 Resumen
Introducción: El paciente con diabetes mellitus tipo 2 (DM2) presenta daños microvasculares mediados por procesos inflamatorios, los cuales pueden ser valorados por el volumen plaquetario medio (VPM). Objetivo: Conocer si el tratamiento del paciente con DM2 mejora el estado proinflamatorio, valorado por medio del VPM. Material y métodos: Estudio retrospectivo, observacional y descriptivo en 139 historias clínicas de pacientes con diagnóstico de DM2 que cumplieron los criterios de selección, analizándose los resultados de laboratorio y las notas médicas, mediante un análisis estadístico con frecuencias, porcentajes para variables cualitativas nominales, con medidas de tendencia central y dispersión en variables cuantitativas, mediante pruebas de chi al cuadrado, de Kruskal-Wallis y de la U de Mann-Whitney. Se respetaron los principios de Belmont, los principios éticos de la Declaración de Helsinki, la Ley General de Salud en México y pautas del Council for International Organizations of Medical Sciences (CIOMS); este protocolo se sometió al Comité de Investigación en Salud 301 y al comité de ética en investigación 3018, con folio R-2021-301-023. Resultados: El promedio de edad de los participantes fue de 55.16 ± 14.208 años, el 60% eran de sexo femenino; la asociación entre el uso de cada fármaco y el VPM fue no significativa (p = 0.568; intervalo de confianza del 95% [IC 95%]: 0.486 a 0.651). Al comparar el grupo de individuos sanos con cada fármaco estudiado se encuentra significación con la dapagliflozina (p = 0.001; IC 95%: 0.000 a 0.021). Conclusión: dapagliflozina en el tratamiento del paciente con DM2 mejora el VPM de forma significativa mediante la disminución de los daños microvasculares mediados por procesos inflamatorios.
Resumen
Introducción: El paciente con diabetes mellitus tipo 2 (DM2) presenta daños microvasculares mediados por procesos inflamatorios, los cuales pueden ser valorados por el volumen plaquetario medio (VPM). Objetivo: Conocer si el tratamiento del paciente con DM2 mejora el estado proinflamatorio, valorado por medio del VPM. Material y métodos: Estudio retrospectivo, observacional y descriptivo en 139 historias clínicas de pacientes con diagnóstico de DM2 que cumplieron los criterios de selección, analizándose los resultados de laboratorio y las notas médicas, mediante un análisis estadístico con frecuencias, porcentajes para variables cualitativas nominales, con medidas de tendencia central y dispersión en variables cuantitativas, mediante pruebas de chi al cuadrado, de Kruskal-Wallis y de la U de Mann-Whitney. Se respetaron los principios de Belmont, los principios éticos de la Declaración de Helsinki, la Ley General de Salud en México y pautas del Council for International Organizations of Medical Sciences (CIOMS); este protocolo se sometió al Comité de Investigación en Salud 301 y al comité de ética en investigación 3018, con folio R-2021-301-023. Resultados: El promedio de edad de los participantes fue de 55.16 ± 14.208 años, el 60% eran de sexo femenino; la asociación entre el uso de cada fármaco y el VPM fue no significativa (p = 0.568; intervalo de confianza del 95% [IC 95%]: 0.486 a 0.651). Al comparar el grupo de individuos sanos con cada fármaco estudiado se encuentra significación con la dapagliflozina (p = 0.001; IC 95%: 0.000 a 0.021). Conclusión: dapagliflozina en el tratamiento del paciente con DM2 mejora el VPM de forma significativa mediante la disminución de los daños microvasculares mediados por procesos inflamatorios.
 Palabras clave
plaquetas, diabetes mellitus, inflamación, volumen plaquetario medio, dapagliflozina
Palabras clave
plaquetas, diabetes mellitus, inflamación, volumen plaquetario medio, dapagliflozina
 Abstract
Abstract
Introduction: The patient with type 2 diabetes mellitus (DM2) presents microvascular damage mediated by inflammatory processes, which can be assessed by the average platelet volume. Objective: To know if the treatment of patients with (DM2) improves the proinflammatory state assessed by means of the mean platelet volume (MPV). Material and methods: Retrospective, observational and descriptive study in 139 records of patients with a diagnosis of DM2 who met the selection criteria, analyzing the laboratory results and medical notes, through a statistical analysis with frequencies, percentages for nominal qualitative variables, with measures of central tendency and dispersion in quantitative variables, with determination of chi2, Kruskal-Wallis and Mann-Whitney U, respecting the Belmont principles, the ethical principles of the Declaration of Helsinki, the General Health Law in Mexico and CIOMS guidelines. This protocol was submitted to the Health Research Committee 301 and the research ethics committee 3018 with folio R-2021-301-023.
Results: Age was 55.16 ± 14.208 years; 60% female; the association between the use of each drug and MPV was non-significant (p = 0.568; 95% CI: 0.486-0.651), when comparing the healthy group with each drug studied the significance is found with dapagliflozin (p = 0.001; 95% CI: 0.000-0.021). Conclusion: Dapagliflozin in the treatment of patients with type 2 diabetes mellitus significantly improves the MPV by reducing microvascular damage mediated by inflammatory processes.
 Key words
Key words
blood platelets, diabetes mellitus, inflammation, mean platelet volume, dapagliflozin
Artículo completo
EL ESTADO PROINFLAMATORIO EN LOS PACIENTES CON DIABETES MELLITUS TIPO 2
(especial para SIIC © Derechos reservados)
Introducción
La prevalencia de diabetes mellitus tipo 2 (DM2) de la población de 20 a 79 años en el mundo es del 8.8%, mientras que en América del Norte es del 10.5%, en América Latina y el Caribe del 9.7%, y en los países miembros de la Organización para la Cooperación y el Desarrollo Económico (OCDE) del 8.3%, de acuerdo con los datos del Banco Mundial en 2019. En México, un 10.3% de la población presenta DM2; en Baja California sur el porcentaje es del 8.4%, y en La Paz, del 9.4%, según datos del Instituto Nacional de Estadística y Geografía (INEGI) de 2018.1-3
El volumen plaquetario medio (VPM) en los pacientes con factores cardiovasculares, como DM2, es de mal pronóstico, lo que aumenta considerablemente el riesgo cardiovascular.
La DM2 cursa con aterosclerosis acelerada, y su patogenia incluye varios mecanismos relacionados con el sistema de coagulación: disfunción endotelial, hiperactividad plaquetaria, generación intravascular de trombina y fibrinólisis disminuida. El resultado es un desequilibrio hemostático que favorece la trombosis, por lo que la DM2se considera un estado protrombótico o trombofílico que, de manera crónica, provoca las alteraciones micro y macrovasculares que están presentes en los pacientes diabéticos, entre las cuales se encuentran la disfunción endotelial, los estados microinflamatorios, los estados protrombóticos y el remodelado vascular.4,5
Independientemente de la etiología, la inflamación contribuye a alterar el balance entre las propiedades procoagulantes y anticoagulantes del endotelio vascular, que adquiere un fenotipo protrombótico; los factores de coagulación aumentan la respuesta inflamatoria mediante la unión a receptores activados por proteasas (PAR) que se localizan en las plaquetas, las células endoteliales, los leucocitos, los fibroblastos y las células musculares lisas.6
En los estados de enfermedad, las plaquetas son células enucleadas con un papel fundamental en la trombosis, la homeostasis y la respuesta inflamatoria. Pueden prepararse positivamente para alcanzar una condición preactivada en la pared del vaso inflamado, interactuando con los leucocitos y el sistema de coagulación, que median la tromboinflamación.7,8 El rol de las plaquetas, como potentes moduladoras y efectoras de los procesos inflamatorios e inmunitarios, se debe a la capacidad que presentan de regular estos procesos, gracias a la habilidad de expresar y secretar una gran variedad de moléculas capaces de atraer e interactuar con los sistemas inmunitario innato y adquirido. Entre los mediadores que afectan a los procesos inflamatorio e inmunitario (y que son liberados por las plaquetas), se encuentran las quimioquinas y las citoquinas almacenadas en los gránulos alfa (como el factor plaquetario 4, RANTES, el factor de crecimiento derivado de plaquetas y el factor de crecimiento transformante-ß), que aseguran el reclutamiento y la adhesión de los leucocitos al sitio injuriado. Otra de las citoquinas proinflamatorias derivadas de las plaquetas es la interleuquina (IL)-1ß, que es producida luego de la activación plaquetaria por el procesamiento del pre-ARNm de la IL-1ß, mediado por la caspasa-1, lo que resulta en la liberación de la IL-1ß funcional. La IL-1ß actúa sobre el endotelio y promueve la expresión de moléculas de adhesión y la liberación de citoquinas que actúan junto al proceso quimiotáctico para estimular la adhesión de neutrófilos y monocitos.9En el momento en que se modifica el entorno interno, la morfología de las plaquetas puede alterarse y desempeñar un papel en ciertos parámetros asociados con estas, los cuales incluyen principalmente el recuento plaquetario (PC, platelet count), el índice plaquetario (PCT, plaquetocrito), la amplitud de distribución plaquetaria (PDW, platelet distribution width) y el VPM.8
Es necesario conocer cuáles son los fármacos de mayor utilidad para disminuir las lesiones microvasculares, pero por el alto costo de los estudios al respecto, es necesario contar con un análisis que nos permita saber el estado proinflamatorio que lleva a la lesión microvascular, como lo es el estudio de las plaquetas. Por ello, se buscan establecer los cambios en las plaquetas como un marcador de seguimiento de la inflamación en esta población, hecho no estudiado aún, sobre todo en pacientes que utilizan los nuevos fármacos que forman parte del tratamiento multimodal, con el objetivo de conocer si el abordaje del paciente con DM2 mejora el estado proinflamatorio, valorado por medio del VPM.
Material y métodos
Estudio retrospectivo, comparativo y descriptivo efectuado sobre 139 historias clínicas de pacientes con diagnóstico de DM2, obtenidas de la consulta externa de medicina familiar de la Unidad de Medicina Familiar No. 34 anexa, Unidad de Medicina de Atención Ambulatoria, de enero a octubre de 2022, utilizando el Sistema de Información de Medicina Familiar (SIMF). Se consideraron aquellas que cumplieron los criterios de selección, revisándose durante un año los resultados de laboratorio: biometría hemática y HbA1c. Se ingresaron los datos de la historia clínica electrónica a una base de datos, tomándose en cuenta las variables de edad, sexo, fármaco, años de tratamiento, índice de masa corporal, estado nutricional, glucosa y HbA1c, así como las notas médicas para su verificación. La estimación de la muestra se realizó de acuerdo con la fórmula para tal fin, mediante la proporción de población infinita, con una frecuencia del 9% para la población de La Paz.
Se realizó un análisis estadístico de las variables, considerando porcentajes para las variables cualitativas nominales, con medidas de tendencia central y dispersión paralas variables cuantitativas, con el uso de las pruebas de chi al cuadrado, de Kruskal-Wallis y de la U de Mann-Whitney; un valor de p igual o menor a 0.05 se consideró como significativo. Se respetaron los principios de Belmont en consideración a la Justicia y Beneficencia, los principios éticos de la Declaración de Helsinki de 1964 en la última revisión de Taipei, Taiwán, de 2016, apegándose al Título Quinto, capítulo único de la Ley General de Salud en México y a las pautas del Council for International Organizations of Medical Sciences(CIOMS); este protocolo se sometió para su evaluación y registro al Comité de Investigación en Salud No. 301 y al comité de ética en investigación No. 3018, con folio R-2021-301-023.
Resultados
En la revisión de las 139 historias clínicas, se encontró que la edad promedio de los pacientes era de 55.16 ± 14.208 años, con un rango de 22-85 años; el 60% eran de sexo masculino, con significación estadística (Tabla 1).
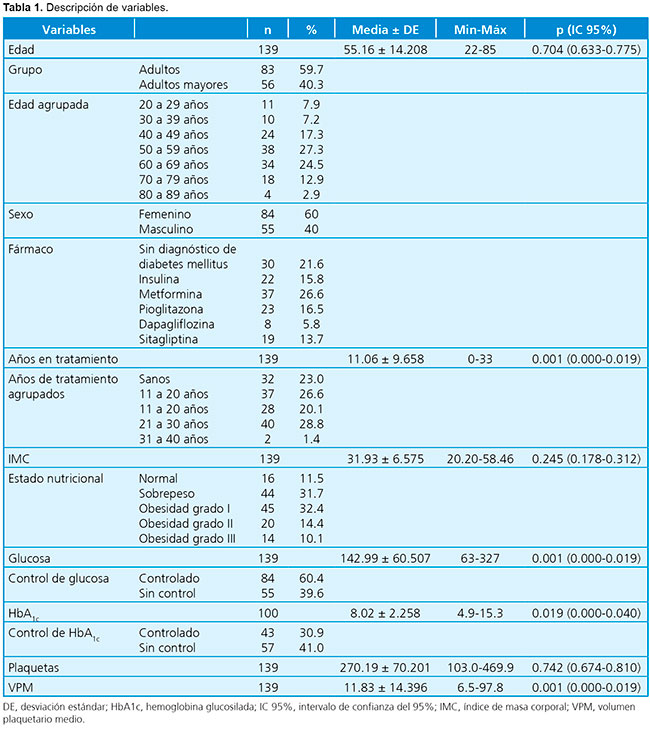
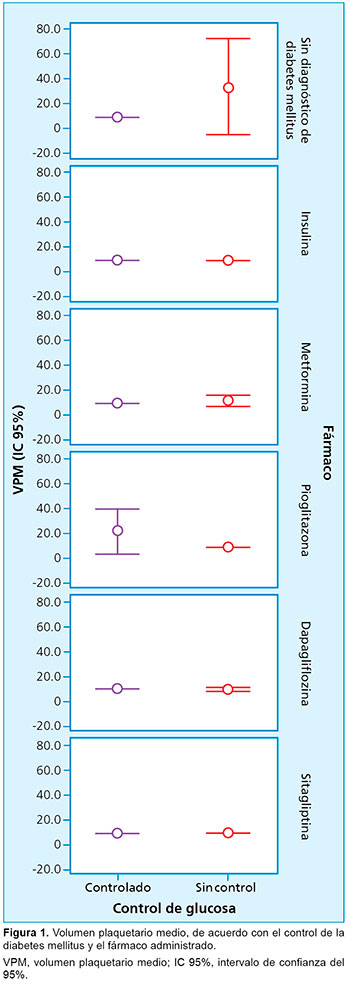
Al comparar el grupo de historias clínicas de pacientes sin diagnóstico de DM2 con cada fármaco estudiado, se encontró significación estadística, medida por la prueba de la U de Mann-Whitney, con el uso de dapagliflozina (p= 0.001; intervalo de confianza del 95% [IC 95%]: 0.000 a 0.021) (Tabla 2). Esto se pone en evidencia en la Figura 1, donde se puede observar la modificación del VPM de los pacientes sin diagnóstico de diabetes mellitus, con valores de glucosa sin control, en comparación con los que se encuentran en tratamiento.

Discusión
Los nuevos abordajes de tratamiento farmacológico para los pacientes con DM2 están enfocados en obtener un control glucémico en el menor tiempo, de forma permanente y con menos efectos secundarios, a través de la acción sobre varias moléculas diana.10En este sentido, tanto las recomendaciones de 2024 de la American Diabetes Association (ADA) como las de otros consensos indican que los abordajes farmacológicos deben evaluarse teniendo en cuenta los factores de riesgo cardiovascular de la persona, así como su estilo de vida y comorbilidades, teniendo como objetivo el control de los niveles de HbA1c.11En el presente estudio se logró el control de la HbA1c en más de la mitad de los pacientes estudiados. Estudios previos a la implementación de los nuevos tratamientos, como el de Roselló-Araya y col.,12 en el que el porcentaje de control de la HbA1c al inicio fue de 8.8% ± 2.1% y al final de 7.8% ± 1.8%, con un valor de p= 0.001, demuestran la falta de control de los pacientes.
La detección y los ensayos de VPM son generalmente válidos en la clínica, ya que se realizan de forma rutinaria. El VPM refleja el tamaño de las plaquetas y la extensión de la inflamación, y se utiliza para revelar la función de las plaquetas. El tamaño de las plaquetas está asociado con la intensidad inflamatoria y puede proporcionar información importante sobre el curso y el pronóstico en muchas afecciones inflamatorias.8,13
El VPM se ha posicionado como marcador diagnóstico, pronóstico y de respuesta al tratamiento en diversos escenarios clínicos, que tienen como común denominador la presencia de un estado proinflamatorio, protrombótico o ambos. Se ha demostrado que el VPM se encuentra elevado en pacientes con síndrome metabólico, en especial en aquellos en los que se agrava la intolerancia a la glucosa y cuando se manifiesta la transición a DM2, presentando una estrecha correlación con los valores de hemoglobina glucosilada A1 (HbA1c). Los niveles de HbA1c< 7%, se relacionan directamente con elevación del VPM e incremento del riesgo de trombosis e inflamación. El incremento en el valor del VPM tiene, además, una estrecha correlación con otros componentes del síndrome metabólico, como la hipercolesterolemia, la obesidad, la esteatosis, la esteatohepatitis y la hipertensión arterial, de mal pronóstico, en especial en lo referente a complicaciones como aterosclerosis, transición de intolerancia a la glucosa a DM2 y disfunción endotelial.14El VPM se eleva de manera significativa en enfermedades que tienen un sustrato inflamatorio, y es un marcador de actividad inflamatoria, evolución y respuesta al tratamiento. Se ha demostrado que el tamaño de las plaquetas y su reactividad se relacionan con la gravedad del proceso inflamatorio dependiendo si este es agudo o crónico.14
En el estudio de Ding y col.15se observó que el VPM se relacionó de forma independiente con el síndrome metabólico en pacientes con DM2. La asociación de VPM con síndrome metabólico fue más fuerte en individuos con sobrepeso, varones o de mayor edad, o bien en aquellos con control glucémico deficiente. Nuestros hallazgos sugieren que, en pacientes con DM2, el VPM puede ser otra característica del síndrome metabólico y, potencialmente, podría usarse como un indicador sustituto de esta alteración en la práctica clínica.
Por su parte, Tecer y col.16encontraron en su estudio que el VPM fue significativamente mayor en enfermedades crónicas como la artritis reumatoidea, tal como sucede con la DM2.Fernando Carrasco y col.17observaron que la inflamación es uno de los mecanismos fisiopatológicos por los cuales se puede condicionar la resistencia a la insulina (RI). La obesidad se ha asociado con un estado inflamatorio crónico leve a moderado, que se manifiesta a nivel sistémico por aumento de los factores inflamatorios y de los leucocitos circulantes. A nivel tisular, y particularmente en el tejido adiposo, se caracteriza por infiltración de células inmunitarias. Considerando que la resistencia insulínica es una alteración metabólica que condiciona la presencia de mayor riesgo cardiovascular y de DM2, es cada vez más frecuente observar en la práctica clínica el uso de fármacos insulinosensibilizadores. Entre estos agentes, el más usado es la metformina, aunque muchos ensayos clínicos también han probado la eficacia de las tiazolidindionas (rosiglitazona, pioglitazona) para tratar estados de resistencia a la insulina y, de esta forma, disminuir sus efectos deletéreos a largo plazo.
También, Rico-Fontalvo y col.18encontraron que el tratamiento de la diabetes mellitus se ha convertido en algo complejo, que requiere la consideración de múltiples aspectos acerca de la condición clínica del paciente antes del inicio de la terapia; la presencia de complicaciones macro y microvasculares en el curso clínico de la enfermedad, además de las diversas comorbilidades que presentan los pacientes, hacen que el tratamiento hipoglucemiante se base tanto en el control de la glucosa como en el abordaje de las comorbilidades, principalmente de forma preventiva, en los procesos de lesiones microvasculares.
Puig Domingo,19 refiere que el mal control glucémico de los individuos que viven con DM2, muestra una reactividad plaquetaria incrementada desde el inicio de la enfermedad, lo cual es “relevante” por su contribución en la morbimortalidad cardiovascular de los pacientes. Un mayor VPM, de acuerdo con Delgado Zambrano y col.,20hace hemostáticamente más activas a las plaquetas (representa un factor de riesgo para complicaciones vasculares, por lo que su evaluación y control ayudan al pronóstico de enfermedades vasculares y complicaciones de los pacientes),de manera que al disminuir el VPM, como se observó en el presente estudio, con la implementación de los tratamientos, se reduce este riesgo en los sujetos con DM2, así como de complicaciones vasculares, y se genera un beneficio a largo plazo.
Esta función plaquetaria, que se encuentra modificada en los pacientes con DM2, asociada con hiperglucemia, se origina por diversas vías independientes del tromboxano A2, por lo que no se ve afectada por el tratamiento antiagregante con el ácido acetilsalicílico o el clopidogrel.19 De allí la importancia de controlar la reactividad plaquetaria también por otras vías, encontrándose evidencia que los factores liberados por las plaquetas en pacientes con un estado alterado, como la DM2, generan un estado procoagulante que se encuentra asociado concompromiso endotelial. Esto se considera como un factor importante para los trastornos de la coagulación, los accidentes cerebrovasculares, el daño renal, la angina inestable y el daño al miocardio, causados por lesiones microvasculares.21
Los resultados obtenidosen el estudio con respecto a los tratamientos de control de la DM2, disminuyeron el VPM en mayor o menor grado, hecho que fue más significativo para la dapagliflozina. Entredichos tratamientos, en ningún caso se ha descrito una ruta directa conocida para la modificación de las plaquetas, por lo que se establece que actúan por otras vías en su control y de la respuesta proinflamatoria, derivada de la actividad plaquetaria.
En cuanto al VPM en la DM2 referido por Delgado Zambrano y col., en su estudio Actividad Plaquetaria en la Diabetes Mellitus: Efectos y consecuencias,20 este fue significativamente mayor, con diferencia de medias estándar (IC 95%: 0.70 a 0.50-0.91; n = 24245). De manera que, en comparación con nuestra investigación, no se encontró significación estadística. Sin embargo, en cuanto al uso de los fármacos, sí se logra mejoría, tanto en los pacientes controlados como en aquellos sin control; esto es significativo para el tratamiento condapagliflozina, lo que corrobora que no todos los tratamientos afectan la actividad plaquetaria.
En el estudio de Jeon y col.,22 con pacientes de 65.5 ± 10 años, es decir con alrededor de una década de diferencia con la población analizada, en la valoración de las plaquetas el resultado fue de 233.2 ± 75.7, mientras que en la presente investigación fue de 270.19 ± 70.201. Estos resultados son significativos para el uso de insulina y para el control por medio de la HbA1c (p < 0.00122). En nuestro caso,fueron no significativos para insulina y significativos para metformina y dapagliflozina; esto pudo deberse a la valoración por medio de las plaquetas y no del VPM.
Como fue observado en estudio de Vasudhevan y col.,23 el VPM se puede utilizar para conocer la función y activación de las plaquetas, lo que refleja tanto el perfil vascular del paciente como el estado proinflamatorio. Se observó que el VPM fue mayor en los pacientes con DM2, valores que fueron significativos en comparación con los sujetos sanos, y que tenían más complicaciones vasculares. De esta forma, se observa una modificación importante del VPM en los pacientes con DM2 que presentaban alteración glucémica, con respecto a los individuos sin diagnóstico de DM2.
En el estudio se pudo registrar que las personas que acuden a la consulta con alteración de los valores de glucosa, tienen también una alteración considerable del VPM. Este último parámetro mejora considerablemente con un buen control de la DM2, y resulta significativo con el uso de dapagliflozina. Esto indica una disminución del proceso proinflamatorioque permite reducir de forma importante el daño a otros órganos blanco en la DM2, con complicaciones leves a largo plazo. Esto se debe a que las plaquetas participan en funciones distintas a la respuesta inflamatoria y la regulación inmunitaria, secretando y transportando una serie de citoquinas y quimioquinas inmunorreguladoras que desempeñan diversas funciones en la hemostasia, la reparación de heridas ylos procesos proinflamatorios y antiinflamatorios, los cuales abarcan desde la liberación de varios mediadores solubles hasta la interacción física con múltiples células inmunitarias.24,25
En el estado proinflamatorio, las plaquetas secretan numerosas citoquinas a la circulación periférica, como el CD40L (también conocido como CD154), lo que desencadena una variedad de reacciones inflamatorias que conducen a la liberación local de moléculas de adhesión, liberando varias quimioquinas y citoquinas tras su activación, que regulan las funciones inflamatorias, como la migración de leucocitos, la fagocitosis y la generación de especies reactivas de oxígeno (ROS), por lo que las plaquetas se han convertido en marcadores importantes de diversas enfermedades.25,26
Las plaquetas son células sanguíneas multifuncionales que desempeñan un papel importante en la inflamación del huésped y en las respuestas inmunitarias a infecciones y lesiones; por ello, las plaquetas pueden ser candidatas a enfoques de control terapéuticos dirigidos innovadores,25 como en la DM2, donde, de acuerdo con el estudio, posterior a la elevación de la glucosa en sangre de forma constante, se produce un estado proinflamatorio crónico que, de no detenerse, puede llevar a un deterioro avanzado del individuo, con daño a órgano blanco en menos tiempo. Por ello, gracias al tratamiento implementado el estado proinflamatorio se detiene, de acuerdo con el nivel de VPM. En el caso de la dapagliflozina, se encuentra una mejora significativa del VPM y, en consecuencia, del estado proinflamatorio, con lo que finalmente el deterioro causado por este proceso disminuye significativamente.
De acuerdo con este estudio, correspondería evaluar el VPM desde el inicio del control del paciente con diabetes, para estar al tanto del estado proinflamatorio y, con ello, la posibilidad de avance de daño de órgano blanco. El médico tratante debe implementar actividades enfocadas a disminuir el daño causadopor el estado proinflamatorio del paciente, mediante un control de bajo costo que ya forma parte del control de la DM2.
Conclusión
El tratamiento del paciente con DM2 mejora el VPM, de forma significativa con la dapagliflozina de entre los tratamientos evaluados, con lo que disminuyen los daños microvasculares mediados por procesos inflamatorios, que pueden estimarse por el VPM. De esta manera,el médico tratante debe llevar adelante una evaluación del VPM para conocer el daño de órgano blanco causado por el estado proinflamatorio, junto con los demás parámetros que presentan los pacientes con DM2.
|
 Bibliografía del artículo
Bibliografía del artículo
1. Núñez Garlobo DL, Ravelo Dopico R, Suárez Rivero B, Perera Lombillo CR, Cruz Rodríguez LO, Miranda Gómez O. Volumen plaquetario medio y posible valor pronóstico en pacientes con infarto agudo de miocardio. Rev Cub Med Mil 48(4):e421, 2019.
2. Banco Mundial [Internet]. Prevalencia de la diabetes (% de la población de 20 a 79 años). 2021 [citado 10 de julio 2021]. Disponible en: https://datos.bancomundial.org/indicator/SH.STA.DIAB.ZS
3. INEGI [Internet]. Prevalencia de Obesidad, Hipertensión y Diabetes para los Municipios de México 2018. 2021 [citado 10 de julio 2021]. Disponible en: https://www.inegi.org.mx/default.html
4. Ramírez RAG, Ramírez MY, Iglesias M. Control glucémico y complicaciones macrovasculares en pacientes con diabetes mellitus tipo II. Invest Medicoquir 12(1):1-17, 2020.
5. Matadamas-Zárate C, Hernández-Jerónimo J, Pérez-Campos E, Majluf-Cruz A. Alteraciones plaquetarias en la diabetes mellitus tipo 2. Arch Cardiol Méx 79(Suppl 2):102-108, 2009.
6. Páramo JA. Respuesta inflamatoria en relación con COVID-19 y otros fenotipos protrombóticos. Reumatología Clínica 18(1):1-4, 2020.
7. Van der Meijden PEJ, Heemskerk JWM. Platelet biology and functions: new concepts and clinical perspectives. Nat Rev Cardiol 16:166-179, 2019.
8. Xu F, Qu S, Wang L, Qin Y. Mean platelet volume (MPV): new diagnostic indices for co-morbidity of tuberculosis and diabetes mellitus. BMC Infect Dis 461:1-9, 2021.
9. D'Atri LP. Funciones inmunoreguladoras de las plaquetas y su rol en la enfermedad autoinmune. Hematología 19:239-244, 2015.
10. Korniluk A, Koper-Lenkiewicz OM, Kami?ska J, Kemona H, Dymicka-Piekarska V. Mean platelet volume (MPV): New perspectives for an old marker in the course and prognosis of inflammatory conditions. Mediators Inflamm 2019:9213074, 2019.
11. Carrillo-Esper R, Carrillo-Córdova DM, Carrillo-Córdova CA, Carrillo-Córdova LD. Volumen plaquetario medio. Su significado en la práctica clínica. Med Sur 20(1):17-20, 2013.
12. Ding, Qinpei MM; Wang, Fangwei MM; Guo, Xintong MM; Liang, Min MD. The relationship between mean platelet volumen and metabolic syndrome in patients with type 2 diabetes mellitus. Medicina 100(13):e25303, 2021.
13. Tecer D, Sezgin M, Kan?k A, ?ncel NA, Çimen ÖB, Biçer A, ?ahin G. Can mean platelet volume and red blood cell distribution width show disease activity in rheumatoid arthritis? Biomark Med 10(9):967-974, 2016.
14. Carrasco N, Galgani F, Reyes J. Síndrome de resistencia a la insulina. estudio y manejo. Rev Med Clin Condes 24(5):827-837, 2013.
15. Rico-Fontalvo J, Daza-Arnedo R, Raad-Sarabia M, Pájaro-Galvis N, Correa-Guerrero J, Villacob-Oviedo A, et al. Agonistas del receptor Glp-1 desde su efecto fisiológico en el sistema incretina hasta su rol en enfermedad renal diabética. Archivos de Medicina 17(2:2):1-12, 2021.
16. Reyes-García R, Moreno-Pérez Ó, Tejera-Pérez C, Fernández-García D, Bellido-Castañeda V, López de la Torre Casares M, et al. Documento de abordaje integral de la diabetes tipo 2. Endocrinol Diabetes Nutr 66:443-458, 2019.
17. American Diabetes Association (ADA). 1. Improving Care and Promoting Health in Populations: Standards of Care in Diabetes-2024. Diabetes 47(Suppl 1):S11-S19, Ene 2024.
18. Roselló-Araya M, Guzmán-Padilla S, Ramírez-Hernández M. Evaluación del control metabólico de personas con diabetes mellitus tipo 2 participantes de una intervención educativa grupal. Resultados de un análisis de conglomerados. PSM 18(2):215-242, 2021.
19. Puig Domingo M. Función plaquetaria e hiperglucemia en el síndrome coronario. Rev Esp Cardiol 67(1):3-5, 2014.
20. Delgado Zambrano JX, Mendoza Satizabal PM, Reyes Baque J. Actividad plaquetaria en la diabetes mellitus: Efectos y consecuencias. Dom Cien 7(2):28-41, 2021.
21. Figuera A, Aliquea M, Valera G, Serroukh N, Ceprían N, Sequera P, et al. Nuevos mecanismos implicados en el desarrollo de la enfermedad cardiovascular en la enfermedad renal crónica. Nefrología 43(1):63-80, 2023.
22. Jeon KH, Jeong YH, Chae IH, Kim BK, Joo HJ, Chang K, et al. Implication of diabetic status on platelet reactivity and clinical outcomes after drug-eluting stent implantation: results from the PTRG-DES consortium. Cardiovasc Diabetol 22(1):245, 2023.
23. Vasudhevan AS, Sumathi DM, Selvakumar AKC, Rajabalaji R. A comparative study of mean platelet volume in diabetic population with and without vascular complication. Indones J Med Lab Sci Technol 5(1):42-52, 2023.
24. Ludwig N, Hilger A, Zarbock A, Rossaint J. Platelets at the crossroads of pro-inflammatory and resolution pathways during inflammation. Cells 11(12):1957, 2022.
25. Chen Y, Zhong H, Zhao Y, Luo X, Gao W. Role of platelet biomarkers in inflammatory response. Biomark Res 8:28, 2020.
26. Baaten C, Nagy M, Bergmeier W, Spronk H, van der Meijden P. Platelet biology and function: plaque erosion vs. rupture. Eur Heart J 45(1)18-31, 2024.
|
|






































