Casos Clínicos
EFECTO ANABOLICO OSEO DEL BORTEZOMIB EN UN PACIENTE CON MIELOMA MULTIPLE: COMUNICACION DE UN CASO
La comunicación de este caso confirma que en los pacientes con mieloma recurrente, la respuesta al agente único bortezomib se asocia a una estimulación espectacular del anabolismo óseo.
Coautores
Federica Cavallo* Larry Suva** Michael Burns*** Guido Tricot**** Shmuel Yaccoby**
MD, University of Torino, Turín, Italia*
PhD, University of Arkansas for Medical Sciences, Little Rock, EE.UU.**
University of Arkansas for Medical Sciences, Little Rock, EE.UU.***
MD, PhD, University of Utah, Salt Lake, EE.UU.****
Federica Cavallo* Larry Suva** Michael Burns*** Guido Tricot**** Shmuel Yaccoby**
MD, University of Torino, Turín, Italia*
PhD, University of Arkansas for Medical Sciences, Little Rock, EE.UU.**
University of Arkansas for Medical Sciences, Little Rock, EE.UU.***
MD, PhD, University of Utah, Salt Lake, EE.UU.****
Clasificación en siicsalud
Artículos originales > Expertos del Mundo >
página /dato/casiic.php/92569
Especialidades










Artículos originales > Expertos del Mundo >
página /dato/casiic.php/92569
Especialidades










Primera edición en siicsalud
2 de febrero, 2010
2 de febrero, 2010
EFECTO ANABOLICO OSEO DEL BORTEZOMIB EN UN PACIENTE CON MIELOMA MULTIPLE: COMUNICACION DE UN CASO
(especial para SIIC © Derechos reservados)
(especial para SIIC © Derechos reservados)
Un hombre de 57 años consultó al médico de familia en noviembre de 1993 después de algunos meses de presentar dolor en la pared torácica y el cuello, lo que finalmente condujo a una evaluación con resonancia magnética (RM) de la columna vertebral. Las secuencias T1 y T2 de la RM cervical mostraron una gran masa en los tejidos blandos paraespinales, adyacente al lado izquierdo de la columna entre los niveles C7 y T1. Una biopsia con aguja fina obtenida bajo control con tomografía computarizada (TC) demostró la presencia de un plasmocitoma. En ese momento, el hemograma del paciente mostró un recuento de leucocitos de 6 600/mm3 y un recuento de plaquetas de 290 000/mm3; la hemoglobina era de 14.1 g/dl, con calcio, creatinina, electrolitos, pruebas de función hepática normales y anhipogammaglobulinemia. La aspiración y biopsia de médula ósea obtenidas de la cresta ilíaca posterior mostraron celularidad normal, con una maduración normal de las series eritroide y mieloide, megacariocitos normales y sin pruebas de plasmacitosis elevada. La evaluación del esqueleto y una RM completa del esqueleto axial identificaron múltiples áreas líticas focales anormales que afectaban las costillas y los huesos largos. El paciente recibió radioterapia por una dosis total de 2 600 cGy en las costillas, 2 400 cGy en el húmero izquierdo y 2 600 cGy en ambos fémures. Fue tratado simultáneamente con quimioterapia VAD1 (vincristina, adriamicina y dexametasona) por un total de nueve ciclos. El tratamiento fue globalmente bien tolerado, con excepción de la aparición de trombosis venosa profunda en la pierna izquierda en junio de 1994, que fue tratada con anticoagulación estándar. Encontrándose bien desde el punto de vista sintomático, fue controlado sin tratamiento entre febrero de 1995 y noviembre de 1999, momento en el cual presentó una tumefacción dolorosa y con aumento de la temperatura local en la parte superior del esternón. El examen físico mostró una lesión expansiva del cuerpo del esternón no asociada a cambios cutáneos. El aspirado y la biopsia de médula ósea de la cresta ilíaca fueron negativos, pero la biopsia del esternón demostró una infiltración plasmocitaria extensa. Desde febrero hasta agosto de 2000, se instituyó quimioterapia con melfalán y prednisona por vía oral, pero a causa de la mala respuesta clínica el tratamiento fue modificado a ciclofosfamida y dexametasona por vía oral.
El paciente se presentó inicialmente en la University of Arkansas for Medical Sciences con un mieloma en recaída en marzo de 2001. El examen físico mostró un individuo normotenso en buen estado general. El examen cardiovascular no tenía nada destacable salvo por un edema simétrico mínimo de las extremidades inferiores; el abdomen era prominente pero no se observaron organomegalias ni anomalías óseas clínicamente aparentes a excepción de sensibilidad y dolor a la palpación del cuerpo del esternón. En ese momento el recuento de glóbulos blancos fue de 3 900/mm3 con diferencial normal, hemoglobina de 13 g/dl, recuento de plaquetas de 165 000/mm3; el perfil químico mostró BUN, creatinina, calcio y pruebas de función hepática normales y una LDH ligeramente elevada de 249 UI/l. Las proteínas totales en suero fueron de 6.1 g/dl con una albúmina de 4.3 g/dl y ß-2M de 1.5 mg/l. El ensayo cuantitativo de inmunoglobulinas en suero demostró panhipogammaglobulinemia con IgG de 454 mg/dl, IgA de 77 mg/dl, IgM de 53 mg/dl. No se detectó ningún componente en suero mediante inmunoelectroforesis; la inmunofijación en suero también fue negativa. La proteinuria total en la muestra de orina de 24 horas fue de 43 mg sin pruebas de proteinuria de Bence-Jones. La celularidad estimada de la médula ósea fue del 60% con menos de 5% de células plasmáticas en el aspirado con biopsia; sin embargo, un aspirado esternal de la masa mostró una plasmocitosis de médula ósea de aproximadamente 30% (tipo Bartl grado 2) con formas asincrónicas.
El análisis citogenético en metafase del aspirado de cresta ilíaca y esternón mostró un cariotipo masculino normal. La evaluación radiológica del esqueleto mostró lesiones en el cuerpo vertebral de T2, las costillas izquierdas 11ª y 12ª y lesiones líticas del fémur izquierdo y el acromion izquierdo; la RM de la cabeza no demostró afección de la base del cráneo ni diploica.
Las imágenes ponderadas en STIR (Short T1 Inversion Recovery) del esqueleto axial identificaron lesiones focales a lo largo del pedículo izquierdo de T1 y T2, y una lesión expansiva focal (3.5 x 1.5 cm) en el manubrio del esternón.
Después de tratar al paciente durante 5 días con inyecciones subcutáneas diarias de 300 µg de factor estimulante de colonias de granulocitos (GCSF) se recogió un total de 15 x 106 CD34+/kg de células madre en sangre periférica. En mayo de 2001 el paciente recibió una dosis alta de melfalán de 200 mg/m2 seguida por la infusión de células madre en sangre periférica (5 x 106 CD34+ve/kg). Luego de una recuperación rápida y sin complicaciones, fue dado de alta 21 días después del trasplante con un recuento leucocitario de 2 200/mm3, Hb de 11.3 g/dl y plaquetas de 108 000/mm3. Aproximadamente 8 semanas más tarde el paciente se sometió a terapia de consolidación con DCEP mensual:2 dexametasona (40 mg vía oral los días 1-4), ciclofosfamida (400 mg/m2 por CI los días 1-4), etopósido (40 mg/m2 por CI los días 1-4) y cisplatino (15 mg/m2 por CI los días 1-4) por un total de 2 ciclos y después se mantuvo únicamente con talidomida (100 mg diarios), que fue suspendida en abril de 2004 por la aparición de neuropatía periférica de grado 2. La evaluación de laboratorio hasta el 15/6/2004 mostró un recuento de glóbulos blancos de 7 700/mm3 con una hemoglobina de 15.1 g/dl, un recuento de plaquetas de 178 000/mm3, glucosa, electrolitos y pruebas de función hepática normales y una elevación mínima de la creatinina (1.2 mg/dl) y nitrógeno ureico en sangre (BUN) (23 mg/dl).
Las proteínas totales en suero fueron de 6.5 g/dl con una albúmina de 4.5 g/dl; las inmunoglobulinas cuantitativas en suero demostraron IgM 66 mg/dl, bajas concentraciones de IgG en 606 y bajas concentraciones de IgA en 77 mg/dl con inmunofijación negativa. La microglobulina ß-2 fue de 1.7 mg/dl, la proteína C-reactiva de 0.59 mg/dl. La proteinuria total en una muestra de orina de 24 horas fue de 144 mg sin componente de Bence-Jones y sin pruebas de proteínas monoclonales en la inmunofijación. Las cadenas livianas libres kappa y lambda en suero fueron de 1.1 mg/dl y 1.2 mg/dl respectivamente, con una relación K/l normal de 0.88 (nl: 0.2-1.6).
Una nueva secuencia de RM T1 y STIR del esqueleto axial mostró una señal hipointensa y homogénea de la médula con lesiones focales antiguas persistentes sin modificaciones de las apófisis transversas de T1 y T2. La RM de seguimiento del esternón mostró una médula homogénea hipointensa con una única anomalía focal que afectaba el manubrio derecho, que disminuía de 3.5 a 2 cm de diámetro máximo. La masa esternal ya no se veía en el examen físico.
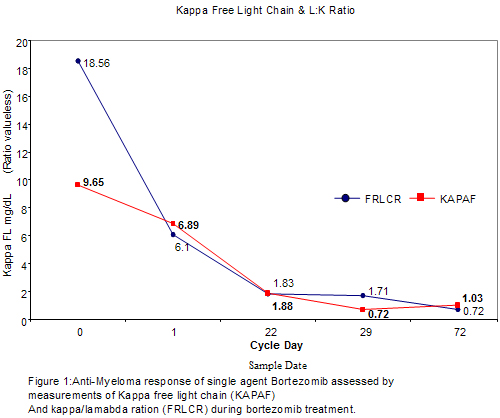
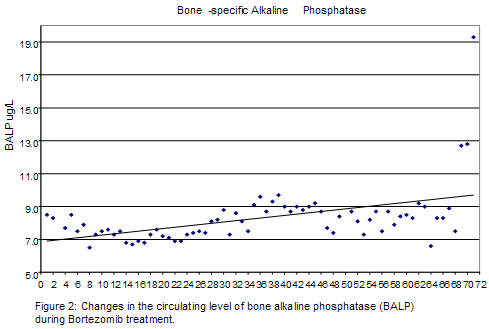
El paciente fue controlado regularmente cada 6 meses con electroforesis de suero y orina, examen de médula ósea, estudios de RM y se consideró en remisión completa hasta junio de 2006 cuando comenzó a referir un nuevo dolor en hombro derecho, que se acompañó por niveles crecientes de marcadores en suero. El examen físico mostró una nueva masa en crecimiento en la articulación esternoclavicular derecha. La RM posterior del esqueleto axial y el esternón mostró las antiguas lesiones T1, T2 y esternales con una nueva masa de tejidos blandos que afectaba la clavícula derecha proximal. La tomografía por emisión de positrones/tomografía computarizada (TEP/TC) de cuerpo entero identificó una captación heterogénea de FDG en la médula roja con un valor de captación estándar (SUV) de 1.6 sobre la base de la masa corporal magra y una lesión nueva en la cabeza de la clavícula derecha que medía 3 x 4 cm. El examen citológico de una muestra de aspiración con aguja fina obtenido de la masa demostró células plasmáticas malignas, principalmente hiperdiploides (índice de ADN 1.22), con exceso de cadenas livianas kappa en el 22% de la población celular. En ese momento el hemograma del paciente mostró un recuento de glóbulos blancos de 5 000/mm3, hemoglobina de 14.5 g/dl y plaquetas de 155 000/mm3; el examen químico del suero mostró concentraciones normales de calcio, potasio y sodio. El proteinograma electroforético y los ensayos cuantitativos de inmunoglobulinas mostraron proteínas totales de 6.5 g/dl con albúmina de 4.5 g/dl, IgG de 1 156 mg/dl, IgA de 191 mg/dl, IgM de 83 mg/dl y sin componente M mensurable; la concentración de microglobulina ß-2 fue de 2.6 mg/l, las cadenas livianas libres kappa fueron de 6.8 mg/dl, las cadenas livianas libres lambda, de 1.02 mg/dl, y se observó una relación K:L elevada de 6.6 (rango 0.2-1.6). No se detectó proteinuria de Bence-Jones en una recolección de orina de 24 horas. Las muestras de aspirado y biopsia de médula ósea de la cresta ilíaca izquierda fueron negativas para mieloma, con un contenido de células plasmáticas inferior al 5%. El análisis por citometría de flujo de la inmunoglobulina citoplasmática y el contenido de ADN no mostró ninguna población aneuploide ni anomalías de las cadenas livianas monoclonales. Se identificó un cariotipo masculino normal en la citogénesis de metafase. Después de conversar acerca de las diferentes intervenciones terapéuticas disponibles con el paciente, decidimos proseguir con la monoterapia con bortezomib igual que para el protocolo UARK 2004-22.3 Después de obtener el consentimiento informado aprobado por el Comité de Revisión Institucional y de suspender todos los tratamientos previos contra el mieloma (incluidos los bifosfonatos), el paciente recibió doxiciclina 100 mg dos veces al día los días -20,-19, -18 y -3, -2, -1 antes del primer ciclo de bortezomib y durante el tercer ciclo. Se obtuvieron muestras para análisis histomorfométricos óseos dinámicos y estáticos en el basal y al final del tercer ciclo de tratamiento. Se administró bortezomib en una dosis de 1.3 mg/m2 los días 1, 4, 8, 11 en un ciclo de 21 días. Durante los tres primeros ciclos el paciente fue controlado con marcadores semanales para mieloma y con perfiles semanales de la química sanguínea. Hacia fines del tercer ciclo de bortezomib, los síntomas y el examen físico del paciente se normalizaron totalmente. Durante el curso del tratamiento se observó una reducción progresiva de las concentraciones de cadenas livianas libres K (isotipo del clon del mieloma), normalización de la relación cadenas libres K/L (Figura 1), juntamente con un aumento paralelo de las concentraciones de fosfatasa alcalina total y específica del hueso (Figura 2).


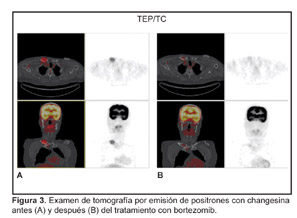
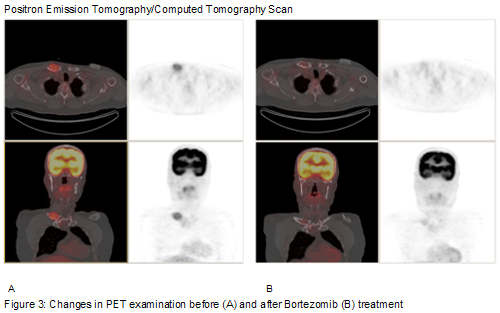
Después de 3 ciclos de bortezomib las secuencias T1 y STIR de la RM del esqueleto axial nuevamente identificaron las antiguas lesiones de la columna torácica; las secuencias esternales junto con la anomalía esternal antigua y no modificada mostraron una lesión clavicular derecha de 2.5 cm que había perdido completamente el componente expansivo del tejido blando. La TEP/TC combinada mostró una captación medular heterogénea leve con una SUV de 1.8; la lesión en la cabeza de la clavícula derecha ya no mostraba captación por encima de la actividad medular de fondo (Figura 3).
En los índices óseos dinámicos basales no se demostró depósito de tetraciclinas. La incorporación de tetraciclina se volvió evidente sólo después del tercer ciclo de tratamiento, lo que refleja el cambio espectacular del recambio óseo inducido por el inhibidor de los proteosomas. Las pruebas histológicas de efectos esqueléticos positivos incluyeron un aumento del espesor osteoide y de la cantidad de osteoblastos tanto en la superficie ósea trabecular como cortical en la muestra postratamiento con bortezomib.
En el momento de esta comunicación, el paciente se mantiene en remisión con la administración mensual de bortezomib. Después de más de un año de iniciado el tratamiento, la evaluación del esqueleto mediante densitometría ósea ha mostrado un aumento del 12% en la columna lumbar. La comunicación de este caso confirma que en los pacientes con mieloma recurrente, la respuesta a la monoterpia con bortezomib se asocia a una estimulación espectacular del anabolismo óseo.
Los autores no manifiestan conflictos de intereses.
El análisis citogenético en metafase del aspirado de cresta ilíaca y esternón mostró un cariotipo masculino normal. La evaluación radiológica del esqueleto mostró lesiones en el cuerpo vertebral de T2, las costillas izquierdas 11ª y 12ª y lesiones líticas del fémur izquierdo y el acromion izquierdo; la RM de la cabeza no demostró afección de la base del cráneo ni diploica.
Las imágenes ponderadas en STIR (Short T1 Inversion Recovery) del esqueleto axial identificaron lesiones focales a lo largo del pedículo izquierdo de T1 y T2, y una lesión expansiva focal (3.5 x 1.5 cm) en el manubrio del esternón.
Después de tratar al paciente durante 5 días con inyecciones subcutáneas diarias de 300 µg de factor estimulante de colonias de granulocitos (GCSF) se recogió un total de 15 x 106 CD34+/kg de células madre en sangre periférica. En mayo de 2001 el paciente recibió una dosis alta de melfalán de 200 mg/m2 seguida por la infusión de células madre en sangre periférica (5 x 106 CD34+ve/kg). Luego de una recuperación rápida y sin complicaciones, fue dado de alta 21 días después del trasplante con un recuento leucocitario de 2 200/mm3, Hb de 11.3 g/dl y plaquetas de 108 000/mm3. Aproximadamente 8 semanas más tarde el paciente se sometió a terapia de consolidación con DCEP mensual:2 dexametasona (40 mg vía oral los días 1-4), ciclofosfamida (400 mg/m2 por CI los días 1-4), etopósido (40 mg/m2 por CI los días 1-4) y cisplatino (15 mg/m2 por CI los días 1-4) por un total de 2 ciclos y después se mantuvo únicamente con talidomida (100 mg diarios), que fue suspendida en abril de 2004 por la aparición de neuropatía periférica de grado 2. La evaluación de laboratorio hasta el 15/6/2004 mostró un recuento de glóbulos blancos de 7 700/mm3 con una hemoglobina de 15.1 g/dl, un recuento de plaquetas de 178 000/mm3, glucosa, electrolitos y pruebas de función hepática normales y una elevación mínima de la creatinina (1.2 mg/dl) y nitrógeno ureico en sangre (BUN) (23 mg/dl).
Las proteínas totales en suero fueron de 6.5 g/dl con una albúmina de 4.5 g/dl; las inmunoglobulinas cuantitativas en suero demostraron IgM 66 mg/dl, bajas concentraciones de IgG en 606 y bajas concentraciones de IgA en 77 mg/dl con inmunofijación negativa. La microglobulina ß-2 fue de 1.7 mg/dl, la proteína C-reactiva de 0.59 mg/dl. La proteinuria total en una muestra de orina de 24 horas fue de 144 mg sin componente de Bence-Jones y sin pruebas de proteínas monoclonales en la inmunofijación. Las cadenas livianas libres kappa y lambda en suero fueron de 1.1 mg/dl y 1.2 mg/dl respectivamente, con una relación K/l normal de 0.88 (nl: 0.2-1.6).
Una nueva secuencia de RM T1 y STIR del esqueleto axial mostró una señal hipointensa y homogénea de la médula con lesiones focales antiguas persistentes sin modificaciones de las apófisis transversas de T1 y T2. La RM de seguimiento del esternón mostró una médula homogénea hipointensa con una única anomalía focal que afectaba el manubrio derecho, que disminuía de 3.5 a 2 cm de diámetro máximo. La masa esternal ya no se veía en el examen físico.
El paciente fue controlado regularmente cada 6 meses con electroforesis de suero y orina, examen de médula ósea, estudios de RM y se consideró en remisión completa hasta junio de 2006 cuando comenzó a referir un nuevo dolor en hombro derecho, que se acompañó por niveles crecientes de marcadores en suero. El examen físico mostró una nueva masa en crecimiento en la articulación esternoclavicular derecha. La RM posterior del esqueleto axial y el esternón mostró las antiguas lesiones T1, T2 y esternales con una nueva masa de tejidos blandos que afectaba la clavícula derecha proximal. La tomografía por emisión de positrones/tomografía computarizada (TEP/TC) de cuerpo entero identificó una captación heterogénea de FDG en la médula roja con un valor de captación estándar (SUV) de 1.6 sobre la base de la masa corporal magra y una lesión nueva en la cabeza de la clavícula derecha que medía 3 x 4 cm. El examen citológico de una muestra de aspiración con aguja fina obtenido de la masa demostró células plasmáticas malignas, principalmente hiperdiploides (índice de ADN 1.22), con exceso de cadenas livianas kappa en el 22% de la población celular. En ese momento el hemograma del paciente mostró un recuento de glóbulos blancos de 5 000/mm3, hemoglobina de 14.5 g/dl y plaquetas de 155 000/mm3; el examen químico del suero mostró concentraciones normales de calcio, potasio y sodio. El proteinograma electroforético y los ensayos cuantitativos de inmunoglobulinas mostraron proteínas totales de 6.5 g/dl con albúmina de 4.5 g/dl, IgG de 1 156 mg/dl, IgA de 191 mg/dl, IgM de 83 mg/dl y sin componente M mensurable; la concentración de microglobulina ß-2 fue de 2.6 mg/l, las cadenas livianas libres kappa fueron de 6.8 mg/dl, las cadenas livianas libres lambda, de 1.02 mg/dl, y se observó una relación K:L elevada de 6.6 (rango 0.2-1.6). No se detectó proteinuria de Bence-Jones en una recolección de orina de 24 horas. Las muestras de aspirado y biopsia de médula ósea de la cresta ilíaca izquierda fueron negativas para mieloma, con un contenido de células plasmáticas inferior al 5%. El análisis por citometría de flujo de la inmunoglobulina citoplasmática y el contenido de ADN no mostró ninguna población aneuploide ni anomalías de las cadenas livianas monoclonales. Se identificó un cariotipo masculino normal en la citogénesis de metafase. Después de conversar acerca de las diferentes intervenciones terapéuticas disponibles con el paciente, decidimos proseguir con la monoterapia con bortezomib igual que para el protocolo UARK 2004-22.3 Después de obtener el consentimiento informado aprobado por el Comité de Revisión Institucional y de suspender todos los tratamientos previos contra el mieloma (incluidos los bifosfonatos), el paciente recibió doxiciclina 100 mg dos veces al día los días -20,-19, -18 y -3, -2, -1 antes del primer ciclo de bortezomib y durante el tercer ciclo. Se obtuvieron muestras para análisis histomorfométricos óseos dinámicos y estáticos en el basal y al final del tercer ciclo de tratamiento. Se administró bortezomib en una dosis de 1.3 mg/m2 los días 1, 4, 8, 11 en un ciclo de 21 días. Durante los tres primeros ciclos el paciente fue controlado con marcadores semanales para mieloma y con perfiles semanales de la química sanguínea. Hacia fines del tercer ciclo de bortezomib, los síntomas y el examen físico del paciente se normalizaron totalmente. Durante el curso del tratamiento se observó una reducción progresiva de las concentraciones de cadenas livianas libres K (isotipo del clon del mieloma), normalización de la relación cadenas libres K/L (Figura 1), juntamente con un aumento paralelo de las concentraciones de fosfatasa alcalina total y específica del hueso (Figura 2).


Después de 3 ciclos de bortezomib las secuencias T1 y STIR de la RM del esqueleto axial nuevamente identificaron las antiguas lesiones de la columna torácica; las secuencias esternales junto con la anomalía esternal antigua y no modificada mostraron una lesión clavicular derecha de 2.5 cm que había perdido completamente el componente expansivo del tejido blando. La TEP/TC combinada mostró una captación medular heterogénea leve con una SUV de 1.8; la lesión en la cabeza de la clavícula derecha ya no mostraba captación por encima de la actividad medular de fondo (Figura 3).

En los índices óseos dinámicos basales no se demostró depósito de tetraciclinas. La incorporación de tetraciclina se volvió evidente sólo después del tercer ciclo de tratamiento, lo que refleja el cambio espectacular del recambio óseo inducido por el inhibidor de los proteosomas. Las pruebas histológicas de efectos esqueléticos positivos incluyeron un aumento del espesor osteoide y de la cantidad de osteoblastos tanto en la superficie ósea trabecular como cortical en la muestra postratamiento con bortezomib.
En el momento de esta comunicación, el paciente se mantiene en remisión con la administración mensual de bortezomib. Después de más de un año de iniciado el tratamiento, la evaluación del esqueleto mediante densitometría ósea ha mostrado un aumento del 12% en la columna lumbar. La comunicación de este caso confirma que en los pacientes con mieloma recurrente, la respuesta a la monoterpia con bortezomib se asocia a una estimulación espectacular del anabolismo óseo.
Los autores no manifiestan conflictos de intereses.
Bone Anabolic Effect of Bortezomib in a Multiple Myeloma Patient: A Case Report.
(especial para SIIC © Derechos reservados)
(especial para SIIC © Derechos reservados)
A 57 year old man presented to his family doctor in November 1993 after a few months’ duration of chest wall and neck pain which eventually prompted an MRI evaluation of the spine. T1 and T2 MRI sequences of the neck revealed a large paraspinal soft tissue mass adjacent to the left side of the spine between the C7 and T1 levels. A fine needle biopsy obtained under CT scan guidance demonstrated the presence of a plasmacytoma. At that time, the patient’s hemogram showed a white blood cell count of 6.6 K/μl and a platelet count of 290 K/μl; his hemoglobin was 14.1 g/dl, with normal calcium, creatinine, electrolytes, liver function tests, and panhypogammaglobulenemia. Bone marrow aspirate and biopsy obtained from the posterior iliac crest showed normal cellularity, with a normal maturation of erythroid and myeloid series, normal megakaryocytes and no evidence of increased plasmacytosis. Skeletal survey and complete MRI of the axial skeleton identified multiple abnormal focal lytic areas involving the ribs and long bones. The patient received radiation therapy for a total dose of 2 600 cGy to the ribs, 2 400 cGy to the left humerus, and 2 600 cGy to both femurs. The patient was concomitantly treated with VAD1 (vincristine, adriamycin, and dexamethasone) chemotherapy for a total of nine cycles. The treatment was overall well tolerated with the exception of the development of left leg deep venous thrombosis in June 1994 which was treated with standard anticoagulation.
Symptomatically well, he was followed without treatment between February 1995 and November 1999, at which point the patient developed painful and somewhat warm swelling of the upper part of the sternum. Physical exam revealed a large expansile lesion of the body of sternum not associated to skin changes. Bone marrow aspirate and biopsy from the iliac crest were negative, but the sternal biopsy demonstrated extensive plasmacytosis. From February till August 2000, chemotherapy with oral melphalan and prednisone was instituted, but because of poor clinical response the treatment was later switched to oral cyclophosphamide and dexamethasone. The patient first presented to the University of Arkansas for Medical Sciences with relapse myeloma in March 2001. Physical examination revealed a well developed normotensive individual. Cardiovascular examination was unremarkable except for minimal symmetric edema of the lower extremities; the abdomen was protruberant but no organomegaly was appreciated no bone abnormalities were clinically evident except for tenderness and swelling of the body of the sternum. At the time, his white cell count was 3.9 K/μl with normal differential hemoglobin 13 g/dl, platelet count 165 K/μl; chemistry profile showed normal BUN, creatinine, calcium, liver function tests and a slightly elevated LDH of 249 IU/l. Serum total protein was 6.1 g/dl with an albumin of 4.3 g/dl and beta-2M of 1.5 mg/l. Quantitative serum immunoglobulin assay demonstrated panhypogammaglobulinemia with IgG 454 mg/dl, IgA 77 mg/dl, IgM 53 mg/dl. No M component in the serum was detected by immunoelectrophoresis; serum immunofixation was also negative. Total proteinuria in 24-hour urine collection was 43 mg with no evidence of Bence-Jones protein. Estimated cellularity of the bone marrow was 60% with less than 5% plasmacells in the aspirate and biopsy; however, a sternal aspirate of the mass revealed approximately 30% bone marrow plasmacytosis (Bartl grade 2 type) with asynchronous forms. Metaphase Cytogenetic analysis of both iliac crest and the sternal aspirate showed normal male karyotype. Radiological evaluation by skeletal survey showed lesions at T2 vertebral body, 11th and 12th left ribs, and lytic lesions in the left femur and left acromial process; the MRI of the head did not demonstrate skull base or diploic involvement. STIR (Short TI Inversion Recovery) weighted images of the axial skeleton identified focal lesions along the left pedicle of T1 and T2, and a focal expansive lesion (3.5 x 1.5cm) in the manubrium of the sternum.
After treating the patient for 5 days with daily subcutaneous injections of 300 mcg of granulocyte colony stimulating factor (GCSF) a total of 15 x 106 CD34+/kg blood peripheral stem cells (BPSC) were collected. In May 2001 the patient then received high dose melphalan at 200 mg/m2 followed by infusion of BPSC (5 x 106 CD34+ve/kg). After a rapid and uneventful recovery, he was discharged home on day +21 post transplant with a WBC 2.2 K/μl, Hb 11.3 g/dl and platlets 108 K/μl. About 8 weeks later, the patient underwent consolidation therapy with monthly DCEP2, dexamethasone (40 mg orally on days 1-4), cyclophosphamide (400 mg/m2 by CI on days 1-4), etoposide (40 mg/m2 by CI on days 1-4), and cisplatin (15 mg/m2 by CI on days 1-4) for a total of 2 cycles and then maintained on single agent thalidomide (100 mg daily) which was discontinued in April 2004 because of the development grade 2 peripheral neuropathy. Laboratory evaluation as of 6/15/04 revealed a white cell count of 7.7k/μl with hemoglobin 15.1 g/dl, platelet count 178 000 k/μl a normal glucose, electrolytes, and liver function tests and minimal elevation of creatinine (1.2 mg/dl), and BUN (23 mg/dl) . Total serum protein was 6.5 g/dl with albumin of 4.5 g/dl; quantitative serum immunoglobulins demonstrated IgM 66mg/dl, low IgG levels at 606 and low IgA levels at 77 mg/dl with negative immunofitation. Beta-2 microglobulin was 1.7 mg/dl, CRP was 0.59 mg/dl. Total proteinuria in 24 hour urine collection was 144 mg with no Bence-Jones component and no evidence of monoclonal protein on immunofixation. Serum Kappa and Lambda free light chains were 1.1 mg/dl and 1.2 mg/dl respectively, with a normal K/L ration of 0.88 (nl:0.2-1.6).
A repeat TI and STIR MRI sequence of the axial skeleton showed a hypointense and homogeneous marrow signal with persistent and unchanged old focal lesions of the transverse processes of T1 and T2. The follow up MRI of the sternum demonstrated a hypointense homogeneous marrow with a single focal abnormality involving the right manubrim which decreased from 3.5 to 2 cm in maximum diameter. The sternal mass was no longer evident on physical exam.
The patient was regularly followed every 6 months with serum and urine electrophoresis, bone marrow examination, MRI studies and felt to be in complete remission until June 2006 when he started to complain of a new right shoulder pain, which was accompanied by rising serum markers. Physical examination revealed a new enlarging mass at the right clavicolar sternal joint. Subsequent MRI of the axial skeleton and sternum revealed the old T1, T2, and sternal lesions with a new soft tissue mass involving the proximal right clavicle. Whole body combined positron emission tomography/computed tomography scan (PET/CT) identified heterogeneous FDG uptake in the red marrow with an SUV of 1.6 based upon lean body mass and one breakout lesion at the right clavicular head site measuring 3 x 4 cm. A cytological exam of a fine needle aspiration sample obtained from the mass demonstrated malignant plasma cells, mainly hyperdiploid (DNA index 1.22), with kappa light chain excess in 22% of the cell population. At the time the hemogram of the patient showed white blood cell count of 5.0 K/μl, hemoglobin 14.5 g/dl, and platelets of 155 K/μl; serum chemistries reported normal calcium, potassium and, sodium levels. Serum protein electrophoresis and quantitative immunoglobulin assays revealed a total protein of 6.5 g/dl with albumin of 4.5 g/dl,IgG 1156 mg/dl, IgA 191 mg/dl, IgM 83 mg/dl and no measurable M component; Beta-2 microglobulin level was 2.6 mg/l, kappa free light chains 6.8 mg/dl, lambda free light chains 1.02 mg/dl, and an elevated K:L ratio of 6.6 (range 0.2-1.6). No Bence-Jones proteinuria was detected in 24-hour urine collection. Bone marrow aspirate and biopsy samples from the left iliac crest were negative for myeloma with plasma cell content less than 5%. Flow cytometric analysis of cytoplasmic immunoglobulin and DNA content demonstrated no aneuploid population or monoclonal light chain abnormalities. A normal male karyotype was identified on metaphase cytogenetics. After discussing the available different therapeutic interventions with the patient, we decided to proceed with single agent bortezomib, as per protocol UARK 2004-223. After obtaining IRB approved informed consent and discontinuation of all previous antimyeloma treatments (including biphosphonates), the patient received doxycycline 100 mg BID on days -20, -19, -18, and -3,-2-1 prior the first and during the third bortezomib cycle. Samples for dynamic and static bone histomorphometric analyses were obtained at baseline and at the end of the third cycle of treatment.
Bortezomib was given at the dose of 1.3 mg/m2 on days 1, 4, 8, 11 on a 21-day cycle. For the first 3 cycles the patient was followed with weekly myeloma markers and by weekly chemistry prophyles. By the end of the third bortezomib cycle, the patient’s symptoms and physical exam completely normalized. During the course of treatment we observed a progressive reduction of K free light chain levels (myeloma clone isotype), normalization of free K/L ratio (Figure 1); along with a parallel increase in total and bone specific alkaline phosphatase levels (Figure 2).
After 3 cycles of bortezomib the T1 and STIR sequences of the MRI of the axial skeleton again identified the old thoracic spine lesions; sternal sequences along with the old and unchanged sternal abnormality revealed a 2.5 cm right clavicular lesion which had completely lost the expansile soft tissue component. Combined PET/CT scan demonstrated a mild heterogeneous marrow uptake with a SUV of 1.8; the right clavicular head lesion no longer showed uptake above background marrow activity (Figure 3).
At baseline dynamic bone indices demonstrated no tetracycline deposition. Tetracycline incorporation became evident only after the third cycle of treatment, reflecting the dramatic change in bone turnover induced by the proteasome inhibitor. Histological evidence of positive skeletal effects included increased osteoid thickness and osteoblast number on both the trabecular and cortical bone surfaces in the post bortezomib treatment sample. At the time of this report, the patient remains in remission on monthly bortezomib administration. After more then one year from starting therapy, skeletal evaluation using bone densitometry (DXA) has shown an increase of 12% at the lumbar spine. This case report confirms that in relapsing myeloma patients, the response to single agent bortezomib is associated to a dramatic stimulation of bone anabolism.
Symptomatically well, he was followed without treatment between February 1995 and November 1999, at which point the patient developed painful and somewhat warm swelling of the upper part of the sternum. Physical exam revealed a large expansile lesion of the body of sternum not associated to skin changes. Bone marrow aspirate and biopsy from the iliac crest were negative, but the sternal biopsy demonstrated extensive plasmacytosis. From February till August 2000, chemotherapy with oral melphalan and prednisone was instituted, but because of poor clinical response the treatment was later switched to oral cyclophosphamide and dexamethasone. The patient first presented to the University of Arkansas for Medical Sciences with relapse myeloma in March 2001. Physical examination revealed a well developed normotensive individual. Cardiovascular examination was unremarkable except for minimal symmetric edema of the lower extremities; the abdomen was protruberant but no organomegaly was appreciated no bone abnormalities were clinically evident except for tenderness and swelling of the body of the sternum. At the time, his white cell count was 3.9 K/μl with normal differential hemoglobin 13 g/dl, platelet count 165 K/μl; chemistry profile showed normal BUN, creatinine, calcium, liver function tests and a slightly elevated LDH of 249 IU/l. Serum total protein was 6.1 g/dl with an albumin of 4.3 g/dl and beta-2M of 1.5 mg/l. Quantitative serum immunoglobulin assay demonstrated panhypogammaglobulinemia with IgG 454 mg/dl, IgA 77 mg/dl, IgM 53 mg/dl. No M component in the serum was detected by immunoelectrophoresis; serum immunofixation was also negative. Total proteinuria in 24-hour urine collection was 43 mg with no evidence of Bence-Jones protein. Estimated cellularity of the bone marrow was 60% with less than 5% plasmacells in the aspirate and biopsy; however, a sternal aspirate of the mass revealed approximately 30% bone marrow plasmacytosis (Bartl grade 2 type) with asynchronous forms. Metaphase Cytogenetic analysis of both iliac crest and the sternal aspirate showed normal male karyotype. Radiological evaluation by skeletal survey showed lesions at T2 vertebral body, 11th and 12th left ribs, and lytic lesions in the left femur and left acromial process; the MRI of the head did not demonstrate skull base or diploic involvement. STIR (Short TI Inversion Recovery) weighted images of the axial skeleton identified focal lesions along the left pedicle of T1 and T2, and a focal expansive lesion (3.5 x 1.5cm) in the manubrium of the sternum.
After treating the patient for 5 days with daily subcutaneous injections of 300 mcg of granulocyte colony stimulating factor (GCSF) a total of 15 x 106 CD34+/kg blood peripheral stem cells (BPSC) were collected. In May 2001 the patient then received high dose melphalan at 200 mg/m2 followed by infusion of BPSC (5 x 106 CD34+ve/kg). After a rapid and uneventful recovery, he was discharged home on day +21 post transplant with a WBC 2.2 K/μl, Hb 11.3 g/dl and platlets 108 K/μl. About 8 weeks later, the patient underwent consolidation therapy with monthly DCEP2, dexamethasone (40 mg orally on days 1-4), cyclophosphamide (400 mg/m2 by CI on days 1-4), etoposide (40 mg/m2 by CI on days 1-4), and cisplatin (15 mg/m2 by CI on days 1-4) for a total of 2 cycles and then maintained on single agent thalidomide (100 mg daily) which was discontinued in April 2004 because of the development grade 2 peripheral neuropathy. Laboratory evaluation as of 6/15/04 revealed a white cell count of 7.7k/μl with hemoglobin 15.1 g/dl, platelet count 178 000 k/μl a normal glucose, electrolytes, and liver function tests and minimal elevation of creatinine (1.2 mg/dl), and BUN (23 mg/dl) . Total serum protein was 6.5 g/dl with albumin of 4.5 g/dl; quantitative serum immunoglobulins demonstrated IgM 66mg/dl, low IgG levels at 606 and low IgA levels at 77 mg/dl with negative immunofitation. Beta-2 microglobulin was 1.7 mg/dl, CRP was 0.59 mg/dl. Total proteinuria in 24 hour urine collection was 144 mg with no Bence-Jones component and no evidence of monoclonal protein on immunofixation. Serum Kappa and Lambda free light chains were 1.1 mg/dl and 1.2 mg/dl respectively, with a normal K/L ration of 0.88 (nl:0.2-1.6).
A repeat TI and STIR MRI sequence of the axial skeleton showed a hypointense and homogeneous marrow signal with persistent and unchanged old focal lesions of the transverse processes of T1 and T2. The follow up MRI of the sternum demonstrated a hypointense homogeneous marrow with a single focal abnormality involving the right manubrim which decreased from 3.5 to 2 cm in maximum diameter. The sternal mass was no longer evident on physical exam.
The patient was regularly followed every 6 months with serum and urine electrophoresis, bone marrow examination, MRI studies and felt to be in complete remission until June 2006 when he started to complain of a new right shoulder pain, which was accompanied by rising serum markers. Physical examination revealed a new enlarging mass at the right clavicolar sternal joint. Subsequent MRI of the axial skeleton and sternum revealed the old T1, T2, and sternal lesions with a new soft tissue mass involving the proximal right clavicle. Whole body combined positron emission tomography/computed tomography scan (PET/CT) identified heterogeneous FDG uptake in the red marrow with an SUV of 1.6 based upon lean body mass and one breakout lesion at the right clavicular head site measuring 3 x 4 cm. A cytological exam of a fine needle aspiration sample obtained from the mass demonstrated malignant plasma cells, mainly hyperdiploid (DNA index 1.22), with kappa light chain excess in 22% of the cell population. At the time the hemogram of the patient showed white blood cell count of 5.0 K/μl, hemoglobin 14.5 g/dl, and platelets of 155 K/μl; serum chemistries reported normal calcium, potassium and, sodium levels. Serum protein electrophoresis and quantitative immunoglobulin assays revealed a total protein of 6.5 g/dl with albumin of 4.5 g/dl,IgG 1156 mg/dl, IgA 191 mg/dl, IgM 83 mg/dl and no measurable M component; Beta-2 microglobulin level was 2.6 mg/l, kappa free light chains 6.8 mg/dl, lambda free light chains 1.02 mg/dl, and an elevated K:L ratio of 6.6 (range 0.2-1.6). No Bence-Jones proteinuria was detected in 24-hour urine collection. Bone marrow aspirate and biopsy samples from the left iliac crest were negative for myeloma with plasma cell content less than 5%. Flow cytometric analysis of cytoplasmic immunoglobulin and DNA content demonstrated no aneuploid population or monoclonal light chain abnormalities. A normal male karyotype was identified on metaphase cytogenetics. After discussing the available different therapeutic interventions with the patient, we decided to proceed with single agent bortezomib, as per protocol UARK 2004-223. After obtaining IRB approved informed consent and discontinuation of all previous antimyeloma treatments (including biphosphonates), the patient received doxycycline 100 mg BID on days -20, -19, -18, and -3,-2-1 prior the first and during the third bortezomib cycle. Samples for dynamic and static bone histomorphometric analyses were obtained at baseline and at the end of the third cycle of treatment.
Bortezomib was given at the dose of 1.3 mg/m2 on days 1, 4, 8, 11 on a 21-day cycle. For the first 3 cycles the patient was followed with weekly myeloma markers and by weekly chemistry prophyles. By the end of the third bortezomib cycle, the patient’s symptoms and physical exam completely normalized. During the course of treatment we observed a progressive reduction of K free light chain levels (myeloma clone isotype), normalization of free K/L ratio (Figure 1); along with a parallel increase in total and bone specific alkaline phosphatase levels (Figure 2).


After 3 cycles of bortezomib the T1 and STIR sequences of the MRI of the axial skeleton again identified the old thoracic spine lesions; sternal sequences along with the old and unchanged sternal abnormality revealed a 2.5 cm right clavicular lesion which had completely lost the expansile soft tissue component. Combined PET/CT scan demonstrated a mild heterogeneous marrow uptake with a SUV of 1.8; the right clavicular head lesion no longer showed uptake above background marrow activity (Figure 3).

At baseline dynamic bone indices demonstrated no tetracycline deposition. Tetracycline incorporation became evident only after the third cycle of treatment, reflecting the dramatic change in bone turnover induced by the proteasome inhibitor. Histological evidence of positive skeletal effects included increased osteoid thickness and osteoblast number on both the trabecular and cortical bone surfaces in the post bortezomib treatment sample. At the time of this report, the patient remains in remission on monthly bortezomib administration. After more then one year from starting therapy, skeletal evaluation using bone densitometry (DXA) has shown an increase of 12% at the lumbar spine. This case report confirms that in relapsing myeloma patients, the response to single agent bortezomib is associated to a dramatic stimulation of bone anabolism.
Maurizio Zangari, University of Arkansas for Medical Sciences Myeloma Institute for Research and Therapy, AR 72205, Little Rock, EE.UU.,
e-mail: zangarimaurizio@uams.edu
1. Anderson H, Scarffe JH, Lambert M, et al. VAD chemotherapy-toxicity and efficacy-in patients with multiple myeloma and other lymphoid malignancies. Hematol Oncol 5(3):213-22, 1987.
2. Fassas A, Gojo I, Rapoport A, et al. Pulmonary toxicity syndrome following CDEP (cyclophosphamide, dexamethasone, etoposide, cisplatin) chemotherapy. Bone Marrow Transplant 28(4):399-403, 2001.
3. Zangari M, Cavallo F, Suva L, et al. Prospective evaluation of the bone anabolic effect of bortezomib in relapsed multiple myeloma. Blood 110:798a, 2007.
Artículos publicados por el autor
(selección)
Zangari M, Yaccoby S, Cavallo F, Esseltine D, Tricot G. Response to bortezomib and activation of osteoblasts in multiple myeloma Clinical Lymphoma Myeloma 7(7):109-114, 2007
Zangari M, Elice F, Fink L, Tricot G. Thrombosis in multiple myeloma Expert Review in Anticancer Therapy 7(7):307-315, 2007
Zangari M, Elice F, Fink L, Tricot G. Hemostatic dysfunction in paraproteinemias and amyloidosis Seminars in Thrombosis and Hemostasis 33(33):339-349, 2007
Zangari M, Esseltine D, Cavallo F, Neuwirth R, Elice F, Burns MJ, Yaccoby S, Richardson P, Sonneveld P, Tricot G. Predictive value of alkaline phosphatase for response and time to progression in bortezomib-treated multiple myeloma patients American Journal Hematology 82(82):831-833, 2007
Zangari M, Yaccoby S, Cavallo F, Esseltine D, Tricot G. Response to bortezomib and activation of osteoblasts in multiple myeloma Clinical Lymphoma Myeloma 7(7):109-114, 2007
Zangari M, Elice F, Fink L, Tricot G. Thrombosis in multiple myeloma Expert Review in Anticancer Therapy 7(7):307-315, 2007
Zangari M, Elice F, Fink L, Tricot G. Hemostatic dysfunction in paraproteinemias and amyloidosis Seminars in Thrombosis and Hemostasis 33(33):339-349, 2007
Zangari M, Esseltine D, Cavallo F, Neuwirth R, Elice F, Burns MJ, Yaccoby S, Richardson P, Sonneveld P, Tricot G. Predictive value of alkaline phosphatase for response and time to progression in bortezomib-treated multiple myeloma patients American Journal Hematology 82(82):831-833, 2007
Está expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC.
ua91218































