Bibliografía del artículo
Bibliografía del artículo
1. Czaja AJ. Diverse manifestations and evolving treatments of autoimmune hepatitis. Minerva Gastroenterol Dietol 51;313-333, 2005.
2. Krawitt EL. Autoimmune hepatitis. N Engl J Med 354:54-66, 2006.
3. Czaja AJ. Treatment of autoimmune hepatitis. Semin Liver Dis 22:365-377, 2002.
4. Manns MP, Vogel A. Autoimmune hepatitis, from mechanisms to therapy. Hepatology 43(Suppl.1):S132-S144, 2006.
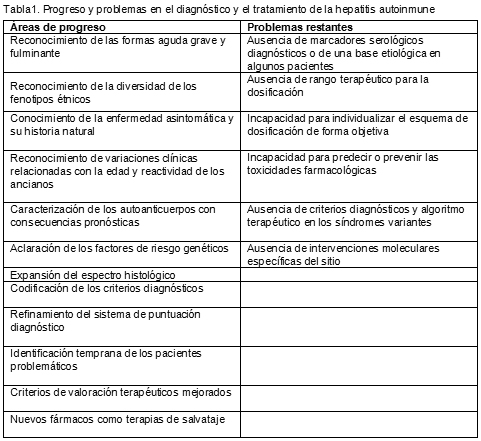
5. Czaja AJ. Evolving concepts in the diagnosis, pathogenesis and treatment of autoimmune hepatitis. Minerva Gastroenterol Dietol 53:43-78, 2007.
6. Montano Loza A, Czaja AJ. Current therapy for autoimmune hepatitis. Nature Clin Pract Gastroenterol Hepatol 4:202-214, 2007.
7. Czaja AJ, Freese DK. Diagnosis and treatment of autoimmune hepatitis. Hepatology 36:479-497, 2002.
8. Czaja AJ, Bianchi FB, Carpenter HA, et al. Treatment challenges and investigational opportunities in autoimmune hepatitis. Hepatology 41:207-215, 2005.
9. Gregorio GV, Portmann B, Reid F, et al. Autoimmune hepatitis in childhood. A 20 year survey. Hepatology 25:541-547, 1997.
10. Schramm C, Kanzler S, Meyer zum Buschenfelde KH, Galle PR, Lohse AW. Autoimmune hepatitis in the elderly. Am J Gastroenterol 96:1587-1591, 2001.
11. Verslype C, George C, Buchel E, Nevens F, Van Steenbergen W, Fevery J. Diagnosis and treatment of autoimmune hepatitis at age 65 and older. Aliment Pharmacol Ther 21:695-699, 2005.
12. Granito A, Muratori L, Pappas G, Muratori P, Ferri S, Cassani F, et al. Clinical features of type 1 autoimmune hepatitis in elderly Italian patients. Aliment Pharmacol Ther 21:1273-1277, 2005.
13. Al-Chalabi T, Boccato S, Portmann BC, McFarlane IG, Heneghan MA. Autoimmune hepatitis (AIH) in the elderly: a systematic retrospective analysis of a large group of consecutive patients with definite AIH followed at a tertiary referral center. J Hepatol 45:575-583, 2006.
14. Miyake T, Miyaoka H, Abe M, et al. Clinical characteristics of autoimmune hepatitis in older aged patients. Hepatol Res 36:139-142, 2006.
15. Czaja AJ, Carpenter HA. Distinctive clinical phenotype and treatment outcome of type 1 autoimmune hepatitis in the elderly. Hepatology 43:532-538, 2006.
16. Kerkar N, Hadzic N, Davies ET, et al. De-novo autoimmune hepatitis after liver transplantation. Lancet 353:409-413, 1998.
17. Jones DEJ, James OFW, Portmann B, Burt AD, Williams R, Hudson M. Development of autoimmune hepatitis following liver transplantation for primary biliary cirrhosis. Hepatology 30:53-57, 1999.
18. Angulo P, El-Amin O, Carpenter HA, Lindor KD. Development of autoimmune hepatitis in the setting of long-standing primary biliary cirrhosis. Am J Gastroenterol 96:3021-3027, 2001.
19. Heneghan MA, Portmann BC, Norris SM, et al. Graft dysfunction mimicking autoimmune hepatitis following liver transplantation in adults. Hepatology 34:464-470, 2001.
20. Czaja AJ. Frequency and nature of the variant syndromes of autoimmune liver disease. Hepatology 28:360-365, 1998.
21. Czaja AJ, Carpenter HA, Santrach PJ, Moore SB. Autoimmune cholangitis within the spectrum of autoimmune liver disease. Hepatology 31:1231-1238, 2000.
22. Czaja AJ, Carpenter HA. Autoimmune hepatitis with incidental histologic features of bile duct injury. Hepatology 34:659-665, 2001.
23. Czaja AJ, Muratori P, Muratori L, Carpenter HA, Bianchi FB. Diagnostic and therapeutic implications of bile duct injury in autoimmune hepatitis. Liver International 24:322-329, 2004.
24. Chazouilleres O, Wendum D, Serfaty L, Rosmorduc O, Poupon R. Long term outcome and response to therapy of primary biliary cirrhosis-autoimmune hepatitis overlap syndrome. J Hepatol 44:400-406, 2006.
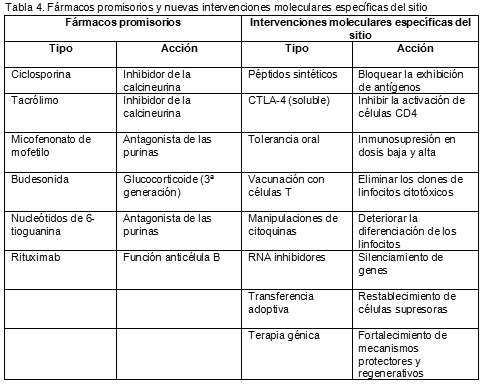
25. Czaja AJ. Treatment strategies in autoimmune hepatitis. Clin Liver Dis 6:799-824, 2002.
26. Czaja AJ. Emerging treatments for autoimmune hepatitis. Current Drug Targets-Inflammation & Allergy 1:317-326, 2002.
27. Vierling JM, Flores PA. Evolving new therapies of autoimmune hepatitis. Clin Liver Dis 6:825-850, 2002.
28. Davis GL, Czaja AJ, Baggenstoss AH, Taswell HF. Prognostic and therapeutic implications of extreme serum aminotransferase elevation in chronic active hepatitis. Mayo Clin Proc 57:303-309, 1982.
29. Crapper RM, Bhathal PS, Mackay IR, Frazer IH. "Acute" autoimmune hepatitis. Digestion 34:216-225, 1986.
30. Amontree, JS, Stuart, TD, Bredfeldt, JE. Autoimmune chronic active hepatitis masquerading as acute hepatitis. J Clin Gastroenterol 11:303-307, 1989.
31. Maggiore G, Porta G, Bernard O, et al. Autoimmune hepatitis with initial presentation as acute hepatic failure in young children. J Pediatr 116:280-282, 1990.
32. Porta G, Da Costa Gayotto LC, Alvarez F. Anti-liver-kidney microsome antibody-positive autoimmune hepatitis presenting as fulminant liver failure. J Ped Gastroenterol Nutr 11:138-140, 1990.
33. Nikias GA, Batts KP, Czaja AJ. The nature and prognostic implications of autoimmune hepatitis with an acute presentation. J Hepatol 21:866-871, 1994.
34. Burgart LJ, Batts KP, Ludwig J, Nikias GA, Czaja AJ. Recent onset autoimmune hepatitis: biopsy findings and clinical correlations. Am J Surg Path 19:699-708, 1995.
35. Herzog D, Rasquin-Weber AM, Debray D, Alvarez F. Subfulminant hepatic failure in autoimmune hepatitis type 1: an unusual form of presentation. J Hepatol 27:578-582, 1997.
36. Viruet EJ, Torres EA. Steroid treatment in fulminant hepatic failure secondary to autoimmune hepatitis. P R Health Sci J 17:297-300, 1998.
37. Ichai P, Duclos-Vallee JC, Guettier C, et al. Usefulness of corticosteroids for the treatment of severe and fulminant forms of autoimmune hepatitis. Liver Transpl (in press).
38. Czaja AJ. Corticosteroids or not in severe acute or fulminant autoimmune hepatitis: therapeutic brinksmanship and the point beyond salvation (editorial). Liver Transpl (in press).
39. Gonzalez-Koch A, Czaja AJ, Carpenter HA, et al. Recurrent autoimmune hepatitis after orthotopic liver transplantation. Liver Transpl 7:302-310, 2001.
40. Lim KN, Casanova RL, Boyer TD, Bruno CJ. Autoimmune hepatitis in African Americans: presenting features and responses to therapy. Am J Gastroenterol 96:3390-3394, 2001.
41. Hurlburt KJ, McMahon BJ, Deubner H, Hsu-Trawinski B, Williams JL, Kowdley KV. Prevalence of autoimmune liver disease in Alaska natives. Am J Gastroenterol 97:2402-2407, 2002.
42. Zolfino T, Heneghan MA, Norris S, Harrison PM, Portmann BC, McFarlane IG: Characteristics of autoimmune hepatitis in patients who are not of European Caucasoid ethnic origin. Gut 50:713-717, 2002.
43. Nakamura K, Yoneda M, Yokohama S, et al. Efficacy of ursodeoxycholic acid in Japanese patients with type 1 autoimmune hepatitis. J Gastroenterol Hepatol 13:490-495, 1998.
44. Czaja AJ, Souto EO, Bittencourt PL, et al. Clinical distinctions and pathogenic implications of type 1 autoimmune hepatitis in Brazil and the United States. J Hepatol 37:302-308, 2002.
45. D'Souza R, Sinnott P, Glynn MJ, Sabin CA, Foster GR. An unusual form of autoimmune hepatitis in young Somalian men. Liver Int 25:325-330, 2005.
46. Kogan J, Safadi R, Ashur Y, Shouval D, Ilan Y. Prognosis of symptomatic versus asymptomatic autoimmune hepatitis. A study of 68 patients. J Clin Gastroenterol 35:75-81, 2002.
47. Feld JJ, Dinh H, Arenovich T, Marcus VA, Wanless IR, Heathcote EJ. Autoimmune hepatitis: effect of symptoms and cirrhosis on natural history and outcome. Hepatology 42:53-62, 2005.
48. Czaja AJ. Autoantibodies in autoimmune liver disease. Adv Clin Chem 40:127-164, 2005.
49. Manns, M, Gerken, G, Kyriatsoulis A, Staritz, M, Meyer zum Buschenfelde. Characterization of a new subgroup of autoimmune chronic active hepatitis by autoantibodies against a soluble liver antigen. Lancet 1:292-294, 1987.
50. Stechemesser E, Klein R, Berg PA. Characterization and clinical relevance of liver-pancreas antibodies in autoimmune hepatitis. Hepatology 18:1-9, 1993.
51. Wies I, Brunner S, Henninger J, Herkel J, Meyer zum Buschenfelde KH, Lohse AW. Identification of target antigen for SLA/LP autoantibodies in autoimmune hepatitis. Lancet 355:1510-1515, 2000.
52. McFarlane IG, McFarlane BM, Major GN, Tolley P, Williams R. Identification of the hepatic asialo-glycoprotein receptor (hepatic lectin) as a component of liver specific membrane lipoprotein (LSP). Clin Exp Immunol 55:347-354, 1984.
53. McFarlane IG, Hegarty JE, McSorley CG, McFarlane BM, Williams R. Antibodies to liver-specific protein predict outcome of treatment withdrawal in autoimmune chronic active hepatitis. Lancet 2:954-956, 1984.
54. Czaja AJ, Pfeifer KD, Decker RH, Vallari AS. Frequency and significance of antibodies to asialoglycoprotein receptor in type 1 autoimmune hepatitis. Dig Dis Sci 41:1733-1740, 1996.
55. Schreiter T, Liu C, Gerken G, Treichel U. Detection of circulating autoantibodies directed against the asialoglycoprortein receptor using recombinant receptor subunit H1. J Immunol Methods 301:1-10, 2005.
56. Czaja AJ, Cassani F, Cataleta M, Valentini P, Bianchi FB. Frequency and significance of antibodies to actin in type 1 autoimmune hepatitis. Hepatology 24:1068-1073, 1996.
57. Chretien-Leprince P, Ballot E, Andre C, et al. Diagnostic value of anti-F-actin antibodies in a French multicenter study. Ann NY Acad Sci 1050:266-273, 2005.
58. Li L, Chen M, Huang DY, Nishioka M. Frequency and significance of antibodies to chromatin in autoimmune hepatitis type 1. J Gastroenterol Hepatol 15:1176-1782, 2000.
59. Czaja AJ, Shums Z, Binder WL, Lewis SJ, Nelson VJ, Norman GL. Frequency and significance of antibodies to chromatin in autoimmune hepatitis. Dig Dis Sci 48:1658-1664, 2003.
60. Fusconi M, Vannini A, Dall'Aglio AC, et al. Anti-cyclic citrullinated peptide antibodies in type 1 autoimmune hepatitis. Aliment Pharmacol Ther 22:951-955, 2005.
61. Montano-Loza A, Czaja AJ, Carpenter HA, et al. Frequency and significance of antibodies to cyclic citrullinated peptide in type 1 autoimmune hepatitis. Autoimmunity 39:341-348, 2006.
62. Ma Y, Okamoto M, Thomas MG, et al. Antibodies to conformational epitopes of soluble liver antigen define a severe form of autoimmune liver disease. Hepatology 35:658-664, 2002.
63. Czaja AJ, Donaldson PT, Lohse AW. Antibodies to soluble liver antigen/liver pancreas and HLA risk factors in type 1 autoimmune hepatitis. Am J Gastroenterol 97:413-419, 2002.
64. Donaldson PT, Doherty DG, Hayllar KM, McFarlane IG, Johnson PJ, Williams R. Susceptibility to autoimmune chronic active hepatitis: human leukocyte antigens DR4 and A1-B8-DR3 are independent risk factors. Hepatology 13:701-706, 1991.
65. Czaja AJ, Carpenter HA, Santrach PJ, Moore SB. Significance of HLA DR4 in type 1 autoimmune hepatitis. Gastroenterology 105:1502-1507, 1993.
66. Czaja AJ, Kruger M, Santrach PJ, Moore SB, Manns MP. Genetic distinctions between types 1 and 2 autoimmune hepatitis. Am J Gastroenterol 92:2197-2200, 1997.
67. Bittencourt PL, Goldberg AC, Cancado ELR, et al. Genetic heterogeneity in susceptibility to autoimmune hepatitis types 1 and 2. Am J Gastroenterol 94:1906-1913, 1999.
68. Djilali-Saiah I, Fakhfakh A, Louafi H, Caillat-Zucman S, Debray D, Alvarez F. HLA class II influences humoral autoimmunity in patients with type 2 autoimmune hepatitis. J Hepatol 45, 844-50, 2006.
69. Ma Y, Bogdanos DP, Hussain MJ, et al. Polyclonal T-cell responses to cytochrome P450IID6 are associated with disease activity in autoimmune hepatitis type 2. Gastroenterology 130:868-882, 2006.
70. Fainboim L, Marcos Y, Pando M, et al. Chronic active autoimmune hepatitis in children. Strong association with a particular HLA DR6 (DRB1*1301) haplotype. Hum Immunol 41:146-150, 1994.
71. Pando M, Larriba J, Fernandez GC, et al. Pediatric and adult forms of type 1 autoimmune hepatitis in Argentina: evidence for differential genetic predisposition. Hepatology 30:1374-1380, 1999.
72. Goldberg AC, Bittencourt PL, Mougin B, et al. Analysis of HLA haplotypes in autoimmune hepatitis type 1: identifying the major susceptibility locus. Hum Immunol 62:165-169, 2001.
73. Czaja AJ, Carpenter HA, Moore SB. Clinical and HLA phenotypes of type 1 autoimmune hepatitis in North America outside DR3 and DR4. Liver Int 26:552-558, 2006.
74. Czaja AJ, Carpenter HA, Moore SB. HLA DRB1*13 as a risk factor for type 1 autoimmune hepatitis in North American patients. Dig Dis Sci (in press).
75. Djilali-Saiah I, Fakhfakh A, Louafi H, Caillat-Zucman S, Debray D, Alvarez F. HLA class II influences humoral autoimmunity in patients with type 2 autoimmune hepatitis. J Hepatol 45, 844-850, 2006.
76. Agarwal K, Czaja AJ, Jones DEJ, Donaldson PT. CTLA-4 gene polymorphism and susceptibility to type 1 autoimmune hepatitis. Hepatology 31:49-53, 2000.
77. Vogel A, Strassburg CP, Manns MP. Genetic association of vitamin D receptor polymorphisms with primary biliary cirrhosis and autoimmune hepatitis. Hepatology 35:126-131, 2002.
78. Fan L, Tu X, Zhu Y, et al. Genetic association of vitamin D receptor polymorphisms with autoimmune hepatitis and primary biliary cirrhosis in China. J Gastroenterol Hepatol 20:249-255, 2005.
79. Cookson S, Constantini PK, Clare M, et al. Frequency and nature of cytokine gene polymorphisms in type 1 autoimmune hepatitis. Hepatology 30:851-856, 1999.
80. Czaja AJ, Cookson S, Constantini PK, Clare M, Underhill JA, Donaldson PT. Cytokine polymorphisms associated with clinical features and treatment outcome in type 1 autoimmune hepatitis. Gastroenterology 117:645-652, 1999.
81. Fan LY. Tu XQ, Zhu Y, et al. Genetic association of cytokine polymorphisms with autoimmune hepatitis and primary biliary cirrhosis in the Chinese. World J Gastroenterol 11:2768-2772, 2005.
82. Hirade A, Imazeki F, Yokosuka O, et al. Fas polymorphisms influence susceptibility to autoimmune hepatitis. Am J Gastroenterol 100:1322-1329, 2005.
83. Agarwal K, Czaja AJ, Donaldson PT. A functional Fas promoter polymorphism is associated with a severe phenotype in type 1 autoimmune hepatitis characterized by early development of cirrhosis. Tissue Antigens 69:227-235, 2007.
84. Vogel A, Strassburg CP, Manns MP. 77 C/G mutation in the tyrosine phosphatase CD45 gene and autoimmune hepatitis: evidence of a genetic link. Gene Immun 4:79-81, 2003.
85. Esteghamat F, Noorinayer B, Sanati MH, et al. C77G mutation in protein tyrosine phosphatase CD45 gene and autoimmune hepatitis. Hepatol Res 32:154-157, 2005.
86. Vogel A, Liermann H, Harms A, Strassburg CP, Manns MP, Obermayer-Straub P. Autoimmune regulator AIRE: evidence for genetic differences between autoimmune hepatitis and hepatitis as part of the autoimmune polyglandular syndrome type 1. Hepatology 33:1047-1052, 2001.
87. Boe AS, Knappskog PM, Myhre AG, Sorheim JI, Husebye ES. Mutational analysis of the autoimmune regulator (AIRE) gene in sporadic autoimmune Addison's disease can reveal patients with unidentified autoimmune polyglandular syndrome type 1. Eur J Endocrinol 146:519-22, 2002.
88. Lankisch TO, Strassburg CP, Debray D, Manns MP, Jacquemin E. Detection of autoimmune regulator gene mutations in children with type 2 autoimmune hepatitis and extrahepatic immune-mediated diseases. J Pediatr 146:839-842, 2005.
89. Honda M, Kawai H, Shirota Y, Yamashita T, Takamura T, Kaneko S. cDNA microarray analysis of autoimmune hepatitis, primary biliary cirrhosis and consecutive disease manifestation. J Autoimmun 25:133-140, 2005.
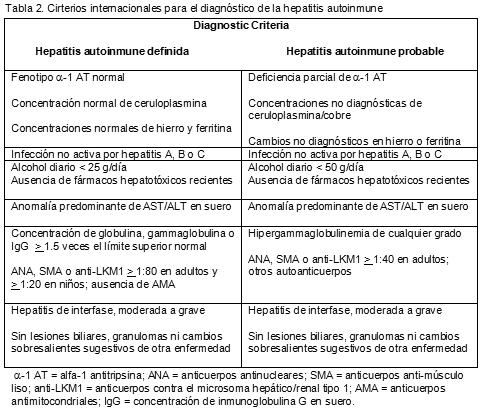
90. Alvarez F, Berg PA, Bianchi FB, et al. International Autoimmune Hepatitis Group report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol 31:929-938, 1999.
91. Czaja AJ, Carpenter HA. Sensitivity, specificity and predictability of biopsy interpretations in chronic hepatitis. Gastroenterology 105:1824-1832, 1993.
92. Pratt DS, Fawaz KA, Rabson A, Dellelis R, Kaplan MM. A novel histological lesion in glucocorticoid-responsive chronic hepatitis. Gastroenterology 113:664-668, 1997.
93. Singh R, Nair S, Farr G, Mason A, Perrillo R. Acute autoimmune hepatitis presenting with centrizonal liver disease: case report and review of the literature. Am J Gastroenterol 97:2670-2673, 2002.
94. Okano N, Yamamoto K, Sakaguchi K, et al. Clinicopathological features of acute-onset autoimmune hepatitis. Hepatology Research 25:263-270, 2003.
95. Misdraji J, Thiim M, Graeme-Cook FM. Autoimmune hepatitis with centrilobular necrosis. Am J Surg Pathol 28:471-478, 2004.
96. Kessler WR, Cummings OW, Eckert G, Chalasani N, Lumeng L, Kwo PY. Fulminant hepatic failure as the initial presentation of acute autoimmune hepatitis. Clin Gastroenterol Hepatol 2:625-631, 2004.
97. Ludwig J, Czaja AJ, Dickson ER, LaRusso NF, Wiesner RH. Manifestations of nonsuppurative cholangitis in chronic hepatobiliary disease: morphologic spectrum, clinical correlations and terminology. Liver 4:105-116, 1984.
98. Dickson RC, Gaffey MJ, Ishitani MB, Roarty TP, Driscoll CJ, Caldwell SH. The international autoimmune hepatitis score in chronic hepatitis C. J Viral Hep 4:121-128, 1997.
99. Czaja AJ, Carpenter HA. Validation of a scoring system for the diagnosis of autoimmune hepatitis. Dig Dis Sci 41:305-314, 1996.
100. Boberg KM, Fausa O, Haaland T, et al. Features of autoimmune hepatitis in primary sclerosing cholangitis: an evaluation of 114 primary sclerosing cholangitis patients according to a scoring system for the diagnosis of autoimmune hepatitis. Hepatology 23:1369-1376, 1996.
101. Hennes EM, Zeniya M, Czaja AJ, et al. Simplified diagnostic criteria for autoimmune hepatitis (abstract). Hepatology 42:295A, 2005.
102. Montano-Loza AJ, Carpenter HA, Czaja AJ. Features associated with treatment failure in type 1 autoimmune hepatitis and predictive value of the model of end stage liver disease. Hepatology (in press).
103. Czaja AJ, Davis GL, Ludwig J, Taswell HF. Complete resolution of inflammatory activity following corticosteroid treatment of HBsAg-negative chronic active hepatitis. Hepatology 4:622-627, 1984.
104. Czaja AJ, Beaver SJ, Shiels MT. Sustained remission following corticosteroid therapy of severe HBsAg-negative chronic active hepatitis. Gastroenterology 92:215-219, 1987.
105. Czaja AJ, Ammon HV, Summerskill WHJ. Clinical features and prognosis of severe chronic active liver disease (CALD) after corticosteroid-induced remission. Gastroenterology 78:518-523, 1980.
106. Hegarty JE, Nouri-Aria KT, Portmann B, Eddleston ALWF, Williams R. Relapse following treatment withdrawal in patients with autoimmune chronic active hepatitis. Hepatology 3:685-689, 1983.
107. Czaja AJ, Menon KVN, Carpenter HA. Sustained remission after corticosteroid therapy for type 1 autoimmune hepatitis: a retrospective analysis. Hepatology 35:890-897, 2002.
108. Cook GC, Mulligan R, Sherlock S. Controlled prospective trial of corticosteroid therapy in active chronic hepatitis. Q J Med 40:159-185, 1971.
109. Soloway RD, Summerskill WHJ, Baggenstoss AH, et al. Clinical, biochemical, and histological remission of severe chronic active liver disease: a controlled study of treatments and early prognosis. Gastroenterology 63:820-833, 1972.
110. Murray-Lyon IM, Stern RB, Williams R. Controlled trial of prednisone and azathioprine in active chronic hepatitis. Lancet 1:735-737, 1973.
111. Schalm SW, Korman MG, Summerskill WHJ, Czaja AJ, Baggenstoss AH. Severe chronic active liver disease. Prognostic significance of initial morphologic patterns. Am J Dig Dis 22:973-980, 1977.
112. DeGroote J, Fevery J, Lepoutre L. Long-term follow-up of chronic active hepatitis of moderate severity. Gut 19:510-513, 1978.
113. Cooksley WGE, Bradbear RA, Robinson W, et al. The prognosis of chronic active hepatitis without cirrhosis in relation to bridging necrosis. Hepatology 6:345-348, 1986.
114. Czaja AJ, Rakela J, Ludwig J. Features reflective of early prognosis in corticosteroid-treated severe autoimmune chronic active hepatitis. Gastroenterology 95:448-453, 1988.
115. Czaja AJ, Strettell MDJ, Thomson LJ, et al. Associations between alleles of the major histocompatibility complex and type 1 autoimmune hepatitis. Hepatology 25:317-323, 1997.
116. Czaja AJ, Donaldson PT. Gender effects and synergisms with histocompatibility leukocyte antigens in type 1 autoimmune hepatitis. Am J Gastroenterol 97:2051-2057, 2002.
117. Said A, Williams J, Holden J, et al. Model for end stage liver disease score predicts mortality across a broad spectrum of liver disease. J Hepatol 40:897-903, 2004.
118. Kamath PS, Kim WR. The model for end-stage liver disease (MELD). Hepatology 45:797-805, 2007.
119. Malinchoc M, Kamath PS, Gordon FD, Peine CJ, Rank J, ter Borg PC. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts. Hepatology 31:864-871, 2000.
120. Verma S, Gunuwan B, Mendler M, Govindrajan S, Redeker A. Factors predicting relapse and poor outcome in type 1 autoimmune hepatitis: role of cirrhosis development, patterns of transaminases during remission, and plasma cell activity in the liver biopsy. Am J Gastroenterol 99:1510-1516, 2004.
121. Miyake Y, Iwasaki Y, Terada R, et al. Persistent normalization of serum alanine aminotransferase levels improves the prognosis of type 1 autoimmune hepatitis. J Hepatol 43:951-957, 2005.
122. Montano-Loza A, Carpenter HA, Czaja AJ. Consequences of treatment withdrawal in type 1 autoimmune hepatitis. Liver Int 27:507-515, 2007.
123. Montano-Loza A, Carpenter HA, Czaja AJ. Improving the end point of corticosteroid therapy in type 1 autoimmune hepatitis to reduce the frequency of relapse. Am J Gastroenterol (in press).
124. Czaja AJ, Wolf AM, Baggenstoss AH. Laboratory assessment of severe chronic active liver disease (CALD): correlation of serum transaminase and gamma globulin levels with histologic features. Gastroenterology 80:687-692, 1981.
125. Kanzler S, Gerken G, Lohr H, Galle PR, Meyer zum Buschenfelde KH, Lohse AW. Duration of immunosuppressive therapy in autoimmune hepatitis. J Hepatol 34:354-355, 2001.
126. Debray D, Maggiore G, Girardet JP, Mallet E, Bernard O. Efficacy of cyclosporin A in children with type 2 autoimmune hepatitis. J Pediatr 135:111-114, 1999.
127. Alvarez F, Ciocca M, Canero-Velasco C, et al. Short-term cyclosporine induces a remission of autoimmune hepatitis in children. J Hepatol 30:222-227, 1999.
128. Malekzadeh R, Nasser-Moghaddam S, Kaviani M-J, Taheri H, Kamalian N, Sotoudeh M. Cyclosporin-A is a promising alternative to corticosteroids in autoimmune hepatitis. Dig Dis Sci 46:1321-1327, 2001.
129. Jackson LD, Song E. Cyclosporin in the treatment of corticosteroid resistant autoimmune chronic active hepatitis. Gut 36:459-461, 1995.
130. Person JL, McHutchison JG, Fong TL, Redeker AG. A case of cyclosporine-sensitive, steroid resistant, autoimmune chronic active hepatitis. J Clin Gastroenterol 17:317-320, 1993.
131. Sherman KE, Narkewicz M, Pinto PC. Cyclosporine in the management of corticosteroid-resistant type 1 autoimmune chronic active hepatitis. J Hepatol 21:1040-1047, 1994.
132. Fernandes NF, Redeker AG, Vierling JM, Villamil FG, Fong TL. Cyclosporine therapy in patients with steroid resistant autoimmune hepatitis. Am J Gastroenterol 94:241-248, 1999.
133. Van Thiel DH, Wright H, Carroll P, et al. Tacrolimus: a potential new treatment for autoimmune chronic active hepatitis: results of an open-label preliminary trial. Am J Gastroenterol 90:771-776, 1995.
134. Aqel BA, Machicao V, Rosser B, Satyanarayana R, Harnois DM, Dickson RC. Efficacy of tacrolimus in the treatment of steroid refractory autoimmune hepatitis. J Clin Gastroenterol 38:805-809, 2004.
135. Richardson PD, James PD, Ryder SD. Mycophenolate mofetil for maintenance of remission in autoimmune hepatitis patients resistant to or intolerant of azathioprine. J Hepatol 33:371-375, 2000.
136. Devlin SM, Swain MG, Urbanski SJ, Burak KW. Mycophenolate mofetil for the treatment of autoimmune hepatitis in patients refractory to standard therapy. Can J Gastroenterol 18:321-326, 2004.
137. Chatur N, Ramji A, Bain VG, et al. Transplant immunosuppressive agents in non-transplant chronic autoimmune hepatitis: the Canadian association for the study of liver (CASL) experience with mycophenolate mofetil and tacrolimus. Liver Int 25:723-727, 2005.
138. Czaja AJ, Carpenter HA. Empiric therapy of autoimmune hepatitis with mycophenolate mofetil: comparison with conventional treatment for refractory disease. J Clin Gastroenterol 39:819-825, 2005.
139. Danielsson A, Prytz H. Oral budesonide for treatment of autoimmune chronic active hepatitis. Aliment Pharmacol Ther 8:585-590, 1994.
140. Wiegand J, Schuller A, Kanzler S, et al. Budesonide in previously untreated autoimmune hepatitis. Liver Int 25:927-934, 2005.
141. Csepregi A, Rocken C, Treiber G, Malfertheiner P. Budesonide induces complete remission in autoimmune hepatitis. World J Gastroenterol 12:1362-1366, 2006.
142. Czaja AJ, Lindor KD. Failure of budesonide in a pilot study of treatment-dependent autoimmune hepatitis. Gastroenterology 119:1312-1316, 2000.
143. Geier A, Gartung C, Dietrich CG, Wasmuth HE, Reinartz P, Matern S. Side effects of budesonide in liver cirrhosis due to chronic autoimmune hepatitis: influence of hepatic metabolism versus portosystemic shunts on a patient complicated with HCC. World J Gastroenterol 9:2681-2685, 2003.
144. De Boer NKH, van Nieuwkerk CMJ, Pages MNA, de Boer SY, Derijks LJJ, Mulder CJJ. Promising treatment of autoimmune hepatitis with 6-thioguanine after adverse events on azathioprine. Eur J Gastroenterol 17:457-461, 2005.
145. Santos ES, Arosemena LR, Raez LE, O'Brien C, Regev A. Successful treatment of autoimmune hepatitis and idiopathic thrombocytopenic purpura with the monoclonal antibody, rituximab: case report and review of the literature. Liver Int 26:625-629, 2006.
146. Kanzler S, Gerken G, Dienes HP, Meyer zum Buschenfelde KH, Lohse AW. Cyclophosphamide as alternative immunosuppressive therapy for autoimmune hepatitis - report of three cases. Z Gastroenterol 35:571-578, 1997.
147. Burak KW, Urbanski SJ, Swain MG. Successful treatment of refractory type 1 autoimmune hepatitis with methotrexate. J Hepatol 29:990-993, 1998.
148. Rebollo Bernardez J, Cifuentes Mimoso C, Pinar Moreno A, et al. Deflazacort for long-term maintenance of remission in type 1 autoimmune hepatitis. Rev Esp Enferm Dig 91:630-638, 1999.
149. Carmassi F, Morale R, Puccetti R, et al. Efficacy of intravenous immunoglobulin therapy in a case of autoimmune-mediated chronic active hepatitis. Clin Exp Rheumatol 10:13-17, 1992.
150. Swada K, Ohnishi K, Kosaka T, et al. Exacerbated autoimmune hepatitis successfully treated with leukocytapheresis and bilirubin adsorption therapy. J Gastroenterol 32:689-695, 1997.
151. Czaja AJ, Hay JE, Rakela J. Clinical features and prognostic implications of severe corticosteroid-treated cryptogenic chronic active hepatitis. Mayo Clin Proc 65:23-30, 1990.
152. Czaja AJ, Carpenter HA, Santrach PJ, Moore SB, Homburger HA. The nature and prognosis of severe cryptogenic chronic active hepatitis. Gastroenterology 104:1755-1761, 1993.
153. Czaja AJ. Behavior and significance of autoantibodies in type 1 autoimmune hepatitis. J Hepatol 30:394-401, 1999.
154. Baeres M, Herkel J, Czaja AJ, et al. Establishment of standardized SLA/LP immunoassays: specificity for autoimmune hepatitis, worldwide occurrence, and clinical characteristics. Gut 51:259-264, 2002.
155. Czaja AJ, Carpenter HA, Manns MP. Antibodies to soluble liver antigen, P450IID6, and mitochondrial complexes in chronic hepatitis. Gastroenterology 105:1522-1528, 1993.
156. Czaja AJ, Shums Z, Norman GL. Nonstandard antibodies as prognostic markers in autoimmune hepatitis. Autoimmunity 37:195-201, 2004.
157. Schalm SW, Summerskill WHJ, Go VLW. Prednisone for chronic active liver disease: pharmacokinetics, including conversion to prednisolone. Gastroenterology 72:910-913, 1977.
158. De Boer NKH, De Graaf P, Wilhelm AJ, Mulder CJJ, Van Bodegraven AA. On the limitation of 6-tioguaninenucleotide monitoring during tioguanine treatment. Aliment Pharmacol Ther 22:447-451, 2005.
159. Uribe M, Go VLW, Kluge D. Prednisone for chronic active hepatitis: pharmacokinetics and serum binding in patients with chronic active hepatitis and steroid major side effects. J Clin Gastroenterol 6:331-335, 1984.
160. Czaja AJ, Carpenter HA. Thiopurine methyltransferase deficiency and azathioprine intolerance in autoimmune hepatitis. Dig Dis Sci 51:968-975, 2006.
161. Langley PG, Underhill J, Tredger JM, Norris S, McFarlane IG. Thiopurine methyltransferase phenotype and genotype in relation to azathioprine therapy in autoimmune hepatitis. J Hepatol 37:441-447, 2002.
162. Heneghan MA, Allan ML, Bornstein JD, Muir AJ, Tendler DA. Utility of thiopurine methyltransferase genotyping and phenotyping, and measurement of azathioprine metabolites in the management of patients with autoimmune hepatitis. J Hepatol 45:584-591, 2006.
163. Czaja AJ. The variant forms of autoimmune hepatitis. Ann Intern Med 125:588-598, 1996.
164. Czaja AJ. Variant forms of autoimmune hepatitis. Curr Gastroenterol Rep 1:63-70, 1999.
165. Heathcote J. Variant syndromes of autoimmune hepatitis. Clin Liver Dis 6:669-684, 2002.
166. Czaja AJ. Overlap syndrome of primary biliary cirrhosis and autoimmune hepatitis: a foray across diagnostic boundaries (editorial). J Hepatol 44:251-252, 2006.
167. Fridkis-Hareli M, Rosloniec EF, Fugger L, Strominger JL. Synthetic peptides that inhibit binding of the collagen type II 261-273 epitope to rheumatoid arthritis-associated HLA-DR1 and -DR4 molecules and collagen-specific T-cell responses. Hum Immunol 61:640-650, 2000.
168. Guinan EC, Boussiotis VA, Neuberg D, et al. Transplantation of anergic histoincompatible bone marrow allografts. N Eng J Med 340:1704-1714, 1990.
169. Wardrop RM, Whitacre CC. Oral tolerance in the treatment of inflammatory autoimmune diseases. Inflamm Res 48:106-119, 1999.
170. Lohse AW, Dienes HP, Meyer zum Buschenfelde K-H. Suppression of murine experimental autoimmune hepatitis by T-cell vaccination or immunosuppression. Hepatology 27:1536-1543, 1998.
171. Nelson DR, Lauwers GY, Lau JY, Davis GL. Interleukin 10 treatment reduces fibrosis in patients with chronic hepatitis C: a pilot study of interferon nonresponders. Gastroenterology 118:655-660, 2000.
172. Menon KV, Stadheim L, Kamath PS, et al. A pilot study of the safety and tolerability of etanercept in patients with alcoholic hepatitis. Am J Gastroenterol 99:255-260, 2004.
173. Hannon GJ, Rossi JJ. Unlocking the potential of the human genome with RNA interference. Nature 431:371-378, 2004.
174. Song E, Lee S-K, Wang J, et al. RNA interference targeting Fas protects mice from fulminant hepatitis. Nature Medicine 9:347-351, 2003.
175. Longhi MS, Hussain MJ, Mitry RR, et al. Functional study of CD4+CD25+ regulatory T cells in health and autoimmune hepatitis. J Immunol 176:4484-4491, 2006.
176. Takahashi H, Oikawa T, Amano K, et al. Intrahepatic NKT cell and soluble CD1d have a significant role in the immuno-pathogenesis of AIH but not in PBC (abstract). Hepatology 44 (Suppl 1):227A-228A, 2006.
177. Touhy VK, Mathisen PM. Gene therapy for autoimmune diseases. In: Manns MP, Paumgartner G, Leuschner U, eds, Immunology and Liver, Falk Symposium 114, Kluwer Academic Publishers, BV, Dordrecht, pp. 376-385, 2000.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: