Bibliografía del artículo
Bibliografía del artículo
1. Nelson LJ, Wells CD. Global epidemiology of childhood tuberculosis. Int J Tuberc Lung Dis 8:636-647, 2004.
2. Chintu C, Mudenda V, Lucas S et. al. Lung diseases at necropsy in African children dying from respiratory illnesses: a descriptive necropsy study. Lancet 360:985-990, 2002.
3. Donald P R. Childhood tuberculosis: out of control? Current Opinion in Pulmonary Medicine 8:178-182, 2002.
4. Schaaf HS, Marais BJ, Hesseling AC, Gie RP, Beyers N, Donald PR. Childhood drug-resistant tuberculosis in the Western Cape Province of South Africa. Acta Paediatrica 95:523-528, 2006.
5. World Health Organization. Guidance for National Tuberculosis Programmes on the Management of Tuberculosis in Children. WHO, Geneva, Switzerland. WHO/HTM/TB/2006.371.
6. Marais BJ, Hesseling AC, Gie RP, Schaaf HS, Beyers N. The burden of childhood tuberculosis and the accuracy of community-based surveillance data. Int J Tuberc Lung Dis 10:259-263, 2006.
7. Marais BJ, Donald PR, Gie RP, Schaaf HS, Beyers N. Diversity of disease manifestations in childhood pulmonary tuberculosis. Ann Trop Paed 25:79-86, 2005.
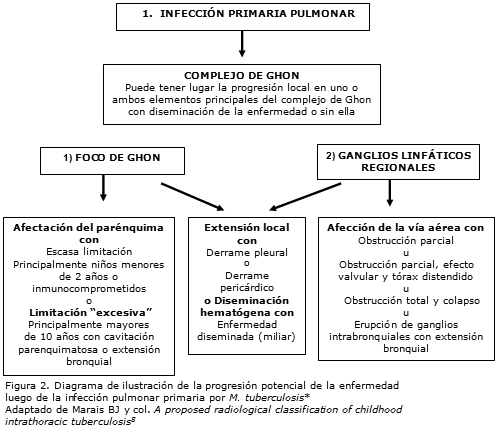
8. Marais BJ, Gie RP, Starke JR et al. A proposed radiological classification of childhood intra-thoracic tuberculosis. Ped Rad 33:886-894, 2004.
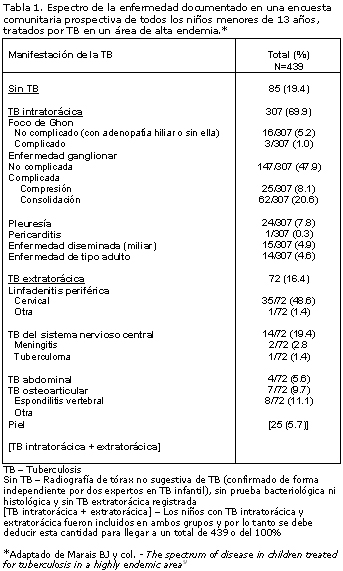
9. Marais BJ, Gie RP, Schaaf HS et. al. The spectrum of disease in children treated for tuberculosis in a highly endemic area. Int J Tuberc Lung Dis 10:732-738, 2006.
10. Weber HC, Beyers N, Gie RP et al. The clinical and radiological features of tuberculosis in adolescents. Ann of Trop Paediatr 20:5-10, 2000.
11. Marais BJ, Gie RP, Schaaf HS et al. The natural history of childhood intra-thoracic tuberculosis. A critical review of the literature from the pre-chemotherapy era. Int J Tuberc Lung Dis 8:392-402, 2004.
12. Marais BJ, Gie RP, Hesseling AC, Beyers N. Adult-type pulmonary tuberculosis in children aged 10-14 years. Pediatr Inf Dis J 24:743-744, 2005.
13. Marais BJ, Gie RP, Schaaf HS et.al. Childhood pulmonary tuberculosis: Old wisdom and new challenges. Am J Resp Crit Care Med 173:1078-1090, 2006.
14. Curtis AB, Ridzon R, Vogel R et.al. Extensive transmission of
Mycobacterium tuberculosis from a child. N Engl J Med 341:1491-1495, 1999.
15. Ewer K, Deeks J, Alvarez L et. al. Comparison of T-cell-based assay with tuberculin skin test for diagnosis of Mycobacterium tuberculosis infection in a school tuberculosis outbreak. Lancet 361:1168-1173, 2003.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento