Bibliografía del artículo
Bibliografía del artículo
1. Grant BF, Dawson DA, Stinson FS, Chou SP, Dufour MC, Pickering RP. The 12-month prevalence and trends in DSM-IV alcohol abuse and dependence: United States, 1991-1992 and 2001-2002. Drug and Alcohol Dependence 74:223-234, 2004.
2. The NSDUH Report: illicit drug use among lifetime nondrinkers and lifetime alcohol users, Office of Applied Programs, Substance Abuse & Mental Health Services Administration, US Dept. of Health and Human Services p. 2, 2005.
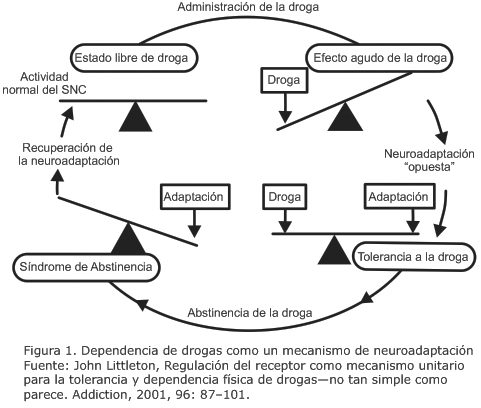
3. Littleton J. Receptor regulation as a unitary mechanism for drug tolerance and physical dependence - not quite as simple as it seemed! Addiction 96:87-101, 2001.
4. Koob GF, Le Moal M. Drug addiction, dysregulation of reward, and allostasis. Neuropsychopharmacology 24(2):97-129, 2001.
5. Tsai G, Gastfriend DR, Coyle JT. The glutamatergic basis of human alcoholism. Am J Psychiatry 152(3): 332-340, 1995.
6. Tsai G, Coyle JT. The role of glutamatergic neurotransmission in the pathophysiology of alcoholism. Annu Rev Med 49:173-184, 1998.
7. Di Chiara G, Tanda G, Cadoni C, Aquas E, Bassareo V, Carboni E. Homologies and differencesin the action of drugs of abuse and a conventional reinforcer (food) on dopamine transmission: an interpretative framework of the mechanism of drug dependence. Adv Pharmacol 42:983-987, 1998.
8. Dodd PR, Beckmann AM, Davidson MS, Wilce PA. Glutamate-mediated transmission, alcohol, and alcoholism. Neurochem Int 37:509-533, 2000.
9. Grant KA, Lovinger DM. Cellular and behavioral neurobiology of alcohol: receptor-mediated neuronal processes. Clin Neurosci 3(3):155-164, 1995.
10. Krystal JH, Tabakoff B. In: Davis KL, Charney DS, Coyle JT, Nemeroff C. Eds. Psychopharmacology: A fifth generation of progress. Philadelphia, Lippincott Williams and Wilkins pp. 1425-1443, 2002.
11. Chandler LJ. Ethanol and brain plasticity: receptors and molecular networks of the postsynaptic density as targets of ethanol. Pharmacology & Therapeutics 99:311-326, 2003.
12. Hoffman PL, Rabe CS, Moses F, Tabakoff B. N-methyl-D-aspartate receptors and ethanol: inhibition of calcium flux and cyclic GMP production. J Neurochem 52:61937-61940, 1989.
13. Lovinger DM, White G, Weight FF. Ethanol inhibits NMDA-activated ion current in hippocampal neurons. Science 243:1721-1724, 1989.
14. Grant KA, Valverius P, Hudspith M, Tabakoff B. Ethanol withdrawal seizures and the NMDA receptor complex. Eur J Pharmacol 176:289-296, 1990.
15. Gulya K, Grant KA, Valverius P, Hoffman PL, Tabakoff B. Brain regional specificity and time-course of changes in the NMDA receptor-ionophore complex during ethanol withdrawal. Brain Res 547(1):129-134, 1991.
16. Gonzalez LP, Veatch LM, Ticku MK, Becker HC. Alcohol withdrawal kindling: Mechanisms and implications for treatment. Alcohol Clin Exp Res 25:197S-201S, 2001.
17. Zhang J, Chiodo LA, Freeman AS. Electrophysiological effects of MK-801 on rat nigrostriatal and mesoaccumbal dopaminergic neurons. Brain Res 590(1-2):153-163, 1992.
18. Hoffman PL, Tabakoff B. Alcohol dependence: a commentary on mechanisms. Alcohol Alcohol 31(4):333-340, 1996.
19. Kretschmer BD. Modulation of the mesolimbic dopamine system by glutamate: role of NMDA receptors. J Neurochem 73(2):839-848, 1999.
20. Fadda F, Rossetti ZL. Chronic ethanol consumption: from neuroadaptation to neurodegeneration. Prog Neurobiol 56(4):385-431, 1998.
21. Rossetti ZL, Melis F, Carboni S, Diana M, Gessa GL. Alcohol withdrawal in rats is associated with a marked fall in extraneuronal dopamine. Alcohol Clin Exp Res 16(3):529-532, 1992.
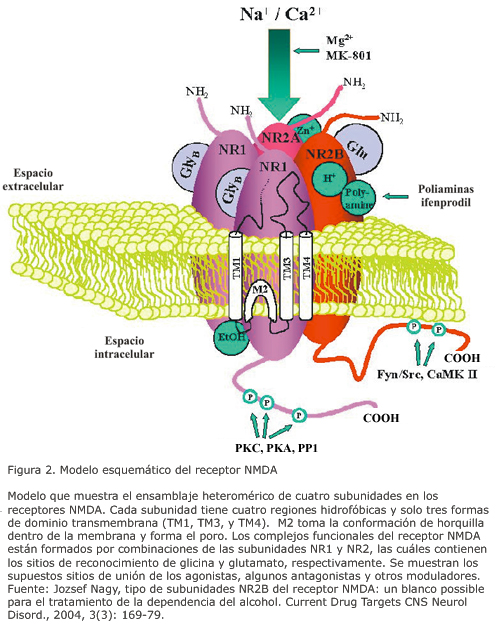
22. Diana M, Pistis M, Carboni S, Gessa GL, Rossetti ZL. Profound decrement of mesolimbic dopaminergic neuronal activity during ethanol withdrawal syndrome in rats: electrophysiological and biochemical evidence. Proc Natl Acad Sci USA 90(17):7966-7969, 193.
23. Nagy J, Horvath C, Farkas S, Kolok S, Szombathelyi Z. NR2B subunit selective NMDA antagonists inhibit neurotoxic effect of alcohol-withdrawal in primary cultures of rat cortical neurones. Neurochem Int 44(1):17-23, 2004.
24. Bisaga A, Popik P. In search of a new pharmacological treatment for drug and alcohol addiction: N-methyl-D-aspartate (NMDA) antagonists. Drug Alcohol Depend 59(1):1-15, 2000.
25. Danysz W, Parsons CG. Glycine and N-methyl-D-aspartate receptors: physiological significance and possible therapeutic applications. Pharmacological Reviews 50(4):597-664, 1998.
26. Husi H, Grant SG. Isolation of 2000-kDa complexes of N-methyl-D-aspartate receptor and postsynaptic density 95 from mouse brain. J Neurochem 77(1):281-291, 2001.
27. Brimecombe JC, Boeckman FA, Aizenman E. Functional consequences of NR2 subunit composition in single recombinant N-methyl-D-aspartate receptors. Proc Natl Acad Sci USA 94(20):11019-11024, 1997.
28. Das S, Sasaki YF, Rothe T, Premkumar LS, Takasu M, Crandall JE, et al. Increased NMDA current and spine density in mice lacking the NMDA receptor subunit NR3A. Nature 393(6683):377-381, 1998.
29. Premkumar LS, Auerbach AJ. Stoichiometry of recombinant N-methyl-D-aspartate receptor channels inferred from single-channel current patterns. Gen Physiol 110(5):485-502, 1997.
30. Laube B, Kuhse J, Betz H. Evidence for a tetrameric structure of recombinant NMDA receptors. J Neurosci 18(8):2954-2961, 1998.
31. Moriyoshi K, Masu M, Ishii T, Shigemoto R, Mizuno N, Nakanishi S. Molecular cloning and characterization of the rat NMDA receptor. Nature 354(6348):31-37, 1991.
32. Monyer H, Sprengel R, Schoepfer R, Herb A, Higuchi M, Lomeli H, et al. Heteromeric NMDA receptors: molecular and functional distinction of subtypes. Science 256:1217-1221, 1992.
33. Monyer H, Burnashev N, Laurie DJ, Sakmann B, Seeburg PH. Developmental and regional expression in the rat brain and functional properties of four NMDA receptors. Neuron 12(3):529-540, 1994.
34. Schorge S, Colquhoun D. Studies of NMDA receptor function and stoichiometry with truncated and tandem subunits. J Neurosci 23(4):1151-1158, 2003.
35. Meddows E, Le Bourdelles B, Grimwood S, Wafford K, Sandhu S, Whiting P, et al. Identification of molecular determinants that are important in the assembly of N-methyl-D-aspartate receptors. J Biol Chem 276:18795-18803, 2001.
36. Regalado MP, Villarroel A, Lerma J. Intersubunit cooperativity in the NMDA receptor. Neuron 32:1085-1096, 2001.
37. Furukawa H, Singh SK, Mancusso R, Gouaux E. Subunit arrangement and function in NMDA receptors. Nature 438(10):185-192, 2005.
38. Lovinger DM. Developmental decrease in ethanol inhibition of N-methyl-D-aspartate receptors in rat neocortical neurons: relation to the actions of ifenprodil. J Pharmacol Exp Ther 274(1):164-172, 1995.
39. Fink K, Göthert M. Both ethanol and ifenprodil inhibit NMDA-evoked release of various neurotransmitters at different, yet proportional potency: potential relation to NMDA receptor subunit composition. Naunyn Schmiedebergs Arch Pharmacol 354(3):312-319, 1996.
40. Williams K. Ifenprodil discriminates subtypes of the N-methyl-D-aspartate receptor: selectivity and mechanisms at recombinant heteromeric receptors. Mol Pharmacol 44(4):851-859, 1993.
41. Kuner T, Schoepfer R, Korpi ER. Ethanol inhibits glutamate-induced currents in heteromeric NMDA receptor subtypes. Neuroreport 5(3):297-300, 1993.
42. Masood K, Wu C, Brauneis U, Weight FF. Differential ethanol sensitivity of recombinant N-methyl-D-aspartate receptor subunits. Mol Pharmacol 45:324-329, 1994.
43. Buller AL, Larson HC, Morrisett RA, Monaghan DT. Glycine modulates ethanol inhibition of heteromeric N-methyl-D-aspartate receptors expressed in Xenopus oocytes. Mol Pharmacol 48(4):717-723, 1995.
44. Chu B, Anantharam V, Treistman SN. Ethanol inhibition of recombinant heteromeric NMDA channels in the presence and absence of modulators. J Neurochem 65(1):140-148, 1995.
45. Mirshahi T, Woodward JJ. Ethanol sensitivity of heteromeric NMDA receptors: effects of subunit assembly, glycine and NMDAR1 Mg(2+)-insensitive mutants. Neuropharmacology 34:347-355, 1995.
46. Wirkner K, Poelchen W, Koles L, Muhlberg K, Scheibler P, Allgaier C, Illes P. Ethanol-induced inhibition of NMDA receptor channels. Neurochem Int 35:153-162, 1999.
47. Blevins T, Mirshahi T, Woodward J. Increased agonist and antagonist sensitivity of N-methyl-D-aspartate stimulated calcium flux in cultured neurons following chronic ethanol exposure. Neurosci Lett 200:214-218, 1995.
48. Blevins T, Mirshahi T, Chandler LJ, Woodward JJ. Effects of acute and chronic ethanol exposure on heteromeric N-methyl-D-aspartate receptors expressed in HEK 293 cells. J Neurochem 69(6):2345-2354, 1997.
49. Anders DL, Blevins T, Sutton G, Chandler LJ, Woodward JJ. Effects of c-Src tyrosine kinase on ethanol sensitivity of recombinant NMDA receptors expressed in HEK 293 cells. Alcohol Clin Exp Res 23(2):357-362, 1999.
50. Smothers CT, Clayton R, Blevins T, Woodward JJ. Ethanol sensitivity of recombinant human N-methyl-D-aspartate receptors. Neurochem Int 38(4):333-340, 2001.
51. Jin C, Woodward JJ. Effects of 8 different NR1 splice variants on the ethanol inhibition of recombinant NMDA receptors. Alcohol Clin Exp Res 30(4):673-679, 2006.
52. Faingold CL, N'Guemo P, Riaz A. Ethanol and neurotransmitter interactions - from molecular to integrative effects. Progress in Neurobiol 55:509-535, 1998.
53. Trevisan L, Fitzgerald LW, Brose N, Gasic GP, Heinemann SF, Duman RS, Nestler EJ. Chronic ingestion of ethanol up-regulates NMDAR1 receptor subunit immunoreactivity in rat hippocampus. J Neurochem 62(4):1635-1638, 1994.
54. Kalluri HS, Mehta AK, Ticku MK. Up-regulation of NMDA receptor subunits in rat brain following chronic ethanol treatment. Brain Res Mol Brain Res 58(1-2):221-224, 1998.
55. Maler JM, Esselmann H, Wiltfang J, Kunz N, Lewczuk P, Reulbach U, Bleich S, Ruther E, Kornhuber J. Memantine inhibits ethanol-induced NMDA receptor up-regulation in rat hippocampal neurons. Brain Res 1052(2):156-162, 2005.
56. Nelson TE, Ur CL, Gruol DL. Chronic intermittent ethanol exposure enhances NMDA-receptor-mediated synaptic responses and NMDA receptor expression in hippocampal CA1 region. Brain Res 1048(1-2):69-79, 2005.
57. Morrow AL, Devaud LL, Bucci D, Smith FD. GABAA and NMDA receptor subunit mRNA expression in ethanol dependent rats. Alcohol Alcohol Suppl 2:89-95, 1994.
58. Hu XJ, Follesa P, Ticku MK. Chronic ethanol treatment produces a selective upregulation of the NMDA receptor subunit gene expression in mammalian cultured cortical neurons. Brain Res Mol Brain Res 36:211-218, 1996.
59. Rani CSS, Ticku MK. Comparison of chronic ethanol and chronic intermittent ethanol treatments on the expression of GABAA and NMDA receptor subunits. Alcohol 38:89-97, 2006.
60. Follesa P, Ticku MK. Chronic ethanol-mediated up-regulation of the N-methyl-D-aspartate receptor polypeptide subunits in mouse cortical neurons in culture. J Biol Chem 271(23):13297-13299, 1996.
61. Follesa P, Ticku MK. NMDA receptor upregulation: molecular studies in cultured mouse cortical neurons after chronic antagonist exposure. J Neurosci 16(7):2172-2178, 1996.
62. Nagy J, Kolok S, Dezso P, Boros A, Szombathelyi Z. Differential alterations in the expression of NMDA receptor subunits following chronic ethanol treatment in primary cultures of rat cortical and hippocampal neurones. Neurochem Int 42(1):35-43, 2003.
63. Krystal JH, Petrakis IL, Mason G, Trevisan L, D'Souza DC. N-methyl-D-aspartate glutamate receptors and alcoholism: reward, dependence, treatment, and vulnerability. Pharmacology & Therapeutics 99:79-94, 2003.
64. Miyakawa T, Yagi T, Kitazawa H, Yasuda M, Kawai N, Tsuboi K, Niki H. Fyn-kinase as a determinant of ethanol sensitivity: relation to NMDA-receptor function. Science 278:698-701, 1997.
65. Anders DL, Blevins T, Sutton G, Swope S, Chandler LJ, Woodward JJ. Fyn tyrosine kinase reduces the ethanol inhibition of recombinant NR1/NR2A but not NR1/NR2B NMDA receptors expressed in HEK 293 cells. J Neurochem 72:1389-1393, 1999.
66. Chandler LJ, Guzman NJ, Sumners C, Crews FT. Magnesium and zinc potentiate ethanol inhibition of N-methyl-D-aspartatestimulated nitric oxide synthase in cortical neurons. J Pharmacol Exp Ther 271:67-75, 1994.
67. Chandler LJ, Sutton G, Norwood D, Sumners C, Crews FT. Chronic ethanol increases N-methyl-D-aspartate-stimulated nitric oxide formation but not receptor density in cultured cortical neurons. Mol Pharmacol 51:733-740, 1997.
68. Pawlak R, Melchor JP, Matys T, Skrzypiec AE, Strickland S. Ethanol-withdrawal seizures are controlled by tissue plasminogen activator via modulation of NR2B-containing NMDA receptors. Proc Natl Acad Sci USA 102(2):443-448, 2005.
69. Hoffman PL, Rabe CS, Grant KA, Valverius P, Hudspith M, Tabakoff B. Ethanol and the NMDA receptor. Alcohol 7:229-231, 1990.
70. Nagy J, Müller F, László L. Cytotoxic effect of alcohol-withdrawal on primary cultures of cortical neurones. Drug and Alcohol Dependence 61:155-162, 2001.
71. Iorio KR, Reinlib L, Tabakoff B, Hoffman PL. Chronic exposure of cerebellar granule cells to ethanol results in increased Nmethyl-D-aspartate receptor function. Mol Pharmacol 41:1142-1148, 1992.
72. Hoffman PL. Glutamate receptors in alcohol withdrawal-induced neurotoxicity. Metab Brain Dis 10:73-79, 1995.
73. Smothers CT, Mrotek JJ, Lovinger DM. Chronic ethanol exposure leads to a selective enhancement of N-methyl-D-aspartate receptor function in cultured hippocampal neurons. J Pharmacol Exp Ther 283:1214-1222, 1997.
74. Thomas MP, Monaghan DT, Morrisett RA. Evidence for a causative role of N-methyl-D-aspartate receptors in an in vitro model of alcohol withdrawal hyperexcitability. J Pharmacol Exp Ther 287:87-97, 1998.
75. Nagy J, László L. Increased sensitivity to NMDA is involved in alcohol-withdrawal induced cytotoxicity observed in primary cultures of cortical neurones chronically pre-treated with ethanol. Neurochem Int 40:585-591, 2002.
76. Calton JL, Wilson W A, Moore SD. Magnesium-dependent inhibition of N-methyl-D-aspartate receptor-mediated synaptic transmission by ethanol. J Pharmacol Exp Ther 287:1015-1019, 1998.
77. Rossetti ZL, Carboni S, Fadda F. Glutamate-induced increase of extracellular glutamate through N-methyl-D-aspartate receptors in ethanol withdrawal. Neuroscience 93:1135-1140, 1999.
78. Whittington MA, Lambert JD, Little HJ. Increases in synaptic activation of calcium current as a mechanism for generation of ethanol withdrawal seizures. Alcohol Alcohol Suppl 2:391-394, 1993.
79. Harris RA, Valenzuela CF, Brozowski S, Chuang L, Hadingham PJ, Whiting PJ. Adaptation of g-aminobutyric acid type A receptors to alcohol exposure: studies with stably transfected cells. J Pharmacol Exp Ther 284:180-188, 1998.
80. Fuller RK, Gordis E. Does disulfiram have a role in alcoholism treatment today? Addiction 99:21-24, 2004.
81. Volpicelli JR, Alterman AI, Hayashida M, O'Brien CP. Naltrexone in the treatment of alcohol dependence. Arch Gen Psychiatry 49:876-880, 1992.
82. O'Malley SS, Jaffe AJ, Chang G, Schottenfeld RS, Meyer RE, Rounsaville B. Naltrexone and coping skills therapy for alcohol dependence. A controlled study. Arch Gen Psychiatry 49:881-887, 1992.
83. Tempesta E, Janiri L, Bignamini A, Chabac S, Potgieter A. Acamprosate and relapse prevention in the treatment of alcohol dependence: a placebo-controlled study Alcohol & Alcoholism 35(2):202-209, 2000.
84. Volpicelli JR, O'Brien CP, Alterman AI, Hayshida M. In: Reid LD. Ed., Opioids, bulimia, and alcohol abuse and alcoholism. New York: Springer-Verlag pp. 195-214, 1990.
85. Benjamin D, Grant E, Pohorecky LA. Naltrexone reverses ethanol- induced dopamine release in the nucleus accumbens in awake, freely moving rats. Brain Res 621:137-140, 1993.
86. Sinclair JD. Evidence about the use of naltrexone and for different ways of using it in the treatment of alcoholism. Alcohol Alcohol 36:2-10, 2001.
87. Swift RM, Whelihan W, Kuznetsov O, Buongiorno G, Hsuing H. Naltrexone-induced alterations in human ethanol intoxication. Am J Psychiatry 151:1463-1467, 1994.
88. Anton RF, Moak DH, Waid LR, Latham PK, Malcolm RJ, Dias JK. Naltrexone and cognitive behavioral therapy for the treatment of outpatient alcoholics: results of a placebo-controlled trial. Am J Psychiatry 156:1758-1764, 1999.
89. Balldin J, Berglund M, Borg S, Mansson M, Bendtsen P, Franck J, et al. A 6-month controlled naltrexone study: combined effect with cognitive behavioural therapy in outpatient treatment of alcohol dependence. Alcohol Clin Exp Res 27:1142-1149, 2003.
90. Morris PL. Naltrexone for alcohol dependence: a randomized controlled trial. Addiction 96:1565-1573, 2001.
91. O'Malley SS, Jaffe AJ, Chang G, Schottenfeld RS, Meyer RE, Rounsaville B. Naltrexone and coping skills therapy for alcohol dependence. A controlled study. Arch Gen Psychiatry 49:881-887, 1992.
92. Volpicelli JR, Alterman AI, Hayashida M, O'Brien CP. Naltrexone in the treatment of alcohol dependence. Arch Gen Psychiatry 49:876-880, 1992.
93. Volpicelli JR, Rhines KC, Rhines JS, Volpicelli LA, Alterman AI, O'Brien CP. Naltrexone and alcohol dependence. Role of subject compliance. Arch Gen Psychiatry 54:737-742, 1997.
94. Anton R, Moak DH, Latham PK, Waid LR, Myrick H, Voronin K, et al. Naltrexone combined with either cognitive behavioural or motivational enhancement therapy for alcohol dependence. J Clin Psychopharmacol 25:349-357, 2005.
95. Morley KC, Teesson M, Reid SC, Sannibale C, Thomson C, Phung N, Weltman M, Bell JR, Richardson K, Haber PS. Naltrexone versus acamprosate in the treatment of alcohol dependence: a multi-centre, randomized, double-blind, placebo-controlled trial. Addiction 101:1451-1462, 2006.
96. Kranzler HR, Modesto-Lowe V, Van Kirk J. Naltrexone vs. nefazodone for treatment of alcohol dependence. A placebo-controlled trial. Neuropsychopharmacology 22:493-503, 2000.
97. Krystal JH, Cramer JA, Krol WF, Kirk GF, Rosenheck RA. Naltrexone in the treatment of alcohol dependence. New England J Med 345:1734-1739, 2001.
98. Gastpar M, Bonnet U, Boning J, Mann K, Schmidt LG, Soyka M, et al. Lack of efficacy of naltrexone in the prevention of alcohol relapse: results from a German mulicenter study. J Clin Psychiatry 22:592-598, 2002.
99. Huang M, Chen C, Yu J, Chen C. A double-blind, placebo controlled study of naltrexone in the treatment of alcohol dependence in Taiwan. Addict Biol 10:289-292, 2005.
100. Monti PM, Rohsenow DJ, Hutchison KE, Swift RM, Mueller TI, Colby SM, et al. Naltrexone's effect on cue-elicited craving among alcoholics in treatment. Alcohol Clin Exp Res 23:1386-1394, 1999.
101. Chick J, Anton R, Checinski K, Croop R, Drummond DC, Farmer R, et al. A multicentre, randomized, double-blind, placebo-controlled trial of naltrexone in the treatment of alcohol dependence or abuse. Alcohol Alcohol 35:587-593, 2000.
102. Paille FM, Guelfi JD, Perkins AC, Royer RJ, Steru L, Parot P. Double-blind randomized multicentre trial of acamprosate in maintaining abstinence from alcohol. Alcohol Alcohol 30:239-247, 1995.
103. Roussaux JP, Hers D, Ferauge M. Does acamprosate diminish the appetite for alcohol in weaned alcoholics? J Pharmacol 51:65-68, 1996.
104. Whitworth AB, Fischer F, Lesch OM, Nimmerrichter A, Oberbauer H, Platz T, et al. Comparison of acamprosate and placebo in long-term treatment of alcohol dependence. Lancet 347:1438-1442, 1996.
105. Sass H, Soyka M, Mann K, Zieglgansberger W. Relapse prevention by acamprosate. Results from a placebo controlled study on alcohol dependence. Arch Gen Psychiatry 53:673-680, 1996.
106. Poldrugo F. Acamprosate treatment in a long-term community-based alcohol rehabilitation programme. Addiction 92:1537-1546, 1997.
107. Geerlings PJ, Ansoms C, Brink WVD. Acamprosate and prevention of relapse in alcoholics. Eur Addict Res 3:129-137, 1997.
108. Tempesta E, Janiri L, Bignamini A, Chabac S, Potgieter A. Acamprosate and relapse prevention in the treatment of alcohol dependence: a placebo-controlled study. Alcohol Alcohol 35:202-209, 2000.
109. Chick J, Howlett H, Morgan MY, Ritson B. United Kingdom Multicentre Acamprosate Study (UKMAS): a 6-month prospective study of acamprosate versus placebo in preventing relapse after withdrawal from alcohol. Alcohol Alcohol 35:176-187, 2000.
110. Namkoong K, Lee BO, Lee PG, Choi MJ, Lee E. Acamprosate in Korean alcohol-dependent patients: a multicentre, randomized, double-blind, placebo-controlled study. Alcohol Alcohol 38:135-141, 2003.
111. Berglund M. Pharmacotherapy for alcohol dependence. Weinheim: Wiley-VCH, 2003.
112. Spanagel R, Holter SM, Allingham K, Landgraf R, Zieglgansberger W. Acamprosate and alcohol: I. Effects on alcohol intake following alcohol deprivation in the rat. Eur J Pharmacol 305(1-3):39-44, 1996.
113. Spanagel R, Putzke J, Stefferl A, Schobitz B, Zieglgansberger W. Acamprosate and alcohol: II. Effects on alcohol withdrawal in the rat. Eur J Pharmacol 305(1-3):45-50, 1996.
114. Spanagel R, Zieglgansberger W, Hundt W. Acamprosate and alcohol: III. Effects on alcohol discrimination in the rat. Eur J Pharmacol 305(1-3):51-56, 1996.
115. De Witte P, Littleton J, Parot P, Koob G. Neuroprotective and abstinence-promoting effects of acamprosate: elucidating the mechanism of action. CNS Drugs 19(6):517-537, 2005.
116. Boismare F, Daoust M, Moore N, Saligaut C, Lhuintre JP, Chretien P, Durlach J. A homotaurine derivative reduces the voluntary intake of ethanol by rats: are cerebral GABA receptors involved? Pharmac Biochem Behav 21:787-789, 1984.
117. Grant KA, Woolverton WL. Reinforcing and discriminative stimulus effects of Ca-acetyl homotaurine in animals. Pharmac Biochem Behav 32:607-611, 1989.
118. Zieglgansberger W, Hauser C, Putzke J, Spanagel R, Wetzel C. The enhanced excitability of central neurons following chronic alcohol intake is reduced by acamprosate. Alcohol Alcohol 30:5524-5526, 1995.
119. Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Central effects of acamprosate: part 1. Acamprosate blocks the glutamate increase in the nucleus accumbens microdialysate in ethanol withdrawn rats. Psychiatry Res 82(2):107-114, 1998.
120. Dahchour A, De Witte P. Effect of repeated ethanol withdrawal on glutamate microdialysate in the hippocampus. Alcohol Clin Exp Res 23(10):1698-1703, 1999.
121. Dahchour A, De Witte P. Ethanol and amino acids in the central nervous system: assessment of the pharmacological actions of acamprosate. Pro Neurobiol 60(4):343-362, 2000.
122. Allgaier C, Franke H, Sobottka H, Scheibler P. Acamprosate inhibits Ca2+ influx mediated by NMDA receptors and voltage-sensitive Ca2+ channels in cultured rat mesencephalic neurones. Naunyn Schmiedebergs Arch Pharmacol 362(4-5):440-443, 2000.
123. Rammes G, Mahal B, Putzke J, Parsons C, Spielmanns P, Pestel E, Spanagel R, Zieglgansberger W, Schadrack J. The anti-craving compound acamprosate acts as a weak NMDA-receptor antagonist, but modulates NMDA-receptor subunit expression similar to memantine and MK-801. Neuropharmacology 40(6):749-760, 2001.
124. Spanagel R, Zieglgansberger W. Anti-craving compounds for ethanol: new pharmacological tools to study addictive processes. Trends Pharmacol Sci 18(2):54-59, 1997.
125. Popp RL, Lovinger DM. Interaction of acamprosate with ethanol and spermine on NMDA receptors in primary cultured neurons. Eur J Pharmacol 394(2-3):221-231, 2000.
126. Mayer S, Harris BR, Gibson DA, Blanchard JA, Prendergast MA, Holley RC, Littleton J. Acamprosate, MK-801, and ifenprodil inhibit neurotoxicity and calcium entry induced by ethanol withdrawal in organotypic slice cultures from neonatal rat hippocampus. Alcohol Clin Exp Res 26(10):1468-1478, 2002.
127. AlQatari M, Khan S, Harris B, Littleton J. Acamprosate is neuroprotective against glutamate-induced excitotoxicity when enhanced by ethanol withdrawal in neocortical cultures of fetal rat brain. Alcohol Clin Exp Res 25(9):1276-1283, 2001.
128. Mayer S, Harris B, Gibson DA, Blanchard J, Prendergast MA, Holley RC, Littleton J. Acamprosate has no effect on NMDA-induced toxicity but reduces toxicity induced by spermidine or by changing the medium in organotypic hippocampal slice cultures from rat. Alcohol Clin Exp Res 26(5):655-662, 2002.
129. AlQatari M, Bouchenafa O, Littleton J. Mechanism of action of acamprosate. Part II. Ethanol dependence modifies effects of acamprosate on NMDA receptor binding in membranes from rat cerebral cortex. Alcohol Clin Exp Res 22(4):810-814, 1998.
130. Harris BR, Prendergast MA, Gibson DA, Rogers DT, Blanchard JA, Holley RC, Fu MC, Hart SR, Pedigo NW, Littleton JM. Acamprosate inhibits the binding and neurotoxic effects of trans-ACPD, suggesting a novel site of action at metabotropic glutamate receptors. Alcohol Clin Exp Res 26(12):1779-1793, 2002.
131. Harris BR, Gibson DA, Prendergast MA, Blanchard JA, Holley RC, Hart SR, Scotland RL, Foster TC, Pedigo NW, Littleton JM. The neurotoxicity induced by ethanol withdrawal in mature organotypic hippocampal slices might involve cross-talk between metabotropic glutamate type 5 receptors and N-methyl-D-aspartate receptors. Alcohol Clin Exp Res 27(11):1724-1735, 2003.
132. Bolo N, Nedelec JF, Muzet M, De Witte P, Dahchour A, Durbin P, Macher JP. Central effects of acamprosate: part 2. Acamprosate modifies the brain in-vivo proton magnetic resonance spectrum in healthy young male volunteers. Psychiatry Res 82(2):115-127, 1998.
133. Heyser CJ, Schulteis G, Durbin P, Koob GF. Chronic acamprosate eliminates the alcohol deprivation effect while having limited effects on baseline responding for ethanol in rats. Neuropsychopharmacology 18(2):125-133, 1998.
134. Hölter SM, Landgraf R, Zieglgansberger W, Spanagel R. Time course of acamprosate action on operant ethanol self-administration after ethanol deprivation. Alcohol Clin Exp Res 21(5):862-868, 1997.
135. Lhuintre JP, Daoust M, Moore ND, Chretien P, Saligaut C, Tran G, Boismare F, Hillemand B. Ability of calcium bis acetyl homotaurine, a GABA agonist, to prevent relapse in weaned alcoholics. Lancet 1:1014-1016, 1985.
136. Lhuintre JP, Moore N, Tran G, Steru L, Langrenon S, Daoust M, Parot P, Ladure P, Libert C, Boismare F, et al. Acamprosate appears to decrease alcohol intake in weaned alcoholics. Alcohol Alcohol 25:613-622, 1990.
137. Krystal JH, Cramer JA, Krol WF, Kirk GF, Rosenheck RA. Naltrexone in the treatment of alcohol dependence. N Engl J Med 345(24):1734-1739, 2001.
138. Liljequist S. The competitive NMDA receptor antagonist, CGP 39551, inhibits ethanol withdrawal seizures. Eur J Pharmacol 192(1):197-198, 1991.
139. Lamblin F, Deuceuninck D, De Witte P. Modulation of alcohol preference by NMDA antagonists in male rats. Alcohol Alcohol 28(6):639-647, 1993.
140. Ripley TL, Little H J. Effects on ethanol withdrawal hyperexcitability of chronic treatment with a competitive N-methyl-D-aspartate receptor antagonist. J Pharmacol Exp Ther 272(1):112-118, 1995.
141. Fidecka S, Langwinski R. Interaction between ketamine and ethanol in rats and mice. Pol J Pharmacol Pharm 41(1):23-32, 1989.
142. Morrisett RA, Rezvani AH, Overstreet D, Janowsky DS, Wilson WA, Swartzwelder HS. MK-801 potently inhibits alcohol withdrawal seizures in rats. Eur J Pharmacol 176(1):103-105, 1990.
143. Grant KA, Colombo G, Grant J, Rogawski MA. Dizocilpine-like discriminative stimulus effects of low-affinity uncompetitive NMDA antagonists. Neuropharmacology 35(12):1709-1719, 1996.
144. Koek W, Colpaert FC. Selective blockade of N-methyl-D-aspartate (NMDA)-induced convulsions by NMDA antagonists and putative glycine antagonists: relationship with phencyclidine-like behavioral effects. J Pharmacol Exp Ther 252(1):349-357, 1990.
145. Murata S, Kawasaki K. Common and uncommon behavioural effects of antagonists for different modulatory sites in the NMDA receptor/channel complex. Eur J Pharmacol 239(1-3):9-15, 1993.
146. Carter AJ. Many agents that antagonize the NMDA receptor-channel complex in vivo also cause disturbances of motor coordination. J Pharmacol Exp Ther 269(2):573-580, 1994.
147. Parsons CG, Danysz W, Hesselink M, Hartmann S, Lorenz B, Wollenburg C, Quack G. Modulation of NMDA receptors by glycine--introduction to some basic aspects and recent developments. Amino-Acids 14(1-3):207-216, 1998.
148. Yenari MA, Bell TE, Kotake AN, Powell M, Steinberg GK. Dose escalation safety and tolerance study of the competitive NMDA antagonist selfotel (CGS 19755) in neurosurgery patients. Clin Neuropharmacol 21(1):28-34, 1998.
149. Breese GR, Knapp DJ, Moy SS. Integrative role for serotonergic and glutamatergic receptor mechanisms in the action of NMDA antagonists: potential relationships to antipsychotic drug actions on NMDA antagonist responsiveness. Neurosci Biobehav Rev 26(4):441-55, 2002.
150. Bormann J. Memantine is a potent blocker of N-methyl-D-aspartate (NMDA) receptor channels. Eur J Pharmacol 166:591-592, 1989.
151. Kornhuber J, Bormann J, Retz W, Hubers M, Riederer P. Memantine displaces 3H-MK-801 at therapeutic concentrations in postmortem human frontal cortex. Eur J Pharmacol 166:589-590, 1989.
152. Kornhuber J, Bormann J, Hubers M, Rusche K, Riederer P. Effects of the 1-amino-adamantanes at the MK-801-binding site of the NMDA-receptor-gated ion channel: a human postmortem brain study. Eur J Pharmacol Molec Pharmacol 206:297-300, 1991.
153. Parsons CG, Quack G, Bresink I, Baran L, Przegalinski E, Kostowski W, et al. Comparison of the potency, kinetics and voltage-dependency of a series of uncompetitive NMDA receptor antagonists in vitro with anticonvulsive and motor impairment activity in vivo. Neuropharmacology 34:1239-1258, 1995.
154. Parsons CG, Gruner R, Rozental J, Millar J, Lodge D. Patch clamp studies on the kinetics and selectivity of N-methyl-Daspartate receptor antagonism by memantine (1-amino-3,5- dimethyladamantan). Neuropharmacology 32:1337-1350, 1993.
155. Gerzon K, Krumkalns EV, Brindle RL, Marshall FJ, Root MA. The adamantyl group in medicinal agents. I. Hypoglycemic N-arylsulfonyl-N%-adamantylureas. J Med Chem 6:760-763, 1963.
156. Grossmann W, Schutz W. Memantine and neurogenic bladder dysfunction in spastic conditions. Arzneim Forsch Drug Res 32:1273-1276, 1982.
157. Miltner FO. Use of symptomatic therapy with memantine in cerebral coma. II. Development of stretch syergisms in coma with brain stem symptoms. Arzneim Forsch Drug Res 32:1271-1273, 1982.
158. Miltner FO, Use of symptomatic therapy with memantine in cerebral coma. I. Correlation of coma stages and EEG spectral patterns. Arzneim Forsch Drug Res 32:1268-1270, 1982.
159. Schneider E, Fischer PA, Clemens R. Effects of oral memantine on symptoms of Parkinson's disease. Dtsch Med Wochenschr 109:987-990, 1984.
160. Mundinger F, Milios E. Treatment of severe spastic and extrapyramidal syndromes with Memantine, in combination or following stereotactic surgery. Nervenarzt 56:106-109, 1985.
161. Chen HSV, Lipton SA. Open-channel block of NMDA responses by the antiparkinson drug memantine. Soc Neurosci Abs 17(516):7, 1991.
162. Parsons CG, Pantev M. Disturbed glutamatergic transmission in dementia: improvement by akatinol memantine. Behav Pharmacol 388:39, 1991.
163. Chen HSV, Pellegrini JW, Aggarwal SK, et al. Open channel block of N-methyl-D-aspartate (NMDA) responses by memantine-therapeutic advantage against NMDA receptor-mediated neurotoxicity. J Neurosci 12:4427-4436, 1992.
164. Johnson JW, Kotermanski SE. Mechanism of action of memantine. Current Opinion in Pharmacology 6:61-67, 2006.
165. Parsons CG, Danysz W, Quack G. Memantine is a clinically well tolerated N-methyl-D-aspartate (NMDA) receptor antagonist - a review of preclinical data. Neuropharmacology 38:735-767, 1999.
166. Popik P, Skolnick P. The NMDA antagonist memantine blocks the expression and maintenance of morphine dependence. Pharmacol Biochem Behav 53:791-797, 1996.
167. Hölter SM, Danysz W, Spanagel R. Evidence for alcohol anti-craving properties of memantine. Eur J Pharmacol 314:R1-R2, 1996.
168. Spanagel R, Zieglgansberger W. Anti-craving compounds for ethanol: new pharmacological tools to study addictive processes. Trends Pharmacol Sci 18:54-59, 1997.
169. Bienkowski P, Danysz W, Kostowski W. Study on the role of glycine, strychnine-insensitive receptors (glycineB sites) in the discriminative stimulus effects of ethanol in the rat. Alcohol 15(1):87-91, 1998.
170. Hundt W, Danysz W, Hölter SM, Spanagel R. Ethanol and N-methyl-D-aspartate receptor complex interactions: A detailed drug discrimination study in the rat. Psychopharmacology 135:44-51, 1998.
171. Koros E, Kostowski W, Danysz W, Bienkowski P. Ethanol discrimination in the rat: lack of modulation by restraint stress and memantine. Naunyn-Schmied Arch Pharmacol 359:117-122, 1999.
172. Beleslin DB, Djokanovic N, Jovanovic-Micic D, Samardzic R. Opposite effects of GABA(A) and NMDA receptor antagonists on ethanol-induced behavioural sleep in rats. Alcohol 14:167-173, 1997.
173. Lukoyanov NV, Paula-Barbosa MM. Memantine, but not dizocilpine, ameliorates cognitive deficits in adult rats withdrawn from chronic ingestion of alcohol. Neuroscience Letters 309:45-48, 2001.
174. Maler JM, Esselmann H, Wiltfang J, Kunz N, Lewczuk P, Reulbach U, et al. Memantine inhibits ethanol-induced NMDA receptor up-regulation in rat hippocampal neurons. Brain Research 1052:156-162, 2005.
175. Escher T, Call SB, Blaha CD, Mittleman G. Behavioral effects of aminoadamantane class NMDA receptor antagonists on schedule-induced alcohol and self-administration of water in mice. Psychopharmacology (Berl) 187(4):424-434, 2006.
176. Parsons CG, Kalvinsh I, Kauss V, Jirgensons A, Gold M, Danysz W. US 6071966, 2000.
177. Sengul C, Dilbaz N, Okay T, Balci Sengul M. The effectiveness of memantine in alcohol withdrawal syndrom 18th Congr Eur Coll Neuropsychopharmacol (ECNP) (Oct 22-Oct 26, Amsterdam) Abst P.6.011, 2005.
178. Danysz W, Parsons CG, Jirgensons A, Kauss V, Tillner J. Amino-alkyl-cyclohexanes as a novel class of uncompetitive NMDA receptor antagonists. Current Pharmaceutical Design 8:835-843, 2002.
179. Bachteler D, Economidou D, Danysz W, Ciccocioppo R, Spanagel R. The effects of acamprosate and neramexane on cue-induced reinstatement of ethanol-seeking behavior in rat. Neuropsychopharmacology 30:1104-1110, 2005.
180. Hölter SM, Linthorst ACE, Reul JMHM, Spanagel R. Withdrawal symptoms in a long-term model of voluntary alcohol drinking in Wistar rats. Pharmacology Biochemistry and Behavior 66(1):143-151, 2000.
181. Bienkowski P, Krzascik P, Koros E, Kostowski W, Scinska A, Danysz W. Effects of a novel uncompetitive NMDA receptor antagonist, MRZ 2/579 on ethanol self-administration and ethanol withdrawal seizures in the rat. Eur J Pharmacol 413(1):81-89, 2001.
182. Kotlinska J, Biala G, Rafalski P, Bochenski M, Danysz W. Effect of neramexane on ethanol dependence and reinforcement. Eur J Pharmacol 503:95-98, 2004.
183. Berger ML, Schödl C, Noe C. Inverse agonists at the polyamine-sensitive modulatory site of the NMDA receptor: 50-fold increase in potency by insertion of an aromatic ring into an alkanediamine chain. Eur J Med Chem 33:3-14, 1998.
184. Littleton JM, Lovinger D, Liljequist S, Ticku R, Matsumoto I, Barron S. Role of polyamines and NMDA receptors in ethanol dependence and withdrawal. Alcohol Clin Exp Res (Suppl) 25(5):132S-136S, 2001.
185. Naassila M, Hammoumi S, Legrand E, Durbin P, Daoust M. Mechanism of action of acamprosate. Part I. Characterization of spermidine-sensitive acamprosate binding site in rat brain. Alcohol Clin Exp Res 22:802-809, 1998.
186. Rammes G, Mahal B, Putzke J, Parsons C, Spielmanns P, Pestel E, et al. The anti-craving compound acamprosate acts as a weak NMDA-receptor antagonist, but modulates NMDA-receptor subunit expression similar to memantine and MK-801. Neuropharmacology 40:749-760, 2001.
187. Font M, Sanmartin C, García H, Contreras S, Paeile C, Bilbeny N. A new polyamine derivative, a structural analog of spermine, with in vivo activity as an inhibitor of ethanol appetite. Bioorganic & Medicinal Chemistry 13:4375-4382, 2005.
188. Kew JN, Trube G, Kemp JA. State-dependent NMDA receptor antagonism by Ro 8-4304, a novel NR2B selective, non-competitive, voltage-independent antagonist. Br J Pharmacol 123(3):463-472, 1998.
189. Boyce S, Wyatt A, Webb JK, O'Donnell R, Mason G, Rigby M, et al. Selective NMDA NR2B antagonists induce antinociception without motor dysfunction: correlation with restricted localisation of NR2B subunit in dorsal horn. Neuropharmacology 38(5):611-623, 1999.
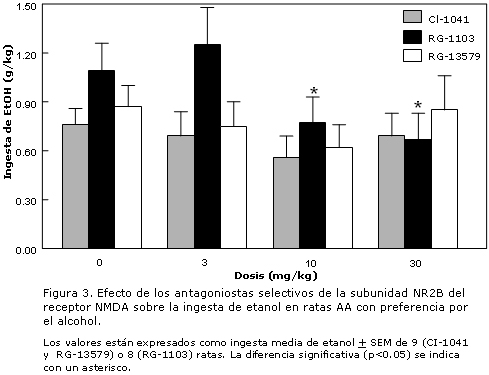
190. Kocsis P, Kovacs G, Farkas S, Horvath C, Szombathelyi Z, Tarnawa I. NR2B receptors are involved in the mediation of spinal segmental reflex potentials but not in the cumulative motoneuronal depolarization in vitro. Brain Res Bull 64(2):133-138, 2004.
191. Fillhard JA. The effects of CI-1041 in two tests of analgesia: acetic acid-induced writing test and formalin foot pad test. Soc Neurosci Abstr 26:617.4, 2000.
192. Chizh BA. Novel approaches to targeting glutamate receptors for the treatment of chronic pain: Review article. Amino Acids 23:169-176, 2002.
193. Wright JL, Gregory TF, Kesten SR, Boxer PA, Serpa KA, Meltzer LT, et al. Subtype-selective N-methyl-D-aspartate receptor antagonists: synthesis and biological evaluation of 1-(heteroarylalkynyl)-4-benzylpiperidines J Med Chem 43:3408-3419, 2000.
194. Kotlinska J, Liljequist S. Oral administration of glycine and polyamine receptor antagonists blocks ethanol withdrawal seizures. Psychopharmacology (Berl) 127(3):238-244, 1996.
195. Narita M, Soma M, Mizoguchi H, Tseng LF, Suzuki T. Implications of the NR2B subunit-containing NMDA receptor localized in mouse limbic forebrain in ethanol dependence. Eur J Pharmacol 401(2):191-195, 2000.
196. Nikam SS, Meltzer LT. NR2B selective NMDA receptor antagonists. Current Pharmaceutical Design 8:845-855, 2002.
197. Chenard BL, Menniti FS, Saltarelli MD. US 2002072538, 2002.
198. Mohacsi E, O'Brien JP. EP 0648744, 1995.
199. Wright JL, Kesten SR, Upasani RB, Lan NC. WO0000197A1, 2000.
200. Taniguchi K, Shinjo K, Mizutani M, Shimada K, Ishikawa T, Menniti FS, Nagahisa A. Antinociceptive activity of CP-101,606, an NMDA receptor NR2B subunit antagonist. Br J Pharmacol 122(5):809-812, 1997.
201. Murray F, Kennedy J, Hutson PH, Elliot J, Huscroft I, Mohnen K, et al. Modulation of 3H.MK-801 binding to NMDA receptors in vivo and in vitro. Eur J Pharmacol 397:263-270, 2000.
202. Chizh BA, Headley PM, Tzschentke TM. NMDA receptor antagonists as analgesics: focus on the NR2B subtype. Trends Pharmacol Sci 22(12):636-642, 2001.
203. Gogas KR. Glutamate-based therapeutic approaches: NR2B receptor antagonists. Current Opinion in Pharmacology 6:68-74, 2006.
204. Horvath C, Farkas S, Domany G, Borza I, Barta-Szalai G, Nagy J, Kolok S. WO0234718A1, 2002.
205. Borza I, Kolok S, Gere A, Agai-Csongor E, Agai B, Tarkanyi G, et al. Indole-2-carboxamides as novel NR2B selective NMDA receptor antagonists. Bioorganic & Medicinal Chemistry Letters 13:3859-3861, 2003.
206. Kiianmaa K, Stenius K, Sinclair JD. Determinants of alcohol preference in the AA and ANA rat lines selected for differential ethanol intake. Alcohol Alcohol Suppl 1:115-20, 1991.
207. Mann K. Pharmacotherapy of alcohol dependence. A review of the clinical data. CNS Drugs 18(8):485-450, 2004.
208. Kemp JA, McKernan RM. NMDA receptor pathways as drug targets. Nature Neurosci Supp 5:1039-1042, 2002.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: