EL PAPEL DE LOS FARMACOS QUIMIOTERAPEUTICOS CAPACES DE ATRAVESAR LA BARRERA HEMATOENCEFALICA: EXPERIENCIA DEL ITALIAN MELANOMA INTERGROUP (IMI)
(especial para SIIC © Derechos reservados)
Recepción del artículo: 22 de agosto, 2005
Aprobación: 26 de agosto, 2005
 Conclusión breve
En los últimos años se incrementó el número de estudios de fármacos capaces de atravesar la barrera hematoencefálica para tratar las metástasis cerebrales de los pacientes con melanoma. En este sentido, el Italian Melanoma Intergroup investigó la eficacia y seguridad de fármacos como temozolomida y fotemustina, entre otros, asociados o no a quimioterapia e inmunoterapia.
Conclusión breve
En los últimos años se incrementó el número de estudios de fármacos capaces de atravesar la barrera hematoencefálica para tratar las metástasis cerebrales de los pacientes con melanoma. En este sentido, el Italian Melanoma Intergroup investigó la eficacia y seguridad de fármacos como temozolomida y fotemustina, entre otros, asociados o no a quimioterapia e inmunoterapia.
 Resumen
El tratamiento del melanoma avanzado es un serio problema para los oncólogos, ya que aproximadamente un tercio de los pacientes presentarán metástasis cerebrales, las cuales agravan considerablemente el pronóstico. Por lo tanto, con el fin de aumentar la supervivencia general, es recomendable utilizar fármacos que sean capaces de atravesar la barrera hematoencefálica. Desde su creación en 1998, el Italian Melanoma Intergroup (IMI) ha llevado a cabo ensayos clínicos para mejorar el pronóstico de los pacientes con melanoma avanzado; en esta revisión se analizan cuatro estudios, en los cuales se utilizó al menos una droga capaz de atravesar la barrera hematoencefálica. En un estudio de fase III, en el que la quimioterapia se comparó con la bioquimioterapia, un subgrupo de pacientes recibió carmustina (BNCU) en las dos ramas de tratamiento y se obtuvo una respuesta global (RG) del 56%. Un estudio de fase II posterior con temozolomida (TMZ) e interferón alfa (IFN-α) mostró una RG del 12.5% en 41 pacientes, una supervivencia global (SG) de 14.7 meses y una incidencia de metástasis cerebrales del 22.5% luego de un período de seguimiento de 27 meses. En diciembre de 2002 concluyó otro estudio de fase II en el que 65 pacientes recibieron fotemustina, cisplatino (CDDP) e interleuquina-2 (IL-2) + IFN-γ y cuyos resultados se están analizando en la actualidad. En un estudio comparativo de fase III con TMZ + CDDP + IL-2 vs. dacarbazina + CDDP + IL-2 se está evaluando la utilidad potencial de estos fármacos para prevenir la aparición de metástasis cerebrales (en abril de 2005 se incluyeron 65 de los 142 pacientes planeados). En el futuro, el IMI se comprometerá a continuar la búsqueda de alternativas terapeúticas para mejorar el pronóstico desfavorable de los pacientes con melanoma avanzado, especialmente en relación con las metástasis cerebrales.
Resumen
El tratamiento del melanoma avanzado es un serio problema para los oncólogos, ya que aproximadamente un tercio de los pacientes presentarán metástasis cerebrales, las cuales agravan considerablemente el pronóstico. Por lo tanto, con el fin de aumentar la supervivencia general, es recomendable utilizar fármacos que sean capaces de atravesar la barrera hematoencefálica. Desde su creación en 1998, el Italian Melanoma Intergroup (IMI) ha llevado a cabo ensayos clínicos para mejorar el pronóstico de los pacientes con melanoma avanzado; en esta revisión se analizan cuatro estudios, en los cuales se utilizó al menos una droga capaz de atravesar la barrera hematoencefálica. En un estudio de fase III, en el que la quimioterapia se comparó con la bioquimioterapia, un subgrupo de pacientes recibió carmustina (BNCU) en las dos ramas de tratamiento y se obtuvo una respuesta global (RG) del 56%. Un estudio de fase II posterior con temozolomida (TMZ) e interferón alfa (IFN-α) mostró una RG del 12.5% en 41 pacientes, una supervivencia global (SG) de 14.7 meses y una incidencia de metástasis cerebrales del 22.5% luego de un período de seguimiento de 27 meses. En diciembre de 2002 concluyó otro estudio de fase II en el que 65 pacientes recibieron fotemustina, cisplatino (CDDP) e interleuquina-2 (IL-2) + IFN-γ y cuyos resultados se están analizando en la actualidad. En un estudio comparativo de fase III con TMZ + CDDP + IL-2 vs. dacarbazina + CDDP + IL-2 se está evaluando la utilidad potencial de estos fármacos para prevenir la aparición de metástasis cerebrales (en abril de 2005 se incluyeron 65 de los 142 pacientes planeados). En el futuro, el IMI se comprometerá a continuar la búsqueda de alternativas terapeúticas para mejorar el pronóstico desfavorable de los pacientes con melanoma avanzado, especialmente en relación con las metástasis cerebrales.
 Palabras clave
Melanoma, tratamiento, metástasis cerebrales, temozolomida, fotemustina
Clasificación en siicsalud
Palabras clave
Melanoma, tratamiento, metástasis cerebrales, temozolomida, fotemustina
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/75913
Especialidades
 Principal: Farmacología, Oncología,
Principal: Farmacología, Oncología,
 Relacionadas: Dermatología, Medicina Farmacéutica, Medicina Interna, Neurología,
Relacionadas: Dermatología, Medicina Farmacéutica, Medicina Interna, Neurología,
 Enviar correspondencia a:
Enviar correspondencia a:
Ruggero Ridolfi, MD, Head, Department of Medical Oncology, Morgagni-Pierantoni Hospital, Via Forlanini 34, 47100 Forlì, Italia
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Agradecimientos:Los autores desean agradecer a Gráinne Tierney por corregir el manuscrito.
THE ROLE OF CHEMOTHERAPEUTIC DRUGS CAPABLE OF CROSSING HEMATOENCEPHALIC BARRIERS IN THE TREATMENT OF ADVANCED MELANOMA: THE ITALIAN MELANOMA INTERGROUP (IMI) EXPERIENCE
 Abstract
Abstract
The treatment of advanced melanoma is still a major problem for oncologists, especially as about one third of patients develop brain metastases, which considerably worsens prognosis. In order to increase overall survival, it is mandatory to use drugs that are capable of crossing the hematoencephalic barrier. Since it was founded in 1998, the Italian Melanoma Intergroup (IMI) has carried out clinical studies to improve the prognosis of patients with advanced melanoma, and the present review examines four studies in which at least one drug potentially capable of crossing this barrier was used. In one phase III trial in which chemotherapy was compared with biochemotherapy, a subgroup of patients in both arms also received BNCU, obtaining an overall response (OR) of 53%. A subsequent phase II trial of temozolomide (TMZ) and alpha interferon (α-IFN) in 41 patients achieved an OR of 12.5%, with an overall survival (OS) of 14.7 months and a 22.5% incidence of brain metastases after a follow up of 27 months. Another phase II study of 65 patients who received fotemustine, cisplatin (CDDP) and interleukin-2+ α-IFN was closed in December 2004 and results are currently being analyzed. A phase III comparative study of TMZ + CDDP + IL-2 vs. dacarbazine + CDDP + IL-2 is ongoing to analyze their potential usefulness in preventing the development of brain metastases (65 of the planned 142 patients had been recruited by April 2005). In the future, IMI will continue its commitment to look for ways of improving the poor prognosis of patients with advanced melanoma, especially in relation to brain metastases.
IL RUOLO DEI FARMACI CHEMIOTERAPICI IN GRADO DI SUPERARE LA BARRIERA EMATOENCEFALICA NEL TRATTAMENTO DEL MELANOMA IN FASE AVANZATA: L’ESPERIENZA DELL’INTERGRUPPO MELANOMA ITALIANO (IMI)SommarioIl trattamento del melanoma in fase avanzata è tuttora uno dei maggiori problemi che assillano l’Oncologo, anche perché circa un terzo di tali pazienti sviluppa metastasi cerebrali, peggiorando considerevolmente la prognosi. Nell’individuare terapie che possano aumentare la sopravvivenza globale (OS) è quindi importante impiegare anche farmaci che siano in grado di superare la barriera ematoencefalica. Fin dalla sua fondazione avvenuta nel 1998, l’Intergruppo Melanoma Italiano (IMI) ha condotto studi clinici con l’obbiettivo di migliorare la prognosi dei pazienti affetti da melanoma avanzato. La presente review esamina 4 studi nei quali è stato impiegato almeno un farmaco capace potenzialmente di superare la barriera ematoencefalica. Nell’ambito di uno studio di fase III in cui veniva confrontata la chemioterapia con la biochemioterapia, un sottogruppo di pazienti in entrambi i bracci aveva ricevuto BCNU, ottenendo un risposta globale (OR) del 53%. In uno successivo studio di fase II con l’uso di Temozolomide (TMZ) ed Alfa-Interferone (α-IFN) su 41 pazienti si è ottenuta una OR del 12.5% con una OS di 14.7 mesi ed una incidenza di metastasi cerebrali dopo un follow-up di 27 mesi del 22.5%. Un ulteriore studio di fase II su 65 pazienti che hanno ricevuto Fotemustina (FTMS), Cisplatino (CDDP), Interleuchina-2 (IL-2) ed α-IFN è stato chiuso nel dicembre 2004: i risultati sono attualmente in analisi. E’ attualmente in corso uno studio di fase III con TMZ+CDDP+IL-2 versus Dacarbazina+CDDP+IL-2 allo scopo di verificare la possibilità di prevenire lo sviluppo di metastasi cerebrali. Ad aprile 2005, 65 dei 142 pazienti previsti sono stati arruolati. E’ intenzione dell’IMI proseguire in futuro nel tentativo di migliorare la prognosi dei pazienti affetti da melanoma avanzato, specialmente in relazione all’insorgenza delle metastasi cerebrali.
 Key words
Key words
Melanoma, therapy, brain metastases, temozolomide, fotemustine
EL PAPEL DE LOS FARMACOS QUIMIOTERAPEUTICOS CAPACES DE ATRAVESAR LA BARRERA HEMATOENCEFALICA: EXPERIENCIA DEL ITALIAN MELANOMA INTERGROUP (IMI)
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
El pronóstico de los pacientes con melanoma avanzado no pasibles de ser sometidos a intervenciones quirúrgicas radicales sigue siendo desfavorable. De hecho, la mediana de supervivencia de estos pacientes es de 6-9 meses, con una probabilidad de sobrevivir a los cinco años del 5%.1,2
En los últimos años se intentaron numerosos estudios clínicos diseñados para mejorar la supervivencia de los pacientes en este contexto y demostrar la mejor eficacia, a través de la respuesta global (RG) y supervivencia global (SG), de las asociaciones quimioinmunoterapéuticas en relación con el fármaco más utilizado, la dacarbazina (DTIC).3,4 No obstante, este último permanece como el tratamiento de referencia ya que ningún estudio controlado y aleatorizado mostró la superioridad de otros agentes.5
La frecuencia elevada de las metástasis cerebrales contribuye significativamente con el pronóstico desfavorable de los pacientes con melanoma avanzado. Estas metástasis, observadas en el 30% al 40% de los enfermos, se asocian con una mediana de SG de 3-4 meses.6,7 Por lo tanto, se debe garantizar firmemente la búsqueda de nuevas drogas capaces de atravesar la barrera hematoencefálica en los pacientes con melanoma. Durante muchos años se utilizaron fármacos como las nitrosureas, especialmente la carmustina (BCNU), y recientemente, agentes como la temozolomida (TMZ) y la nitrosurea de tercera generación, fotemustina (FTMS), han ocupado un lugar preponderante.
El Italian Melanoma Intergroup (IMI), fundado en 1998, llevó a cabo ensayos clínicos con estos fármacos por considerarlos relevantes en el tratamiento antiblástico del melanoma. En particular, en el marco de un ensayo clínico de fase III, se realizó un estudio en una subpoblación de pacientes tratados con BCNU en comparación a la quimioterapia asociada a la quimioinmunoterapia. También se condujeron dos ensayos de fase II de combinaciones basadas en TMZ (TMZ + IFN-α) y FTMS (CDDP + FTMS + IL-2 + IFN-α) y un estudio de fase III actual en donde la asociación de CDDP + TMZ + IL-2 se comparó con la de CDDP + DTIC + IL-2.
A continuación se describen los estudios realizados por el IMI de las drogas que atraviesan la barrera hematoencefálica.
Quimioterapia (QT) y bioquimioterapia (bioQT) en pacientes con melanoma avanzado: terapia de combinación con nitrosurea8
El IMI realizó un estudio multicéntrico aleatorizado en que se comparó un régimen quimioterápico estándar de DTIC y cisplatino (CDDP) (CT) vs. el mismo esquema más el agregado de IL-2 e IFN-α utilizados como inmunomoduladores (bioQT). La IL-2 y el IFN-α fueron administrados por vía subcutánea a dosis bajas, de manera tal de permitir su uso en los pacientes ambulatorios por un período prologado (1 año) o hasta la recaída, en un plan de mantenimiento para estudiar la posibilidad de prolongar el tiempo hasta la progresión.9,11
Antes del comienzo del estudio se requirió que los centros participantes determinaran o no el agregado de una nitrosurea (BCNU) al esquema QT o bioQT.
Tratamiento
Tres de los 27 centros decidieron utilizar la combinación que incluyera BCNU. Los pacientes fueron aleatorizados para recibir un tratamiento tanto con quimioterapia (QT) como con quimioinmunoterapia (bioQT). En el primer día, todos los pacientes recibieron 75 mg/m2 de CDDP por vía intravenosa (i.v.) con el esquema de hidratación estándar, 800 mg/m2 de DTIC i.v. y 150 mg/m2 de BCNU (régimen QT). La rama de los pacientes medicados con el régimen bioQT recibió el mismo esquema QT más 4 500 000 UI de IL-2 por vía subcutánea (s.c.) desde el día 3 al 5 y del 8 al 12. Además, se agregaron 3 000 000 U de IFN-α-2b por vía intramuscular (i.m.) en los días 3 y 5 y posteriormente tres veces por semana.
El tratamiento se repitió cada 21 días durante 6 ciclos o hasta la progresión o toxicidad grave. La IL-2 se administró en jeringas de insulina, las cuales fueron preparadas, facilitadas a los pacientes y almacenadas en heladeras hasta que el fármaco se volviese a aplicar en el hogar durante los siguientes 3-4 días.
Luego del 6º ciclo, los pacientes que recibieron bioQT continuaron medicados con IL-2 e IFN-α en monoterapia durante 12 meses o hasta la presentación de progresión o toxicidad grave. Se analizó el tratamiento de la toxicidad antas de cada ciclo con los criterios de la OMS. En el caso de presentarse toxicidad hematológica, se redujeron las dosis de los fármacos de acuerdo con lo recomendado en el protocolo.
Resultados
Entre marzo de 1997 y diciembre de 1999, 27 centros incluyeron 176 pacientes, de los cuales 80 y 87 fueron aleatorizados para recibir QT o bioQT, respectivamente. Tres centros agregaron BCNU a cada tratamiento. En la tabla 1 se muestran las características de los 17 pacientes que también recibieron BCNU (un paciente se rehusó a recibir esta asociación). En la tabla 2 se incluyeron los datos relacionados con la respuesta tumoral, su duración y la supervivencia global (SG) de cada paciente según el tratamiento recibido.


No se observaron respuestas completas (RC). Cinco pacientes de la rama tratada con QT y 4 de la bioQT mostraron respuestas parciales (RP) e, independientemente del tratamiento, 9 de los 17 pacientes (53%) respondieron a los fármacos, observándose 6 respuestas en 9 pacientes con lesiones múltiples (vísceras/hígado ± otras).
En los que respondieron al tratamiento, la duración de la respuesta y la supervivencia fueron de 1.2-3.6 y 4.1-18.4 meses, respectivamente. Hay que destacar que la supervivencia más prolongada (27.8 meses) fue observada en un paciente con compromiso de las partes blandas y enfermedad estable.
En 10 pacientes (59%) el tratamiento se administró según el protocolo, en 2 individuos (12%) se redujo la dosis menos del 25% y en 1 fue necesario disminuirla más del 25%. Cuatro pacientes fueron retirados del estudio luego de analizar la respuesta clínica.
Los eventos adversos observados más importantes fueron, de acuerdo a lo esperado, los hematológicos. Cuatro pacientes (44%) que recibieron QT presentaron leucopenia/granulocitopenia de grado 3 y en otros 4 se comunicó toxicidad de grado 4. En 7 pacientes (78%) se observó trombocitopenia de grado 4.
Cuatro pacientes medicados con bioQT presentaron leucopenia/granulocitopenia de grado 3, y 4 más mostraron toxicidad de grado 4 y trombocitopenia.
Conclusiones
Los resultados de este análisis, llevado a cabo sobre un número reducido de pacientes con melanoma, sugieren que el agregado de una nitrosurea a la quimioterapia o a la bioquimioterapia, podrían mejorar las tasas de respuesta. Si bien en este estudio no se investigó específicamente la aparición consecutiva de metástasis cerebrales, el IMI planea conducir otros estudios de series de casos más numerosos en los que se utilicen asociaciones farmacológicas, las cuales, como en caso de las nitrosureas, sean capaces de atravesar la barrera hematoencefálica.
Temozolomida e interferón-alfa en el melanoma metastático: estudio de fase II del Italian Melanoma Intergroup (IMI)12
Un nuevo agente alquilante oral, la temozolomida (TMZ), demostró actividad similar a la de la DTIC en el tratamiento del melanoma metastático.13 Es capaz de atravesar la barrera hematoencefálica y mostró ser efectiva en los tumores cerebrales primarios y metástasis cerebrales, incluidas las del melanoma.14,15 Además, es una droga muy manejable y de toxicidad limitada y se están realizando estudios para identificar asociaciones con otros fármacos de manera tal de mejorar su impacto terapéutico.
En un intento por identificar terapéuticamente las asociaciones quimioinmunoterapéuticas efectivas en el melanoma metastático y verificar cualquier aumento de la toxicidad, el IMI decidió adoptar un esquema gradual para evaluar las nuevas combinaciones terapéuticas. Por lo tanto, se condujo un estudio de fase II en el que se analizó la asociación de TMZ con IFN-α. Este modificador de respuestas biológicas probó ser efectivo en el melanoma y su asociación con DTIC garantiza un aumento del 53% en la respuesta tumoral (p = 0.01), si bien no existieron diferencias significativas en la SG comparada a la obtenida con la DTIC sola.16
El objetivo principal de este estudio fue analizar la actividad de esta asociación farmacológica en relación con la tasa de respuesta. Los objetivos secundarios fueron observar la incidencia de metástasis cerebrales y evaluar la tolerabilidad del tratamiento, seguridad y supervivencia del paciente.
Tratamiento
La TMZ se administró por vía oral una vez por día durante 5 días consecutivos en dosis de 200 mg/m2/día y el IFN-α en dosis de 5 UM (unidades murinas) subcutáneas 3 veces por semana, sin interrupción. La TMZ fue provista sin cargo por Schering-Plough. El tratamiento se repitió cada 28 días. Si se presentaban vómitos durante el curso de la administración de estos fármacos no se permitió la redosificación de los pacientes antes de la próxima dosis programada. La reducción de las dosis se dispuso de la siguiente manera: si el recuento de glóbulos blancos era inferior a 3 000, se determianba la cantidad de neutrófilos, y si estos eran inferiores a 1 500 o las plaquetas a 90 000, el tratamiento se demoraba 1 semana. De persistir estos dos recuentos, la dosis de TMZ se disminuía un 25%. La reducción de dosis se mantenía durante todos los ciclos restantes. Si en la segunda semana de tratamiento, el recuento de neutrófilos persistía en menos de 1 000 y el de las plaquetas en menos de 70 000, se suspendía la administración de estos fármacos. En presencia de eventos de toxicidad no hematológica de grado 3 (excepto fiebre y alopecia), el tratamiento se demoraba por 1-2 semanas. La toxicidad no hematológica de grado 4 resultó en la suspensión del tratamiento o en la retirada del estudio. En ausencia de la progresión de la enfermedad o de toxicidad inaceptable, los pacientes continuaron con el tratamiento hasta un máximo de 8 ciclos.
Resultados
Entre junio de 2000 y julio de 2001, ingresaron al estudio 141 pacientes. Sus características y enfermedad de base se muestran en la tabla 3. La mediana de la edad fue 58 años y el 87% de los pacientes presentó un estado general ECOG (Eastern Cooperative Oncology Group) de 0. La mayoría de los pacientes tenían metástasis hepáticas o viscerales y 6 individuos presentaron metástasis de las partes blandas y nódulos linfáticos. Trece pacientes habían recibido tratamiento adyuvante previo: 9, medicados con dosis bajas de IFN (3 UM tres veces por semana por períodos de entre 6 y 9 meses); 2, con dosis altas de IFN según el régimen de Kirkwood,17 y 2, con radioterapia locorregional. Un paciente no comenzó el tratamiento y no se lo pudo seguir luego de registrarse en el estudio.

De los 40 pacientes tratados, 5 presentaron respuestas globales (RG) (12.5%) y consistieron en 2 RC (5%) de 1.5 y 2 meses de duración y 3 RP (7.5%) de 2.5, 3.5 y 13.5 meses. Además, 13 pacientes (32.5%) estabilizaron su enfermedad (SD), con una duración mediana de 4 meses (tabla 4). La mediana del período de seguimiento para el análisis del tiempo a la progresión (TTP) fue de 13.5 y 14.7 meses, respectivamente.
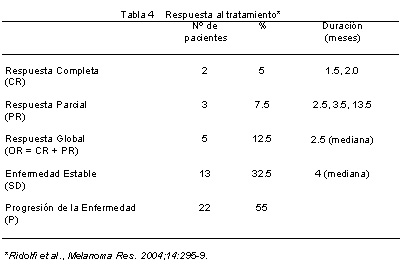
Como se muestra en la figura 1, la mediana del TTP para todos los pacientes fue de 2.6 meses (intervalo de confianza del 95% [CI], 2-4 meses) y la mediana de la SG fue de 11.8 meses (IC 95%, 6.2-16.2 meses). La probabilidad de supervivencia libre de progresión (SLP) fue de 29% (IC95%, 0.15-0.43 meses) y la probabilidad de supervivencia de 67% (IC95%, 0.52-0.82) meses.

En los pacientes que respondieron, la enfermedad comprometió los siguientes órganos: pulmón y nódulos linfáticos en los 2 pacientes con RC e hígado, pulmón + hígado y piel + nódulos linfáticos en los 3 pacientes con RP.
Desde el comienzo del estudio (junio de 2000) y hasta septiembre de 2002 (14 meses posteriores al término), 9 (22.5%) de los 40 pacientes presentaron metástasis cerebrales, siendo éstas el sitio primario de progresión en 3 individuos y el subsecuente en 6.
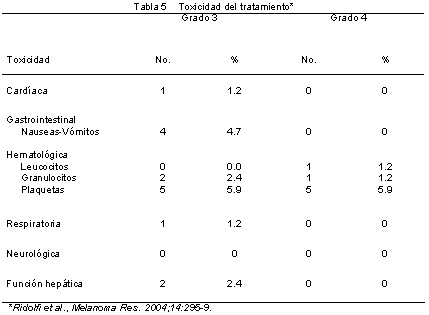
Se administraron en total 113 ciclos de quimioterapia. De los 10 pacientes con toxicidad hematológica de grados 3-4, 6 requirieron reducción de la dosis de TMZ en un 25% y el IFN se suspendió en los otros 4 pacientes durante una mediana de 5 días. Un paciente presentó toxicidad cardíaca de grado 3 (pericarditis con alteraciones funcionales y del ritmo), la cual resolvió con el tratamiento médico adecuado. En cuatro pacientes se observó toxicidad gastrointestinal de grado 3 (1 gastritis y 1 diarrea) y en 1 paciente se comunicó una toxicidad respiratoria de grado 3. Todas resolvieron luego del tratamiento sintomático. No se comunicaron fiebre de grado 3 y astenia, posiblemente por el tratamiento previo con paracetamol. No hubo muertes relacionadas con el tratamiento (tabla 5).
Conclusiones
En este estudio, la asociación de TMZ e IFN-α obtuvo una RG de 12.5%, mientras que un estudio similar llevado a cabo en España con IFN-α en dosis de 10 UM comunicó una RG del 20% en 25 pacientes tratados. Por lo tanto, pareciera que el agregado de IFN no potencia la actividad de la TMZ.
La mayor parte de nuestros datos coinciden con los comunicados en la literatura,19-22 mientras que la supervivencia de 11.8 meses fue mayor, probablemente porque los pacientes con metástasis cerebrales fueron excluidos del estudio. Sin embargo, la buena tolerabilidad de este régimen brinda la posibilidad de conducir nuevos estudios en los cuales otros fármacos quimioterapéuticos o quimioinmunoterapéuticos –como la IL-2– puedan ser utilizados en combinación.
Algunos datos publicados parecen sugerir que la TMZ posee un potencial curativo y la capacidad de reducir la incidencia de las metástasis cerebrales.14,15,23 En nuestro estudio, el porcentaje con lesiones cerebrales fue del 22.5%, el cual es levemente inferior a la tasa esperada de > 30%, aunque nuestra serie de casos limitada no permitió que se extrajeran conclusiones de estos resultados. Actualmente se está realizando un estudio italiano multicéntrico de fase III para analizar el impacto de la TMZ sobre las metástasis cerebrales y esclarecer si este fármaco es capaz de prevenir o demorar su presentación.
Ensayo multicéntrico, abierto y no comparativo para evaluar la eficacia y tolerabilidad de la fotemustina en asociación con la bioquimioterapia en pacientes con melanoma avanzado
La fotemustina (FTMS) es una nitrosurea que contiene un grupo transportador fosfoalanina unido al radical nitrosurea, lo que hace a la droga muy lipofílica, según lo mostrado por el coeficiente de partición octanol/agua, el cual se encuentra en un intervalo óptimo cuando se lo compara al del BCNU o al del CCNU.24
En un estudio, la FTMS utilizada en monoterapia indujo una tasa de respuesta global del 24.2% y en algunas pacientes las respuestas fueron de acción prolongada.25 Otro estudio comunicó que la asociación entre FTMS y DTIC resultó en una RG del 27%, que se mantuvo por 21 semanas.26 Terheyden, quien investigó la eficacia de la combinación con FTMS + IL-2 en 19 pacientes con melanoma metastásico, indicó que podría ser útil estudiar la asociación compleja de la bioquimioterapia basada en la fotemustina.27
El objetivo de nuestro estudio fue evaluar la eficacia y tolerabilidad de este régimen terapéutico a través de un ensayo de fase II, para lo cual se planeó la inclusión de 60 pacientes con melanoma.
Tratamiento
FTMS 1 000 mg/m2 en 250 ml de una solución de glucosa al 5%; 1 hora de infusión en el día 1.
CDDO 75 mg/m2 en 250 ml de solución fisiológica; infusión de 30 minutos en el día 1 (con hiperhidratación salina durante 4 horas).
IL-2 4.5 MIU s.c. en los días 3-5 y 8-12.
IFN 3 MU s.c. en los días 3, 5-8. 10, 12-15, 17, 19.
El régimen se repitió cada 3 semanas durante 6 ciclos.
Régimen de mantenimiento: IL-2 a la misma dosis durante 8 días/mes (igual al anterior) hasta 12 meses o progresión de la enfermedad. IFN a la misma dosis 3 veces por semana hasta 12 meses o progresión de la enfermedad.
Resultados
El estudio terminó en diciembre de 2004 y se incluyeron 65 pacientes. El análisis de los datos se completará hacia finales de 2005.
Ensayo de fase III aleatorizado de DTIC-cisplatino e IL-2 versus temozolomida-cisplatino e IL-2 en pacientes con melanoma metastático
El fracaso de los regímenes bioquimioterapéuticos actuales suele comunicarse en relación con las recaídas del sistema nervioso central (SNC) y la mayoría de los pacientes con enfermedad metastásica avanzada finalmente morirán por la diseminación cerebral o insuficiencia respiratoria.28,29 En un estudio se comunicó que la mediana de supervivencia de 702 pacientes con metástasis cerebrales fue de 113.2 días, las cuales contribuyeron a la muerte del 94.5% de los individuos.6 En el estudio de Chapman la inclusión en la combinación quimioterapéutica de agentes que puedan cruzar eficazmente la barrera hematoencefálica, como la carmustina (régimen Dartmouth), no disminuyó la incidencia de las metástasis cerebrales en comparación a la DTIC sola.3 Por lo tanto, la prevención de las complicaciones del SNC constituye un desafío importante en el tratamiento del melanoma.
Sobre la base de experiencias previas, el IMI comenzó un estudio multicéntrico de fase III para evaluar la eficacia de la temozolomida en la prevención de las metástasis cerebrales en los pacientes con melanoma avanzado que no habían recibido tratamiento previo con quimioterapia sistémica.
El criterio de valoración principal fue el impacto sobre la supervivencia libre de metástasis cerebrales. Criterios secundarios fueron la SG, la toxicidad y la calidad de vida. En este estudio se incluirá un total de 142 pacientes provenientes de 20 centros.
Tratamiento
Rama A: cisplatino 75 mg/m2 i.v. durante 1 hora y dacarbazina 800 mg/m2 i.v. durante 30-60 minutos en forma consecutiva en el día 1, seguido de interleuquina-2 (IL-2) 3 UM s.c. dos veces por día desde el día 9 al 17.
Rama B: cisplatino 75 mg/m2 i.v. durante 1 hora en el día 1, temozolomida 200 mg/m2 diarios desde el día 1 al 5 e interleuquina-2 (IL-2) 3 MU s.c. dos veces por día desde el día 9 al 17.
Los ciclos de quimioterapia se repetirán cada 28 días, con un máximo de 6 ciclos o hasta la presencia de toxicidad inaceptable o progresión de la enfermedad.
Cálculo del tamaño de la muestra
En los pacientes con melanoma, la incidencia esperada de metástasis cerebrales a los 12 meses es de aproximadamente 30%. Se espera que el tratamiento con temozolomida reduzca esta tasa de incidencia al 12%. Esta disminución corresponde a un índice de riesgo (HR) de 0.57, es decir una reducción del 57% en el riesgo instantáneo de presentar un evento en el grupo medicado con temozolomida en comparación a los que recibieron dacarbazina. Para detectar una diferencia con un poder estadístico del 80% y un nivel alfa del 5% (prueba de dos colas) son necesarios un total de 30 eventos. Si se asume un período de 24 meses, un seguimiento de hasta 36 meses y una tasa de abandono del 5%, se precisa aleatorizar 30 pacientes en este estudio.
Resultados
En dicho estudio intervienen quince centros italianos y hasta abril de 2005 se incluyeron 60 pacientes. La finalización está programada para finales de 2005.
Discusión general y conclusiones
En los pacientes con melanoma avanzado, la incidencia elevada de metástasis cerebrales contribuye indudablemente con su pronóstico desfavorable. No es casual que dos de las nuevas drogas antiblásticas utilizadas para el tratamiento del melanoma sean capaces de atravesar la barrera hematoencefálica y por lo tanto ser potencialmente activas contra las metástasis cerebrales.
En el estudio comparativo de fase III de Middleton se mostró que la TMZ era tan efectiva como la DTIC, la cual, como se mencionó anteriormente, es la droga de referencia actual. Sin embargo, la TMZ probó inducir una mejor adhesión al tratamiento y ser menos tóxica que la DTIC.13 Los estudios retrospectivos llevados a cabo por Summers y col. mostraron, incluso en series pequeñas de casos, que se pueden obtener resultados clínicos importantes en relación con las metastasis cerebrales e indicaron la potencialidad de la TMZ para ser utilizada en los estadios tempranos de la enfermedad así como en su prevención.14,23,30 De esta manera, el IMI actualmente conduce un estudio de fase III para investigar estas hipótesis.
La utilización de FTMS en el melanoma avanzado, estudiada por numerosos autores franceses25,26,31,32 e italianos33,34 obtuvo amplia aceptación en el ensayo de fase III de Avril en el que se comparó DTIC con FTMS. En este estudio, la RG fue de 15.5 vs. 7.2% y la SG de 7.3 vs. 5.6 meses a favor de la FTMS, con un valor de p (p = 0.04) justo por debajo de la significación estadística.35
Los ensayos de fase II realizados por el IMI tuvieron como objetivo evaluar la eficacia y tolerabilidad de estos fármacos en asociación con otras drogas quimioterapéuticas e inmunoterapéuticas. La tolerabilidad probó ser aceptable y se mostró que pueden diseñarse estudios más complejos y definir mejor el papel de estos nuevos fármacos, según lo sustentado por los datos biológicos y farmacocinéticos.
El IMI espera resultados interesantes de su estudio de fase III en el que se analiza el papel desempeñado por la TMZ para disminuir la aparición de las metástasis cerebrales en los pacientes con melanoma avanzado.36 Esta asociación podría ser particularmente útil, según los datos de la farmacocinética preclínica, lo que indica que la TMZ ejerce una influencia positiva para la acción de otros agentes quimioterapéuticos en el cerebro.37
El autor declara que: “No hay cuestiones financieras ni de otro tipo vinculadas al presente manuscrito que puedan llevar a un conflicto de intereses”.
 Bibliografía del artículo
Bibliografía del artículo
- Boyle P, Maisonneuve P, Dorè JF. Epidemiology of malignant melanoma. Brit Med Bull. 1995; 3:523-47.
- Lee ML, Tomsu K, Von Eschen KB. Duration of survival for disseminated malignant melanoma: results of a meta-analysis. Melanoma Res. 2000; 10:81-92.
- Chapman PB, Einhorn LH, Meyers ML, et al. Phase III multicenter randomized trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma. J Clin Oncol. 1999; 17:2745-51.
- Atkins MB, Kunkel L, Sznol M, et al. High-dose recombinant interleukin-2 therapy in patients with metastatic melanoma: long-term survival update. Cancer J Sci Am. 2000; 6(Suppl 1):S11-4.
- Bajetta E, Del Vecchio M, Bernard-Marty C, et al. Metastatic melanoma: chemotherapy. Semin Oncol. 2002; 29:427-45.
- Sampson JH, Carter JH Jr, Friedman AH, et al. Demographics, prognosis, and therapy in 702 patients with brain metastases from malignant melanoma. J Neurosurg. 1998; 88:11-20.
- Chiarion Sileni V, Nortilli R, Aversa SM, et al. Phase II randomized study of dacarbazine, carmustine, cisplatin and tamoxifen versus dacarbazine alone in advanced melanoma patients. Melanoma Res. 2001; 11:189-96.
- Ridolfi R, Tanganelli L, Scelzi E, et al. Chemotherapy and bio-chemotherapy in patients with advanced melanoma: combination therapy with a nitrosourea. J Chemother. 2003; 15:198-202.
- Ridolfi R, Chiarion-Sileni V, Guida M, et al. Cisplatin, dacarbazine with or without subcutaneous interleukin-2, and interferon alpha-2b in advanced melanoma outpatients: results from an Italian multicenter phase III randomized clinical trial. J Clin Oncol. 2002; 20:1600-7.
- Chiarion-Sileni V, Del Bianco P, De Salvo GL, et al. Quality of life evaluation in a randomised trial of chemotherapy versus bio-chemotherapy in advanced melanoma patients. Eur J Cancer. 2003; 39:1577-85.
- Guida M, Ravaioli A, Sileni VC, et al. Fibrinogen: a novel predictor of responsiveness in metastatic melanoma patients treated with bio-chemotherapy: IMI (Italian Melanoma Inter-group) trial. J Transl Med. 2003; 1:13.
- Ridolfi R, Romanini A, Sileni VC, et al. Temozolomide and interferon-alpha in metastatic melanoma: a phase II study of the Italian Melanoma Intergroup. Melanoma Res. 2004; 14:295-9.
- Middleton MR, Grob JJ, Aaronson N, et al. Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J Clin Oncol. 2000; 18:158-66.
- Paul MJ, Summers Y, Calvert AH, et al. Effect of temozolomide on central nervous system relapse in patients with advanced melanoma. Melanoma Res. 2002; 12:175-8.
- Agarwala SS, Kirkwood JM, Gore M, et al. Temozolomide for the treatment of brain metastases associated with metastatic melanoma: a phase II study. J Clin Oncol. 2004; 22:2101-7.
- Huncharek M, Caubet JF, McGarry R. Single-agent DTIC versus combination chemotherapy with or without immunotherapy in metastatic melanoma: a meta-analysis of 3273 patients from 20 randomized trials. Melanoma Res. 2001; 11:75-81.
- Kirkwood JM, Strawderman MH, Ernstoff MS, et al. Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol. 1996; 14:7-17.
- Garcia Martin M, Tres A, Crespo C, et al. Phase II multicenter study of temozolomide in combination with interferon alfa-2b in metastatic malignant melanoma. Proc Am Soc Clin Oncol. 2002; 21:1389a.
- Allen IE, Kupelnick B, Kumashiro M, et al. Efficacy of interleukin-2 in the treatment of metastatic melanoma. Cancer Ther. 1998; 1:168-73.
- Agarwala SS, Kirkwood JM. Temozolomide in combination with interferon alpha-2b in patients with metastatic melanoma: a phase I dose-escalation study. Cancer. 2003; 97:121-7.
- Danson S, Lorigan P, Arance A, et al. Randomized phase II study of temozolomide given every 8 hours or daily with either interferon alfa-2b or thalidomide in metastatic malignant melanoma. J Clin Oncol. 2003; 21:2551-7.
- Eigentler TK, Caroli UM, Radny P, et al. Palliative therapy of disseminated malignant melanoma: a systematic review of 41 randomised clinical trials. Lancet Oncol. 2003; 4:748-59.
- Summers Y, Middleton M, Calvert H, et al. Effect of temozolomide (TMZ) on central nervous system (CNS) relapse in patients with advanced melanoma. Proc Am Soc Clin Oncol. 1999; 18:2048a.
- Kleeberg UR, Engel E, Israels P, et al. Phase II trial of fotemustine in patients with metastatic melanoma (EORTC-MCG 18881). Onkologie. 1991; 14:81-3.
- Petit T, Borel C, Rixe O, et al. Complete remission seven years after treatment for metastatic malignant melanoma. Cancer. 1996; 77:900-2.
- Avril MF, Bonneterre J, Cupissol D, et al. Fotemustine plus dacarbazine for malignant melanoma. Eur J Cancer. 1992; 28:1807-11.
- Terheyden P, Becker JC, Kampgen E, et al. Sequential interferon-alpha2b, interleukin-2 and fotemustine for patients with metastatic melanoma. Melanoma Res. 2000; 10:475-82.
- Keilholz U, Gore ME. Biochemotherapy for advanced melanoma. Semin Oncol. 2002 Oct; 29(5):456-61.
- Tsao H, Atkins MB, Sober AJ. Management of cutaneous melanoma. N Engl J Med. 2004; 351:998-1012.
- Bafaloukos D, Gogas H, Georgoulias V, et al. Temozolomide in combination with docetaxel in patients with advanced melanoma: a phase II study of the Hellenic Cooperative Oncology Group. J Clin Oncol. 2002; 20:420-5.
- Jacquillat C, Khayat D, Banzet P, et al. Final report of the French multicenter phase II study of the nitrosourea fotemustine in 153 evaluable patients with disseminated malignant melanoma including patients with cerebral metastases. Cancer. 1990; 66:1873-8.
- Khayat D, Avril MF, Gerard B, et al. Fotemustine: an overview of its clinical activity in disseminated malignant melanoma. Melanoma Res. 1992; 2:147-51.
- Comella P, Daponte A, Casaretti R, et al. Fotemustine and dacarbazine plus recombinant interferon alpha 2a in thetreatment of advanced melanoma. Eur J Cancer. 1997; 33:1326-9.
- Daponte A, Ascierto PA, Gravina A, et al. Cisplatin, dacarbazine, and fotemustine plus interferon alpha in patients with advanced malignant melanoma. A multicenter phase II study of the Italian Cooperative Oncology Group. Cancer. 2000; 89:2630-6.
- Avril MF, Aamdal S, Grob JJ, et al. Fotemustine compared with dacarbazine in patients with disseminated malignant melanoma: a phase III study. J Clin Oncol. 2004; 22:1118-25.
- Bruzzi P. Objective response to treatment as a potential surrogate marker of survival in breast cancer. Ann NY Acad Sci. 2002; 963:144-7.
- Gander M, Leyvraz S, Decosterd L, et al. Sequential administration of temozolomide and fotemustine: depletion of O6-alkyl guanine-DNA transferase in blood lymphocytes and in tumours. Ann Oncol. 1999; 10:831-8.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento





