O TRATAMENTO COM BENZNIDAZOL PROMOVE MUDANÇAS NO COMPARTIMENTO LINFÓIDE DE CAMUNDONGOS INFECTADOS PELO TRYPANOSOMA CRUZI
(especial para SIIC © Derechos reservados)
Coautores
Vinícius Cotta de Almeida* Tania Araújo Jorge**
Doutor em Ciências. Instituto Oswaldo Cruz/FIOCRUZ*
Doutora em Ciências. Instituto Oswaldo Cruz/FIOCRUZ**
Recepción del artículo: 17 de mayo, 2005
Aprobación: 7 de junio, 2005
 Conclusión breve
O tratamento com benznidazol interrompeu não apenas a replicação parasitária, mas também originou novos mecanismos regulatórios ocasionando mudanças na resposta imune.
Conclusión breve
O tratamento com benznidazol interrompeu não apenas a replicação parasitária, mas também originou novos mecanismos regulatórios ocasionando mudanças na resposta imune.
 Resumen
A doença de Chagas é considerada uma doença endêmica em muitos países da América Latina. O benznidazol (N-benzil-2-nitroimidazol acetamida) é utilizado para a terapia desta doença, e o conceito de que o sucesso da terapia envolva a participação do sistema imune foi proposto. Neste texto, será feita a revisão dos principais resultados obtidos por nosso grupo no que diz respeito ao impacto da terapia com benznidazol sobre as principais populações linfocitárias presentes em órgãos linfóides durante a infecção experimental por T. cruzi. O tratamento com benznidazol atenuou as principais alterações observadas no timo, havendo redução da atrofia tímica e da eliminação de timócitos, concomitante ao restabelecimento do fenótipo normal com maioria de células imaturas CD4+CD8+, além da prevenção de depósitos de moléculas de matriz extracelular. Estes dados sugerem a preservação do compartimento linfóide central. De forma surpreendente, detectamos aumento na massa e celularidade do baço de camundongos infectados e tratados por benznidazol, relacionado à expansão preferencial de linfócitos T CD8+ com fenótipo efetor/memória. Além disso, houve modificação na relação CD4:CD8 e redução na frequência de apoptose. Em resumo, o tratamento com benznidazol interrompeu não apenas a replicação parasitária, mas também originou novos mecanismos regulatórios ocasionando mudanças na resposta imune.
Resumen
A doença de Chagas é considerada uma doença endêmica em muitos países da América Latina. O benznidazol (N-benzil-2-nitroimidazol acetamida) é utilizado para a terapia desta doença, e o conceito de que o sucesso da terapia envolva a participação do sistema imune foi proposto. Neste texto, será feita a revisão dos principais resultados obtidos por nosso grupo no que diz respeito ao impacto da terapia com benznidazol sobre as principais populações linfocitárias presentes em órgãos linfóides durante a infecção experimental por T. cruzi. O tratamento com benznidazol atenuou as principais alterações observadas no timo, havendo redução da atrofia tímica e da eliminação de timócitos, concomitante ao restabelecimento do fenótipo normal com maioria de células imaturas CD4+CD8+, além da prevenção de depósitos de moléculas de matriz extracelular. Estes dados sugerem a preservação do compartimento linfóide central. De forma surpreendente, detectamos aumento na massa e celularidade do baço de camundongos infectados e tratados por benznidazol, relacionado à expansão preferencial de linfócitos T CD8+ com fenótipo efetor/memória. Além disso, houve modificação na relação CD4:CD8 e redução na frequência de apoptose. Em resumo, o tratamento com benznidazol interrompeu não apenas a replicação parasitária, mas também originou novos mecanismos regulatórios ocasionando mudanças na resposta imune.
 Palabras clave
Benznidazol, Trypanosoma cruzi, camundongos, órgãos linfóides, linfócitos
Clasificación en siicsalud
Palabras clave
Benznidazol, Trypanosoma cruzi, camundongos, órgãos linfóides, linfócitos
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/74187
Especialidades
 Principal: Infectología,
Principal: Infectología,
 Relacionadas: Bioquímica, Farmacología, Salud Pública,
Relacionadas: Bioquímica, Farmacología, Salud Pública,
 Enviar correspondencia a:
Enviar correspondencia a:
Dra. Tania Araújo Jorge. Lab. Biologia Celular, DUBC/IOC, Fundação Oswaldo Cruz. Av. Brasil 4365, Rio de Janeiro, Brasil - CEP 21045-900 Araújo-Jorge T
BENZNIDAZOLE THERAPY PROMOTES CHANGES ON THE LYMPHOID COMPARTMENT OF TRYPANOSOMA CRUZI INFECTED MICE
 Abstract
Abstract
Chagas’ disease is endemic in most Latin American countries. The nitroderivative benznidazole (N-benzyl-2-nitroimidazole acetamide) is the most employed trypanocidal drug for Chagas’ disease and the concept that the success of anti-parasite treatment involves the immune system has been proposed. Here we review our work evaluating the impact of benznidazole therapy upon the main lymphocyte populations present in lymphoid organs in the course of experimental T. cruzi infection. Benznidazole treatment was able to lessen the severe abnormalities seen in the thymus following T. cruzi infection: it reduced thymus involution and thymocyte loss, restored the normal immature CD4+CD8+ phenotype, and prevented extracellular matrix deposits, substantiating the concept that the central lymphoid compartment is preserved. Surprisingly, in benznidazole-treated mice we detected higher spleen mass and viable cell numbers than in non-treated mice (higher splenomegaly), related to the preferential expansion of CD8+ T lymphocytes with high frequency of effector/memory cells, and a decrease in the apoptosis rate. As a consequence, a change in the CD4:CD8 ratio occurred as well. As a result, benznidazole treatment not only interrupted parasite replication but also induced new regulatory mechanisms, originating thus a different host immune response.
 Key words
Key words
Benznidazole, Trypanosoma cruzi, mice, lymphoid organs, lymphocytes
O TRATAMENTO COM BENZNIDAZOL PROMOVE MUDANÇAS NO COMPARTIMENTO LINFÓIDE DE CAMUNDONGOS INFECTADOS PELO TRYPANOSOMA CRUZI
(especial para SIIC © Derechos reservados)
Artículo completo
Introdução
A doença de Chagas resulta da infecção pelo protozoário intracelular
Trypanosoma cruzi,1 o qual persiste por toda a vida no
hospedeiro humano/mamífero. Esta doença é endêmica em muitos países do
continente americano, com mais de 300.000 novos casos registrados a cada ano e
cerca de 16 a 18 milhões de indivíduos infectados.2 Progressos
admiráveis foram feitos para a redução de sua incidência, especialmente no que diz
respeito ao controle vetorial e à interrupção da transmissão por transfusão
sanguínea.3 No entanto, o grau de invalidez e a mortalidade como
consequência da infecção pelo T. cruzi ainda são grandes, pois uma
proporção substancial de indivíduos infectados desenvolve sintomatologia crônica
representada principalmente pela miocardiopatia chagásica crônica, ou também,
em menor frequência, por desordens digestivas.4 Portanto, os
conceitos de infecção e de doença são diferentes, e é possível a manutenção da
infecção sem doença, mas não de doença sem infecção. Tanto a intensidade do
parasitismo como os níveis de inflamação e a intensidade e perfil de resposta imune
concorrem para controle ou não da carga parasitária e para gênese ou não de
doença. Foi proposto que a persistência do parasita em certos locais contribua para
o desenvolvimento da doença, mas também não é descartado o envolvimento de
fenômenos auto-imunes na patogenia.5-7
O tratamento da doença de Chagas é feito com os nitroderivados N-benzil-2-
nitroimidazol acetamida (benznidazol) ou 4-([5-nitrofurfurilideno]-amino)-3-
methilthio morpholina-1,1-dióxido (nifurtimox). Ambos compostos são capazes de
eliminar os sintomas da fase aguda e abreviar o curso da infecção, além de curar
aproximadamente 50% das infecções recentes,8-10 enquanto que
na fase crônica o tratamento é menos eficaz.11,12 Até o presente
momento, o benznidazol continua sendo o composto mais empregado no
tratamento da doença de Chagas.
Os mecanismos imunológicos relevantes tanto para a resistência como para a
patogênese da doença de Chagas são inúmeros e não estão completamente
esclarecidos, envolvendo muitos tipos celulares e mediadores da imunidade inata e
adaptativa. De fato, a infecção pelo T. cruzi ocasiona diversas alterações
na homeostasia do sistema imune do hospedeiro, e a infecção experimental murina
pelo T. cruzi tem sido a maior fonte de conhecimento sobre a sua
imunobiologia. As alterações clássicas da infecção experimental incluem a ativação
policlonal de linfócitos B e T em órgãos linfóides secundários, a
hipergamaglobulinemia, e a imunossupressão a antígenos homólogos e
heterólogos.13-16 A atrofia do timo também foi caracterizada em
estudos experimentais, sendo expressa pela perda de massa e redução na
celularidade relacionadas ao decréscimo no número de timócitos imaturos
CD4+CD8+ e ao aumento de células
CD4+ ou CD8+.17,18 Apesar destas
alterações, a resposta imune se desenvolve visando o controle sobre os parasitas
circulantes, e a participação dos linfócitos T é essencial neste processo e também
na resposta inflamatória.13,19-22 Experimentalmente, a
depleção específica de linfócitos T CD4+ e/ou
CD8+,22 bem como sua deleção
genômica23 acarretam níveis mais altos de parasitemia e
parasitismo tissular.
Recentemente, a idéia de que o sucesso da terapia anti-parasitária envolva a
participação do sistema imune foi proposta. Alguns estudos revelaram o
envolvimento de IFN-γ e IL-12 no incremento da ação do benznidazol
durante a infecção aguda pelo T. Cruzi.24-26 Outros
estudos levantaram a hipótese de que além de sua ação tripanocida, o benznidazol
pode ocasionar modificações em certos elementos da resposta imune de forma a
definir mudanças no curso da infecção.27 Neste contexto, decidimos
avaliar o impacto da terapia com benznidazol sobre as principais populações
linfocitárias presentes em órgãos linfóides no curso da infecção experimental pelo
T. cruzi.
O timo de camundongos infectados pelo T. cruzi após o tratamento
por benznidazol
A relevância do timo para a resistência do hospedeiro na infecção pelo T.
cruzi já foi bem caracterizada, bem como a descrição de alterações no órgão
após a infecção.17,18,28-32 A infecção se torna mais grave, com
altos níveis de parasitas circulantes e aumento na mortalidade após a remoção do
timo33 ou em camundongos atímicos,34,35 e lesões
miocárdicas mais acentuadas relacionam-se à timectomia em animais
adultos.36 Dados mais recentes revelaram que animais susceptíveis
à infecção por T. cruzi apresentam maior frequência de morte de
timócitos, quando comparados a animais resistentes; estes últimos sobrevivem a
infecção aguda e o timo recupera o seu tamanho normal.37 Nosso
trabalho evidenciou a prevenção da atrofia do timo em animais infectados após a
terapia por benznidazol.38 Em nosso modelo experimental, o
tratamento com benznidazol iniciou-se no 7º dia após a infecção pelo T.
cruzi (cepa Y) em camundongos Swiss e as análises do timo foram realizadas
imediatamente após o pico de parasitemia no 9º dia da infecção, ou no 14º dia
quando o número de parasitas circulantes já havia decrescido. A clara prevenção da
perda de timócitos nos animais tratados associou-se a um perfil de sub-populações
similar àquele encontrado em animais não-infectados, onde a maioria dos timócitos
apresenta um fenótipo imaturo (CD4+CD8+) (figura
1). Estes dados validam a idéia de que o órgão linfóide central nos animais
infectados e tratados por benznidazol foi preservado, o que pode estar associado à
reduzida mortalidade e melhoria das condições clínicas nestes animais.

Figura 1. Redução da involução do timo após o tratamento com benznidazol em animais
infectados pelo Trypanosoma cruzi. Dados dos grupos não-infectado (N), infectado sem
tratamento (I) e infectado tratado com benznidazol a partir do 7º dia da infecção (IBz) no 14º dia após a
infecção, em um total de 3 experimentos. (a) Resultados de citofluorimetria após marcação celular com
anti-CD4 e anti-CD8 para a definição de timócitos simples-positivos CD4+ e CD8+, duplo-positivos
CD4+CD8+ (DP) e duplo-negativos CD4-CD8- (DN), com o respectivo número absoluto de timócitos
(abaixo). (b) Histogramas da expressão de CD3 de um animal representativo de cada grupo experimental
com barras horizontais indicando expressão de CD3low (M1) e CD3high (M2), após a definição de
marcação positiva através de controle isotípico de imunoglobulina. Os números entre parênteses indicam
a frequência relativa de cada sub-população. • = diferente de N, •• = diferente de I
(p<0.05).
Recentes estudos de nosso grupo sobre a atrofia do timo durante a infecção pelo
T. cruzi evidenciaram o papel dos receptores purinérgicos em células T
CD4+CD8+39 e ao mesmo tempo excluíram
mecanismos dependentes de ligante de Fas e perforina40 no
processo de morte dos timócitos. De fato, o T. cruzi evade a resposta
imune do hospedeiro através da indução de apoptose em timócitos. O aumento na
frequência de apoptose em animais infectados foi identificado como causa para a
depleção celular, e o envolvimento da trans-sialidase do parasita foi
sugerido.41,42 Nosso trabalho indicou que a involução do timo
relacionou-se à depleção específica de timócitos imaturos
CD4+CD8+ por apoptose, e que o mecanismo
responsável pela prevenção da involução do timo após o tratamento com
benznidazol foi a diminuição na frequência de apoptose nestas células (figura 2).
Ainda, formas amastigota de T. cruzi foram previamente identificadas no
timo de animais infectados,18 e o número de timócitos é recuperado
após o controle da parasitemia em estágios mais avançados da
infecção.28,31 De acordo com este conjunto de dados, a depleção
de timócitos relaciona-se à apoptose, enquanto que a redução da carga parasitária
é importante para a recuperação da depleção dos timócitos. Nesse sentido, o
tratamento com o benznidazol promoveu diretamente a redução da carga
parasitária ao mesmo tempo em que bloqueou a depleção dos timócitos pela
redução da frequência de apoptose.

Figura 2. O tratamento com benznidazol preveniu a ocorrência de elevada frequência de
apoptose em timócitos após a infecção pelo Trypanosoma cruzi. Representação da frequência
média de timócitos em apoptose por detecção citofluorimétrica após marcação com 7-AAD em timócitos
totais e CD4+CD8+ dos grupos não-infectado (N), infectado sem tratamento (I) e infectado tratado com
benznidazol a partir do 7º dia da infecção (IBz), em um total de 3 experimentos com 6-9 camundongos
por grupo experimental.
A migração celular é essencial para a diferenciação intratímica de linfócitos T, e a
participação de quimiocinas e moléculas de matriz extracelular neste processo já foi
evidenciada.43 Já foram descritos distúrbios na migração e
diferenciação dos timócitos na infecção pelo T. cruzi, ao mesmo tempo em
que detectou-se alterações no microambiente do timo, com a densificação de sua
rede epitelial e o aumento de moléculas de matriz
extracelular.18,29,30 A depleção dos timócitos ocorre
simultaneamente ao aumento da expressão de moléculas de matriz extracelular, e
alterações na capacidade migratória de células T imaturas correlacionam-se a uma
exportação prematura destas células em animais
infectados.18,29,30 Nosso trabalho demonstrou a nítida prevenção
dos depósitos de matriz extracelular no timo após o tratamento por benznidazol
(figura 3). Como consequência deste fato, é possível que tenha ocorrido in
vivo a regulação na dinâmica de migração dos timócitos nos animais
infectados e tratados por benznidazol.

Figura 3. Prevenção da deposição de fibronectina no timo após a infecção por Trypanosoma
cruzi em camundongos submetidos ao tratamento com benznidazol. Imagens de microscopia
confocal da detecção de fibronectina de animais representativos dos grupos não-infectado (a), infectado
sem tratamento (b) e infectado tratado com benznidazol a partir do 7º dia da infecção (c) no 14º dia após
a infecção. O cortex (Co) e medula (Me) do timo estão indicados.
Em resumo, a terapia com o benznidazol foi capaz de minimizar as graves
alterações no timo decorrentes da infecção pelo T. cruzi. Desta forma,
nossos resultados sugerem que a preservação da homeostase do timo esteja
contribuindo para o surgimento de novos mecanismos regulatórios após a terapia
tripanocida, e que possivelmente estejam envolvidos no aumento da resistência
observado nos animais infectados e tratados.
O baço após o tratamento por benznidazol em camundongos infectados pelo
T. cruzi
A esplenomegalia é uma característica da infecção aguda pelo T. cruzi,
tanto em humanos como em camundongos. Resultados experimentais
evidenciaram a expansão na celularidade total do baço, e especialmente da sub-
população linfocitária T nesta fase.44-46 Além disso, a morte celular
induzida por ativação (AICD) de linfócitos T CD4+ do baço parece
ser um mecanismo imunorregulatório importante no curso da
infecção.47,48 Nesse sentido, a quantificação do número de células,
bem como a composição linfocitária e o grau de ativação celular neste órgão
linfóide poderiam representar importantes sinais do efeito do benznidazol em
animais infectados. A administração de benznidazol aos animais foi iniciada aos 7
dias da infecção e as análises foram realizadas nos dias 9 e 14 após a infecção pela
cepa Y de T. cruzi em camundongos Swiss. Nossos resultados indicaram
nítida esplenomegalia nos animais tratados, especialmente no 14º dia após a
infecção.49 De fato, detectamos em animais tratados um aumento
na massa do órgão e no número de células viáveis, do que em animais não-
tratados (figura 4). As análises fenotípicas das populações linfocitárias majoritárias
do baço indicaram que a manutenção da esplenomegalia em animais infectados e
tratados pelo benznidazol deveu-se à expansão preferencial de linfócitos T
CD8+, tendo como conseqüência uma mudança na relação CD4:CD8
(figura 4). A análise da expressão de marcadores de ativação celular em linfócitos T
CD8+ mostrou elevação na frequência de células com fenótipo
efetor/memória, determinada pelo aumento na expressão de CD44
concomitantemente a uma redução na expressão de CD62L (figura 5). Além disso,
observamos diminuição na frequência de apoptose nos esplenócitos após o
tratamento pelo benznidazol, quando comparado a animais infectados sem
tratamento.49 Em resumo, a terapia com o benznidazol impediu a
replicação parasitária, e ao mesmo tempo originou uma resposta imune diferente
em órgãos linfóides periféricos.
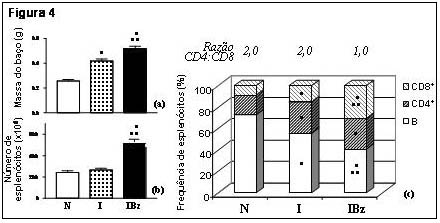
Figura 4. Aumento da massa absoluta e celularidade do baço acompanhado da expansão de
linfócitos T CD8+ em animais tratados com benznidazol após a infecção pelo Trypanosoma cruzi.
Valores médios da massa do baço (a), do número de esplenócitos (b) e da frequência de linfócitos
CD4+, CD8+ e B no baço, com a razão CD4:CD8 (acima) (c), dos grupos não-infectado (N), infectado
sem tratamento (I) e infectado tratado com benznidazol a partir do 7º dia da infecção (IBz). Resultados
de 3 experimentos com 3-4 animais por grupo experimental, no 14º dia da infecção. As barras horizontais
em (a) e (b) representam valores de desvio-padrão. • = diferente de N, •• = diferente
de I (p<0.05).

Figura 5. Diminuição na expressão de CD62L paralelo ao aumento na expressão de CD44 em
linfócitos T CD8+ do baço de animais infectados por Trypanosoma cruzi e tratados com
benznidazol. Valores médios da frequência de linfócitos CD8+CD44+ e CD8+CD62L- por análise
citofluorimétrica em animais não-infectados (N), infectados sem tratamento (I) e infectados tratados com
benznidazol após o 7º dia da infecção (IBz). Resultados de 3 experimentos com 3-4 animais por grupo
experimental, no 14º dia da infecção.
A resposta imune após a terapia com benznidazol em desafio:
reinfecção
Nosso trabalho demonstrou uma clara mudança na distribuição das principais
populações linfocitárias em órgãos linfóides primários e secundários nos
camundongos tratados pelo benznidazol. A resposta imune primária desenvolvida
após a infecção pelo T. cruzi em animais tratados pelo benznidazol durante
a fase aguda foi capaz de proteger os animais da morte em um segundo episódio
de infecção.49 A reinfecção dos animais tratados foi realizada no 50º
dia após a infecção primária, ocasionando redução na mortalidade em comparação
com a infecção primária de animais de mesma idade (figura 6).

Figura 6. A mortalidade é reduzida em animais infectados por Trypanosoma cruzi
tratados com benznidazol a partir do 7º dia e submetidos à infecção secundária pelo T. cruzi no 50º
dia após a primeira infecção. Mortalidade de 40 animais infectados e tratados com benznidazol
submetidos à reinfecção (IBz; círculos) em comparação com 21 animais-controle infectados e de mesma
idade (I; quadrados), em 2 experimentos independentes acompanhados durante 40 dias.
Considerações finais
Em virtude da eficácia parcial das drogas tripanocidas atualmente em uso
clínico, bem como dos efeitos colaterais que apresentam, o desenvolvimento de
medicamentos mais eficazes, e que possam ser utilizados na fase crônica
sintomática da doença continua sendo essencial. Novas abordagens envolvendo a
inibição da biossíntese de esteróis, inibidores de cisteino-proteases (ex: cruzipaína)
e inibidores de pirofosfatos foram testadas com demonstração in vitro e
in vivo de ação anti-T. Cruzi.50,51 Alguns estudos
clínicos foram realizados com alopurinol, cetoconazol e itraconazol como
alternativas para o tratamento da doença de Chagas, levando a resultados
imprecisos na capacidade de eliminação da infecção.52-56 De forma
especial, merecem destaque os compostos inibidores da biossíntese de esteróis
como os derivados triazólicos SCH 56592 (posaconazol, (-)-4-[4-[4-[4-[[(2R-
cis)-5-(2,4-difluorophenyl)-tetrahydro-5-(1H-1,2,4-triazol-1-ylmethyl)-3-
furanyl]methoxy]phenyl]-1-piperazinyl]phenyl]-2,4-dihydro-2-[(S)-1-ethyl-2(S)-
hydroxypropyl]-3H-1,2,4-triazol-3-one, Schering-Plough Research Institute,
Kenilworth, NJ) e TAK-187 (2-[(1R,2R)-2-(2,4-difluorophenyl)-2-
hydroxy-1-methyl-3-(1H-1,2,4-triazol-1-yl)propyl]-4-[4-(2,2,3,3-
tetrafluoropropxy)phenyl]- 3 (2H,4H)-1,2,4-triazolone, Takeda Chemical Company,
Osaka, Japan). Ambos compostos foram capazes de controlar a parasitemia na
infecção experimental crônica pelo T. cruzi, além de atuarem sobre cepas
do parasita resistentes ao benznidazol e nifurtimox.57-60 De
qualquer modo, o benznidazol continua sendo composto mais empregado na clínica
para o tratamento da doença de Chagas.
Resultados experimentais embasam a idéia de que o sucesso da terapia anti-
parasitária envolva a participação do sistema imune. Nesse sentido, a definição de
parâmetros reprodutíveis com relação ao perfil de resposta imune dos hospedeiros
tratados com benznidazol tornará mais fácil a comparação com o efeito de novos
compostos sintetizados. Posto que a utilização de um tratamento capaz de inibir a
expansão parasitária no início da infecção, mas onde mesmo assim verificam-se
alterações na homeostasia do sistema imune, propõe que o tratamento não deve
ser considerado somente como um meio de controlar a carga parasitária. Desta
forma, se torna necessário um estudo de longo prazo sobre a repercussão destas
alterações em fases avançadas da infecção. Os efeitos da terapia tripanocida na
resposta imune podem ser por vezes inesperados, gerando possivelmente novos
circuitos regulatórios.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Chagas C. Nova tripanosomíase humana. Estudos sobre a morfologia e o ciclo evolutivo de Schizotrypanum cruzi n.gen., n.sp., agente etiológico de nova entidade mórbida do homem. Mem Inst Oswaldo Cruz 1909; 1:159-218.
- World Health Organization. Chagas disease. Tropical Disease Research, 18th Program Report, UNDP/WB/TDR, Geneva, 2002.
- Dias JC. PAHO/WHO. Task force on the initiative of the South Cone for the elimination of vector transmission and interruption of transfusion transmission of Trypanosoma cruzi. Epidemiologic surveillance of Triatoma infestans. Rev Soc Bras Med Trop 1993; 26 Suppl 3:39-44.
- Dias JCP, Coura JR. Epidemiologia. In: Dias JCP, and Coura JR (ed.), Clínica e terapêutica da doença de Chagas, uma abordagem prática para o clínico geral, FIOCRUZ, Rio de Janeiro. 1997. p.33-65.
- Kierszenbaum F. Views on the autoimmunity hypothesis for Chagas disease pathogenesis. FEMS Immunol 2003; 37:1-11.
- Soares MBP, Pontes-de-Carvalho L, Ribeiro-dos-Santos R. The pathogenesis of Chagas’ disease: when autoimmune and parasite-specific immune response meet. An Acad Bras Cienc 2001; 73(4):547-59.
- Tarleton RL. Parasite persistence in the aetiology of Chagas disease. Int J Parasitol 2001; 31:550-4.
- Cançado JR, Brener Z. Terapêutica. In: Brener Z, Andrade Z (ed.) Trypanosoma cruzi e Doença de Chagas, Guanabara Koogan. 1979. p.362-424.
- Cerisola JA, Alvarez M, Rissio AM. Imunodiagnóstico da doença de Chagas. Evolução serológica de pacientes com doença de Chagas. Rev Inst Med Trop São Paulo 1970; 12:403-11.
- Schmuñis GA, Szarfman A, Coarasa L,. Guilleron C, Peralta JM. Anti-Trypanosoma cruzi agglutinins in acute human Chagas’ disease. Am Soc Trop Med Hyg 1980; 29:170-8.
- Galvão L, Nunes R, Cançado JR, Brener Z, Krettli A. Lytic antibodies titer as a means of assessing cure after treatment of Chagas’ disease: a 10 year follow-up study. Trans R Soc Trop Med Hyg 1993; 87:220-3.
- Viotti R, Vigliano C, Armenti H, Segura E. Treatment of chronic Chagas disease with benznidazole: clinical and serological evolution of patients with long-term follow-up. Am Heart J 1994; 127:151-62.
- Minoprio P, Coutinho A, Joskowicz M, D’Imperio-Lima MR, Eisen H. Polyclonal lymphocyte responses to murine Trypanosoma cruzi infection. II. Cytotoxic T lymphocytes. Scand J Immunol 1986; 24:669-79.
- Minoprio P, Eisen H, Forni L, D’Imperio-Lima MR, Joskowicz M, Coutinho A. Polyclonal lymphocyte responses to murine Trypanosoma cruzi infection. I. Quantitation of both T- and B-cell responses. Scand J Immunol 1986; 24:661-68.
- Minoprio P, Burlen O, Pereira P et al. Most B cells in acute Trypanosoma cruzi infection lacks parasite specificity. Scand J Immunol 1988; 28:553–61.
- Minoprio P, Itohara S, Heusser C,. Tonegawa S, Coutinho A. Immunobiology of murine Trypanosoma cruzi infection: the predominance of parasite-nonspecific responses and the activation of TCRI T cells. Immunol Ver 1989; 112:183-207.
- Leite-de-Moraes MC, Hontebeyrie-Joskowicz M, Leboulenger F, Savino W, Dardenne M, Lepault F. Studies on the thymus in Chagas’ disease. II. Thymocyte subset fluctuations in Trypanosoma cruzi-infected mice: relationship to stress. Scand J Immunol 1991; 33:267-75.
- Savino W, Leite-de-Moraes MC, Hontebeyrie-Joskowicz M, Leboulenger F, Dardenne M. Studies on the thymus in Chagas’disease. I. Changes in the thymic microenvironment in mice acutely infected with Trypanosoma cruzi. Eur J Immunol 1989; 19:1727-33.
- Kierszenbaum F. What are T-cell subpopulations really doing in Chagas’ disease Parasitol Today 1995;11:6-7.
- Tarleton RL. The role of T cells in Trypanosoma cruzi infection. Parasitol Today 1995; 1:7-9.
- Tarleton RL, Koller BH, Latour A, Postan M. Susceptibility of beta 2-microglobulin-deficient mice to Trypanosoma cruzi infection. Nature 1992; 356:338-40.
- Tarleton RL, Sun J, Zhang L, Postan M. Depletion of T-cell subpopulations results in exacerbation of myocarditis and parasitism in experimental Chagas’ disease. Infect Immun 1994; 62(5):1820-9.
- Rottenberg ME, Bakhiet M, Olsson T et al. Differential susceptibilities of mice genomically deleted of CD4 and CD8 to infections with Trypanosoma cruzi or Trypanosoma brucei. Infect Immun 1993; 61:5129-33.
- Michailowsky V, Murta SMF, Carvalho-Oliveira L et al. Interleukin-12 enhances in vivo parasiticidal effect of benznidazole during acute experimental infection with a naturally drug-resistant strain of Trypanosoma cruzi. Antimicrob Agents Chemother 1998; 42:2549-56.
- Murta SM, Ropert C, Alves RO, Gazzinelli RT, Romanha AJ. In-vivo treatment with benznidazole enhances phagocytosis, parasite destruction and cytokine release by macrophages during infection with a drug-susceptible but not with a derived drug-resistant Trypansoma cruzi population. Parasite Immunol 1999; 21(10):535-44.
- Romanha AJ, Alves RO, Murta SM, Silva JS, Ropert C, Gazzinelli RT. Experimental chemotherapy against Trypanosoma cruzi infection: essential role of endogenous interferon-gamma in mediating parasitologic cure. J Infect Dis 2002; 186(6): 823-8.
- Piaggio E, Roggero E, Pitashny M,. Wietzerbin J, Bottasso OA, Revelli SS. Treatment with benznidazole and its immunomodulating effects on Trypanosoma cruzi-infected rats. Parasitol Res 2001; 87(7):539-47.
- Antunez MI, Feinstein RE, Cardoni RL, Gronvik KO. Trypanosoma cruzi: T cell subpopulations in the Peyer's patches of BALB/c infected mice. Exp Parasitol 1996; 87:58-64.
- Cotta-de-Almeida V, Bonomo A, Mendes-da-Cruz DA et al. Trypanosoma cruzi infection modulates intrathymic contents of extracellular matrix ligants and receptors and alters thymocyte migration. Eur J Immunol 2003; 33(9):2439-48.
- Cotta-de-Almeida V, Bertho AL, Villa-Verde DMS, Savino W. Phenotypic and functional alterations of thymic nurse cells following acute Trypanosoma cruzi infection. Clin Immunol Immunopathol 1997; 82:125-32.
- Leite-de-Moraes MC, Hontebeyrie-Joskowicz M, Dardenne M, Savino W. Modulation of thymocyte subsets during acute and chronic phases of experimental Trypanosoma cruzi infection. Immunol 1992; 77(1):95-8.
- Mendes-da-Cruz DA, DeMeis J, Cotta-de-Almeida V, Savino W. Experimental Trypanosoma cruzi infection alters the shaping of the central and peripheral T-cell repertoire. Microbes Infect 2003; 5(10):825-32.
- Schmunis GA, Cappa SMG, Traversa OC, Jaanovsky JF. The effects of immuno-depression due to neonatal thymectomy on infections with Trypanosoma cruzi in mice. Trans R Soc Trop Med Hyg 1971; 65:89-94.
- Gonçalves-da-Costa SC, Lagrange PH, Hurtrel B, Keer I, Alencar A. Role of T lymphocytes in the resistance and immunopathology of experimental Chagas’disease. 1. Histopathological studies. Ann Inst Pasteur (Immunol.) 1984; 135:317-32.
- Kierszenbaum F, Pienkowski MM. Thymus-dependent control of host defense mechanisms against Trypanosoma cruzi infection. Infect Immun 1979; 24:117-20.
- Bottasso OA, Revelli SS, Davila H et al. Enhanced myocardial lesions in chronically Trypanosoma cruzi-infected rats subjected to adult thymectomy. Immunol Lett 1993; 37:175-80.
- Roggero E, Perez A, Tamae-Kakazu M et al. Differential susceptibility to acute Trypanosoma cruzi infection in BALB/c and C57BL/6 mice is not associated with distinct parasite load but cytokine abnormalities. Clin Exp Immunol 2002; 128:421-8.
- Olivieri BP, Farias-De-Oliveira DA, Araujo-Jorge T, Cotta-De-Almeida V. Benznidazole Therapy in Trypanosoma cruzi-Infected Mice Blocks Thymic Involution and Apoptosis of CD4+CD8+ Double-Positive Thymocytes Antimicrob Agents Chemother. 2005; 49(5):1981-1987.
- Mantuano-Barradas M, Henriques-Pons A, Araújo-Jorge TC, Di Virgilio F, Coutinho-Silva R, Persechini PM. Extracellular ATP induces cell death in CD4+/CD8+ double-positive thymocytes in mice infected with Trypanosoma cruzi. Microbes Infect 2003; 5(15):1363-71.
- Henriques-Pons A, DeMeis J, Cotta-De-Almeida V, Savino W, Araujo-Jorge TC. Fas and perforin are not required for thymus atrophy induced by Trypanosoma cruzi infection. Exp Parasitol 2004; 107(1-2):1-4.
- Mucci J, Hidalgo A, Mocetti E, Argibay PF, Leguizamón MS, Campetella O. Thymocyte depletion in Trypanosoma cruzi infection is mediated by trans-sialidase-induced apoptosis on nurse cells complex. PNAS 2002; 99(6):3896-901.
- Risso MG, Garbarino GB, Mocetti E et al. Differential expression of a virulence factor, the trans-sialidase, by the main Trypanosoma cruzi phylogenetic lineages. J Infect Dis 2004; 189(12):2250-9.
- Savino W, Mendes-da-Cruz DA, Silva JS, Dardenne M, Cotta-de-Almeida V. Intrathymic T-cell migration: a combinatorial interplay of extracellular matrix and chemokines. Trends Immunol 2002; 23(6):305-13.
- Dos Reis GA. Cell-mediated immunity in experimental Trypanosoma cruzi-infection. Parasitol Today 1997; 13:335-42.
- Kierszenbaum F, de Diego JL, Fresno M, Sztein MB. Inhibitory effects of the Trypanosoma cruzi membrane glycoprotein AGC10 on the expression of IL-2 receptor chains and secretion of cytokines by subpopulations of activated human T lymphocytes. Eur J Immunol 1999; 29:1684–91.
- Reina-San-Martin B, Degrave W, Rougeot C et al. A B-cell mitogen from a pathogenic trypanosome is a novel eukaryotic proline racemase. Nature Med 2000; 6:890-7.
- Lopes MF, Da Veiga VF, Santos AR, Fonseca MEF, DosReis GA. Activation-induced CD4+ T cell death by apoptosis in experimental Chagas’ disease. J Immunol. 1995; 154:744-52.
- Lopes MF, DosReis GA. Trypanosoma cruzi-induced immunossupression: selective triggering of CD4+ T cell death by the T-cell receptor CD3 pathway and not by the CD69 or Ly-6 activation pathway. Infect Immun 1996; 64:1559-64.
- Olivieri BP, Cotta-De-Almeida V, Araujo-Jorge T. Benznidazole treatment following acute Trypanosoma cruzi infection triggers CD8+ T-cell expansion and promotes resistance to reinfection. Antimicrob Agents Chemother. 2002; 46(12):3790-96.
- Coura JR, de Castro SL. A critical review on Chagas disease chemotherapy. Mem Inst Oswaldo Cruz 2002; 97(1):3-24.
- Urbina JA, Docampo R. Specific chemotherapy of Chagas disease: controversies and advances. Trends Parasitol 2003; 19(11):495-501.
- Apt W, Arribada A, Zulantay I, Sanchez G, Vargas SL, Rodriguez J. Itraconazole or allopurinol in the treatment of chronic American trypanosomiasis: the regression and prevention of electrocardiographic abnormalities during 9 years of follow-up. Ann Trop Med Parasitol 2003;97(1):23-9.
- Avila JL, Polegre MA, Robins RK. Biological action of pyrazolopyrimidine derivatives against Trypanosoma cruzi studies in vitro e in vivo. Comp Biochem Physiol 1987; 86C:49-54.
- Brener Z, Cancado JR, Galvão LM et al. An experimental and clinical assay with ketoconazole in the treatment of Chagas disease. Mem Inst Oswaldo Cruz 1993; 88(1):149-53.
- Meirovich CI, Montrull HL, Gallerano RH, Sosa RR. Allopurinol in the treatment of chronic Chagas' disease. Arq Bras Cardiol 1985; 45(3):217-23.
- Moreira AAB, De Souza HBWT, Amato Neto V et al. Avaliação da atividade terapêutica do itraconazol nas infecções crônicas, experimental e humana, pelo Trypanosoma cruzi. Rev Inst Med Trop São Paulo 1992; 34:177-80.
- Molina J, Martins-Filho O, Brener Z, Romanha AJ, Loebenberg D, Urbina JA. Activities of the triazole derivative SCH 56592 (posaconazole) against drug-resistant strains of the protozoan parasite Trypanosoma (Schizotrypanum) cruzi in immunocompetent and immunosuppressed murine hosts. Antimicrob Agents Chemother 2000; 44(1):150-5.
- Urbina JA, Payares G, Sanoja C et al. Parasitological cure of acute and chronic experimental Chagas disease using the long-acting experimental triazole TAK-187. Activity against drug-resistant Trypanosoma cruzi strains. Int J Antimicrob Agents 2003; 21(1):39-48.
- Urbina JA, Payares G, Molina J et al. Cure of short- and long-term experimental Chagas' disease using D0870. Science 1996; 273(5277):969-71.
- Urbina JA, Payares G, Contreras LM et al. Antiproliferative effects and mechanism of action of SCH 56592 against Trypanosoma (Schizotrypanum) cruzi: in vitro and in vivo studies. Antimicrob Agents Chemother 1998; 42(7):1771-7.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:




