UN MODELO PARA EL ESTUDIO DE LA CARCINOGENESIS MAMARIA Y DIABETES CONJUNTAS. COMPROMISO DEL FACTOR DE CRECIMIENTO INSULINICO
(especial para SIIC © Derechos reservados)
Coautores
Claudia Cocca* Mariel Núñez, Nora Mohamad,** Alicia Gutiérrez*** Gabriela Martín* Graciela Cricco, Vanina Medina, Elena Rivera**** Máximo Croci*****
Doctor. Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires*
Bioquímicas, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires**
Licenciada en Ciencias Biológicas, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires***
Doctoras en Bioquímica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires****
Médico. Instituto de Inmunooncología, Buenos Aires*****
Recepción del artículo: 25 de febrero, 2005
Aprobación: 0 de , 0000
 Conclusión breve
Los bajos niveles circulantes de IGF-I total durante la fase de promoción de la carcinogénesis juegan un importante papel en el retraso del desarrollo tumoral mamario y favorecen las lesiones mamarias benignas.
Conclusión breve
Los bajos niveles circulantes de IGF-I total durante la fase de promoción de la carcinogénesis juegan un importante papel en el retraso del desarrollo tumoral mamario y favorecen las lesiones mamarias benignas.
 Resumen
El objetivo del presente trabajo fue desarrollar un modelo de tumor mamario en ratas hembra Sprague-Dawley diabéticas a fin de contar con un modelo in vivo que permitiera estudiar la carcinogénesis mamaria cuando un cuadro diabético está instalado. La diabetes insulinoindependiente fue provocada mediante administración subcutánea de estreptozotocina, mientras que los tumores mamarios se indujeron por inyección intraperitoneal de tres dosis del carcinógeno N-nitroso-N-metilurea. Los parámetros tumorales, comparados con los obtenidos en animales no diabéticos mostraron: mayor período de latencia (110.0 ± 6.5 vs. 80.3 ± 2.5 días), menor número de tumores por animal (2.3 ± 0.9 vs. 5.6 ± 1.2) y menor volumen tumoral final (2.1 ± 0.6 vs. 35 ± 8.6 cm3). Los tumores desarrollados en animales diabéticos mostraron un predominio de patrones benignos, en tanto que los desarrollados en ratas no diabéticas mostraron en todos los casos características malignas. Estos resultados se correlacionaron con un nivel plasmático mas bajo de IGF-I total (ng/ml) (562 ± 53 vs. 1 149 ± 108) durante la fase de promoción de la carcinogénesis mamaria (día 80 de vida). Postulamos que bajos niveles circulantes de IGF-I total durante la fase de promoción de la carcinogénesis juegan un importante papel en el retraso del desarrollo tumoral mamario y favorecen el desarrollo de lesiones mamarias benignas.
Resumen
El objetivo del presente trabajo fue desarrollar un modelo de tumor mamario en ratas hembra Sprague-Dawley diabéticas a fin de contar con un modelo in vivo que permitiera estudiar la carcinogénesis mamaria cuando un cuadro diabético está instalado. La diabetes insulinoindependiente fue provocada mediante administración subcutánea de estreptozotocina, mientras que los tumores mamarios se indujeron por inyección intraperitoneal de tres dosis del carcinógeno N-nitroso-N-metilurea. Los parámetros tumorales, comparados con los obtenidos en animales no diabéticos mostraron: mayor período de latencia (110.0 ± 6.5 vs. 80.3 ± 2.5 días), menor número de tumores por animal (2.3 ± 0.9 vs. 5.6 ± 1.2) y menor volumen tumoral final (2.1 ± 0.6 vs. 35 ± 8.6 cm3). Los tumores desarrollados en animales diabéticos mostraron un predominio de patrones benignos, en tanto que los desarrollados en ratas no diabéticas mostraron en todos los casos características malignas. Estos resultados se correlacionaron con un nivel plasmático mas bajo de IGF-I total (ng/ml) (562 ± 53 vs. 1 149 ± 108) durante la fase de promoción de la carcinogénesis mamaria (día 80 de vida). Postulamos que bajos niveles circulantes de IGF-I total durante la fase de promoción de la carcinogénesis juegan un importante papel en el retraso del desarrollo tumoral mamario y favorecen el desarrollo de lesiones mamarias benignas.
 Palabras clave
Tumores mamarios, diabetes, carcinogénesis, ratas, IGF-I, oncología experimental
Clasificación en siicsalud
Palabras clave
Tumores mamarios, diabetes, carcinogénesis, ratas, IGF-I, oncología experimental
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/72752
Especialidades
 Principal: Oncología,
Principal: Oncología,
 Relacionadas: Medicina Interna,
Relacionadas: Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Dra. Rosa María Bergoc. Facultad de Farmacia y Bioquímica, Laboratorio de Radioisótopos. Junín 956 (1113) Buenos Aires, Argentina.
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Agradecimientos: La realización de este trabajo fue posible gracias a los aportes de la Agencia Nacional de Promoción Científica y Tecnológica (BID-OC-AR-PICT-12250) y del Consejo Nacional de Ciencia y Tecnología (CONICET, PIP 02543/03). Parcialmente formó parte de un Acuerdo de Cooperación Académico con la Dra. Ana Pérez Castillo, del Instituto de Investigaciones Biomédicas, CSIC, Departamento de Regulación de la Expresión Génica, Consejo Superior de Investigaciones Científicas, Madrid, España. Proyecto: Estudios in vivo e in vitro del papel del IGF-I en cáncer de mama. Implicancia del factor de transcripción NF-kB, 2001-2004.
A MODEL FOR THE STUDY OF MAMMARY CARCINOGENESIS AND DIABETES. INVOLVEMENT OF INSULIN GROWING FACTOR (IGF)
 Abstract
Abstract
The objective of this paper was to develop a mammary tumor model in vivo in diabetic Sprague-Dawley rats and to compare its histological and biochemical characteristics with those of tumors from non-diabetics ones. Insulin-independent diabetes was induced by subcutaneous streptozotocin administration and mammary tumors were induced by three intraperitoneal N-nitroso-N-methylurea injections. Tumor parameters indicate that diabetic rats showed a longer latency period (days): 110.0 ± 6.5 vs. 80.3 ± 2.5; a lower number of tumors per animal: 2.3 ± 0.9 vs. 5.6 ± 1.2; and a smaller final tumor volume (cc): 2.1 ± 0.6 vs. 35 ± 8.6. Also, tumors developed in diabetic animals showed predominantly a benign pattern whilst all those developed in normal rats showed malignant characteristics. These results correlated with a significantly lower plasma level of total-IGF-I (ng/ml) (562 ± 53 vs. 1 149 ± 108) at the promotion phase of carcinogenesis in this animal model (day 80th of life). We postulate that lower circulating levels of total IGF-I during the promotion phase of carcinogenesis play an important role in delaying tumor development in diabetic animals and in favoring the development of benign mammary lesions. We assume that this model is useful to study mammary carcinogenesis when diabetes is established.
 Key words
Key words
Mammary tumors, diabetes, multistep carcinogenesis, rats, IGF-I, experimental oncology
UN MODELO PARA EL ESTUDIO DE LA CARCINOGENESIS MAMARIA Y DIABETES CONJUNTAS. COMPROMISO DEL FACTOR DE CRECIMIENTO INSULINICO
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Datos epidemiológicos recientes indican que el cáncer mamario humano representa el 10% de los nuevos casos de cáncer en todo el mundo y que, a pesar de los esfuerzos realizados y las nuevas terapias en uso, la proporción de muertes por esta enfermedad no ha variado significativamente desde 1930.1 La mejor comprensión de los procesos biológicos involucrados en la transformación neoplásica implica abrir nuevos caminos en favor de la identificación de terapias más específicas y con menores efectos adversos. El cáncer de mama es el resultado de una compleja desregulación del crecimiento celular en el que intervienen numerosos factores. Se sabe que la proliferación de las células del tejido mamario, tanto normal como neoplásico, está regulada por hormonas polipeptídicas y factores de crecimiento.2,3 En particular, el factor de crecimiento insulínico tipo I (IGF-I) juega un importante papel en la proliferación celular, la diferenciación, la supresión de la apoptosis y las interacciones célula-célula y célula-matriz extracelular, que favorecen los procesos de transformación.4-6 Estos complejos e intrincados mecanismos requieren aun investigaciones más profundas para su completa dilucidación.
El sistema IGF está constituido por una familia que comprende dos ligandos: el factor de crecimiento insulínico tipo I (IGF-I) y el factor de crecimiento insulínico tipo II (IGF-II), sus respectivos receptores (IGFR-I e IGF-RII) y proteínas ligadoras a las que se conoce como proteínas de unión de IGF (IGFBP). Dada la estrecha homología entre IGF-I, IGF-II e insulina, numerosos investigadores incluyen en esta familia a la insulina (Ins), a su receptor (InsR) y a un receptor híbrido entre IGF-IR e InsR.7 Este sistema, esquematizado en la Figura 1, está íntimamente relacionado con numerosos procesos biológicos normales y neoplásicos. Tanto el IGF-I como el IGF-II son importantes en la proliferación celular, en la diferenciación y en la supresión de la apoptosis.5 Se sabe también que el IGF-I interviene activamente en la progresión del ciclo celular, al inducir el paso de las células desde la fase G1 a la S.3
Figura 1. Representación esquemática del sistema IGF

En el espacio extracelular, el IGF-I, el IGF-II y la insulina pueden unirse potencialmente a diferentes proteínas. Cuatro receptores (IGF-IR, IGF-IIR, InsR o el receptor híbrido IGF-IR/InsR) y siete proteínas, IGFBP, pueden interactuar con los IGF y modular sus acciones.
Por otra parte, se ha informado que pacientes diabéticas con cáncer de mama tienen mejor evolución tratadas con drogas hipoglucemiantes y el antiestrógeno tamoxifeno que sus pares no diabéticas tratadas con tamoxifeno.8-10
Estos antecedentes nos llevaron a diseñar un modelo experimental animal que nos permitiera estudiar in vivo los mecanismos involucrados en los procesos de transformación mamaria maligna.11 En el presente trabajo describimos un modelo experimental para el estudio del cáncer de mama cuando un cuadro diabético está instalado, y el papel del IGF-I en esas circunstancias particulares.
Materiales y métodos
Animales: Se emplearon en total 80 ratas hembra de la cepa Sprague-Dawley, las que fueron mantenidas en condiciones acordes con las recomendadas por la Guía para el Cuidado de Animales de Laboratorio del National Research Council de los Estados Unidos,12 a fin de contar con 4 lotes de animales.
Inducción de los tumores mamarios: La inducción se efectuó mediante inyección i.p. de tres dosis del carcinógeno N-nitroso-N-metilurea (NMU), a los 50, 80 y 110 días de vida de los animales.11 Estudios ya efectuados demostraron que estos tumores presentan regulación hormonal dependiente de estrógenos y sujeta a factores de crecimiento similar a la descrita para el cáncer mamario humano.11,13-16
Inducción de diabetes: Se realizó por inyección s.c. de 90 mg/kg peso corporal de estreptozotocina (STZ) en buffer citrato pH 4.8 al segundo día de vida de los animales.17,19
Curva de tolerancia a la glucosa (CTG): Para confirmar que las ratas inyectadas con STZ habían desarrollado diabetes y previa determinación de la glucosa basal, se les efectuó la CTG inyectando 2 g/kg de peso corporal de glucosa y se midió la glucemia a los 30, 60 y 120 minutos posteriores a la inyección. Los resultados se compararon con los obtenidos en el lote de animales sin administración de STZ (control).
Ciclo estral: Se monitoreó el ciclo estral de cada rata diariamente mediante la observación microscópica de los extendidos vaginales durante todo el período de experimentación. Se determinó el estadio del ciclo estral y, sobre la base de las características observadas en los extendidos, se los clasificó en diestro, estro o proestro (la fase de metaestro no fue incluida como estadio independiente debido a su brevedad).
Parámetros de evolución tumoral: Para evaluar y comparar el desarrollo tumoral experimental en las ratas diabéticas inyectadas con el carcinógeno (lote STZ + NMU) con respecto a las no diabéticas (lote NMU), se analizaron los siguientes parámetros: a) período de latencia (PL), evaluado como el número de días transcurridos entre la primera inyección de NMU y la aparición del primer tumor en cada rata; b) número de tumores por rata (n/r), calculado como el número promedio de tumores que desarrolló cada animal; c) número total de tumores (N), determinado como el número total de tumores que desarrolló cada lote; d) incidencia tumoral (IT), como el porcentaje de ratas de cada lote que desarrolló tumor; e) volumen tumoral (VT), informado como el volumen promedio de los tumores de cada lote calculado mediante la fórmula 4/3 π r3; el radio de los tumores se calculó como el promedio entre la medición del diámetro mayor y el perpendicular a éste.
Para determinar estos parámetros los animales fueron palpados a lo largo de sus cadenas mamarias día por medio.
Lotes: Los lotes analizados quedaron conformados del siguiente modo: NMU, lote de ratas inyectadas con el carcinógeno; STZ+NMU, lote de ratas diabéticas inyectadas con el carcinógeno; STZ, lote de ratas diabéticas; Control, lote de ratas normales.
Histología: Al finalizar los experimentos, todos los tumores fueron analizados histológicamente y clasificados de acuerdo con la clasificación histológica de tumores de rata de Russo y col.19,20 También se analizaron los páncreas de los animales diabéticos y no diabéticos para conocer el grado de efecto producido por la STZ, así como otros órganos a fin de conocer su apariencia macroscópica y microscópica.
Inmunohistoquímica: Se determinó mediante inmunohistoquímica la expresión del antígeno celular de proliferación, PCNA, en todos los tumores desarrollados. El recuento se efectuó contando el número de células epiteliales positivas por campo y expresando el resultado como promedio de 10 campos de 100x de aumento de:
[Nº cél. epit. PCNA+/ Nº cél. epit. totales]x100
Niveles de IGF-I circulante: El factor IGF-I se cuantificó en plasma de todos los animales tomando muestras de sangre de la cola de todas las ratas (en ayunas) a los 50, 80 y 110 días de vida. Se empleó un juego de reactivos específico para rata con un sistema de doble anticuerpo (kit de radioinmunoanálisis, RIA). El método empleado incluye una extracción con etanol que permite la liberación del IGF-I que forma complejos con las proteínas IGFBP, por lo que cuantifica IGF-I total (tIGF-I).
Supervivencia: Dadas las características de los estudios planificados sobre ratas diabéticas y portadoras de tumores mamarios (fundamentalmente tratamientos prolongados a posteriori del desarrollo tumoral), se evaluó si el cuadro diabético instalado en los animales inyectados con STZ permitía una supervivencia en condiciones adecuadas para realizar estudios a largo plazo; por ello, en experimentos efectuados en paralelo se hicieron los estudios de supervivencia evaluándose estadísticamente los resultados mediante las curvas de supervivencia de Kaplan-Meier y la prueba de logrank empleando el programa GraphPad Prism.
Estadística: Las pruebas estadísticas aplicadas se informan en cada caso.
Reactivos: La NMU, la STZ y el buffer citrato pH 4.8 fueron comprados a Sigma Chemical Co. (St. Louis, Missouri, EE.UU.); el reactivo para IGF-I fue adquirido a Diagnostic Systems Laboratories Inc. (Texas, EE.UU.). Para la determinación de glucosa se empleó un micrométodo (Glucometer Gx, Ames S.A., Argentina). Los reactivos para inmunohistoquímica fueron: IgG anti-PCNA monoclonal de Dako Laboratories, segundo anticuerpo de BioGenex Laboratories SA (EE.UU.) y diaminobencidina en tabletas de Sigma Chemical Co. (St. Louis, Missouri, EE.UU.). Otros reactivos utilizados fueron de grado analítico.
Resultados
Inducción de diabetes: Entre las ratas inyectadas con STZ, el 90% desarrolló diabetes. Esta se manifestó claramente en los resultados de las CTG, en las que se observó una respuesta anormal a la sobrecarga de glucosa (Tabla 1). Al final de los estudios, la observación histológica de los páncreas mostró que en las ratas que habían desarrollado diabetes los islotes de Langerhans estaban muy reducidos en tamaño y número respecto de los de las ratas no diabéticas, como lo ilustra la Figura 2. Asimismo, es significativa la disminución del peso de los páncreas de ratas diabéticas en relación con las normales (Figura 2).

Tabla 1. Curva de tolerancia a la glucosa. Los resultados se informan como la media ± DE; (Control, n = 20; STZ, n = 18). p < 0.001, ANOVA de dos vías y prueba de Turkey. Datos obtenidos diariamente entre los 50 y 95 días de vida de los animales.
Figura 2. Detalle de los estudios histológicos de páncreas de ratas normales y ratas diabéticas por inyección de estreptozotocina


Rata normal de 18 cm de largo; peso del páncreas: 1.5 g. a. Se observan islotes normales en tamaño y número (H.E. 100x). b. Islote normal coloreado con tinción diferencial (Gomory, 400x). Se observan numerosas células alfa en los bordes del islote y células beta en el centro.


Rata diabética de 18 cm de largo; peso del páncreas: 0.6 g. c y d. Se observan escasos islotes de muy pequeño tamaño, sólo uno se puede calificar como mediano (150 células) mientras que los demás tienen entre 4 y 40 células. Número de islotes: 30, celularidad promedio: 4 a 40, sólo uno de 150.


Rata diabética de 17 cm de largo; páncreas de 0.5 g. e y f. Se observa reducción del tamaño pancreático, todos los islotes tienen menos de 40 células, excepto dos que llegan a 60 células. Número de islotes: 29, celularidad promedio: 40, excepto en dos islotes en los que es de 60.
Ciclo estral. Con el fin de determinar si la enfermedad diabética producía cambios hormonales importantes que llevaran a alteraciones en el ciclo estral normal se comparó la extensión de los diferentes estadios de cada ciclo de las ratas diabéticas (STZ) con la de los animales del grupo control (Control). Los resultados obtenidos se resumen en la Tabla 2, apreciándose que no se observaron diferencias significativas en la duración de los ciclos entre ambos lotes. La NMU tampoco varió significativamente la duración ni la alternancia de los ciclos.

Tabla 2. Ciclo estral. Los resultados se informan como los valores medios ± DE en días (Control, n = 20; STZ, n = 18; p = NS, ANOVA de dos factores).
Parámetros de evolución tumoral: En el grupo STZ+NMU el PL fue significativamente más prolongado y el n/r y N fueron significativamente menores que en el grupo NMU. En cuanto a la IT no se observaron diferencias significativas a partir de los 130 días luego de la primera inyección del carcinógeno, ya que a ese tiempo todos los animales habían desarrollado tumores. Sin embargo, hasta los 120 días pocos animales del lote STZ+NMU habían desarrollado tumores. En cuanto al VT, éste fue significativamente menor en las ratas STZ+NMU con respecto al de las ratas NMU (Tabla 3).

Tabla 3. Parámetros de evolución tumoral en ratas diabéticas y no diabéticas. Los resultados se informan a los 150 días luego de la primera inyección del carcinógeno NMU. PL, n/r y VT se informan como la media ± DE. (NMU, n = 20; STZ+NMU, n = 18; a , p < 0.005; b, p < 0.003; c, p < 0.003; d, p < 0.001, prueba de Mann-Witney).br>
Histología tumoral: El análisis histológico de los tumores evidenció los siguientes resultados: el 100% de los tumores desarrollados en las ratas no diabéticas (lote NMU) fueron malignos, en sus variedades cribriforme, comedociana y papilar (Figura 3); estos resultados concuerdan con los obtenidos previamente con el modelo tumoral descrito.11,13-16 En cambio, sólo el 16% de los tumores desarrollados en las ratas diabéticas fue maligno y el 84% restante evidenció claras características benignas: fibroadenomas intracanaliculares o pericanaliculares (Figura 4).
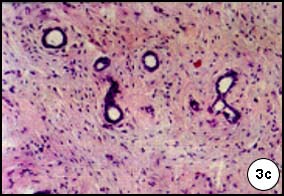
Figura 3. Imágenes histológicas correspondientes a tumores mamarios inducidos en ratas mediante el carcinógeno NMU

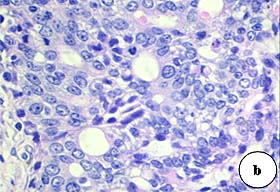



a. Carcinoma intraductal con patrón cribriforme: áreas sólidas de células epiteliales, alta actividad mitótica y escasa proliferación estromal (H.E. 100x). b. Numerosas mitosis en glándulas de un adenocarcinoma cribriforme (H.E. 400x). c. Tumor papilar incipiente (H.E.100x) d. Patrón papilar, con alta actividad mitótica, anisocariosis (H.E. 400x) e. Tumor sólido escasamente diferenciado con gran actividad proliferativa. (H.E. 100x). f. Comedocarcinoma que muestra necrosis central de las estructuras ductales y aspecto cribriforme del epitelio parietal (H.E. 20x).
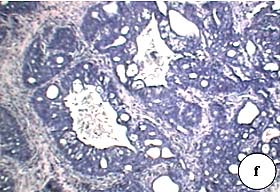
Figura 4. Imágenes histológicas correspondientes a tumores mamarios inducidos en ratas diabéticas mediante el carcinógeno NMU





a. Fibroadenoma pericanalicular. Se observan estructuras ductales rodeadas de proliferación fibrosa y lóbulos delimitados por denso tejido fibroso (H.E. 20x). b. Hiperplasia mamaria fibrosa (H.E. 20x). c. Fibroadenoma pericanalicular. Ductos rodeadaos de proliferación fibrosa que presentan una sola capa de células epiteliales (H.E. 20x). d. Fibroadenoma pericanalicular que presenta mayor grado de complejidad. Algunos sectores muestran un claro patrón intracanalicular (H.E. 100x). e. Sectores de transición entre un fibroadenoma intracanalicular (ángulo superior derecho) y un adenocarcinoma cribriforme (ángulo inferior izquierdo) (H.E. 100x). f. Adenocarcinoma cribriforme con sectores papilares, adyacente a la lesión fibroadenomatosa (H.E. 100x).
Inmunohistoquímica: El recuento de células epiteliales positivas para PCNA evidenció una cifra significativamente menor en los tumores de ratas diabéticas (STZ+NMU) en relación con las no diabéticas (NMU). Los resultados se muestran en la Tabla 3.
Niveles de tIGF-I: A los 50 días de vida, los niveles de tIGF-I de los animales de los distintos grupos no varían significativamente (Tabla 4). En las ratas no diabéticas (tanto Control como NMU) los niveles de tIGF-I circulantes a los 80 días de edad mostraron un aumento respecto del día 50, aunque no fue significativo. A los 110 días de vida los niveles de tIGF-I disminuyeron hasta valores menores a los determinados al día 50.
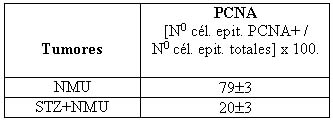
Tabla 4. Expresión de PCNA en tumores desarrollados en ratas diabéticas y no diabéticas. Los resultados se informan como las medias ± SEM del recuento en 10 campos (aumento 100x). p < 0.0001, prueba de la t.
En cambio, los valores obtenidos en las ratas diabéticas mostraron una significativa disminución a partir del día 80 con respecto a los valores inicialmente obtenidos a los 50 días.
Al comparar los niveles de tIGF-I entre los animales diabéticos y no diabéticos a las mismas edades hallamos que a partir de los 80 días de vida los animales diabéticos (tanto STZ como STZ+NMU) mostraron valores significativamente menores que los animales de los grupos no diabéticos (Control y NMU).
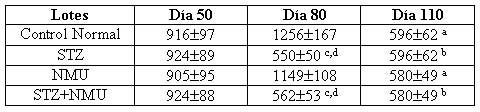
Tabla 5. Niveles plasmáticos de IGF-I (ng/ml). Contenido plasmático IGF-I total (tIGF-I) en las distintas etapas del desarrollo de la glándula mamaria y de la carcinogénesis inducida por NMU en ratas normales y diabéticas. Los resultados se informan como los valores medios ± SEM. (a, p < 0.001 Control y NMU al día 110 vs. Control y NMU al día 80; b, p < 0.01 STZ y STZ+NMU al día 110 vs. STZ y STZ+NMU al día 50; c, p < 0.01 STZ y STZ+NMU al día 80 vs. STZ y STZ+NMU al día 50; d, p < 0.001 STZ y STZ+NMU al día 80 vs. Control y NMU al día 80 (ANOVA de dos factores y prueba de Tukey a posteriori).
Supervivencia: En lotes de animales en paralelo analizamos la supervivencia de los animales diabéticos y no diabéticos inyectados con el carcinógeno (STZ+NMU vs. NMU). La supervivencia media de las ratas inyectadas con el carcinógeno fue de 150.0 días luego de la tercera administración de NMU, mientras que la de las diabéticas inyectadas con el carcinógeno fue significativamente mayor: 189.5 días (Figura 5). Tanto las ratas diabéticas (STZ) como las ratas controles (Control) tuvieron una supervivencia normal cercana a los 22 meses.
Figura 5. Supervivencia de ratas normales y diabéticas inyectadas con el carcinógeno
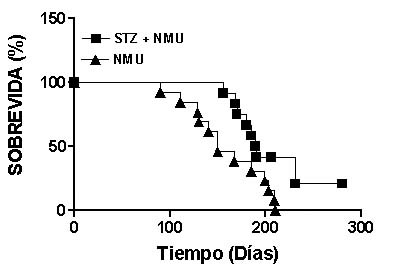
Supervivencia de ratas diabéticas inyectadas con NMU y portadoras de tumores mamarios () vs. ratas normales en las mismas condiciones (). p = 0.022, () vs. (), Kaplan Meier y prueba de logrank.
Discusión y conclusiones
En este trabajo presentamos las características particulares de un modelo experimental de tumor mamario inducido en ratas diabéticas cuando se las compara con las que presenta el mismo modelo inducido en ratas no diabéticas y el importante papel que juega el factor de crecimiento IGF-I.
En las ratas diabéticas, la diabetes producida se caracteriza por glucemia basal normal y escasa capacidad para responder a la sobrecarga de glucosa; por ende, las curvas de tolerancia a la glucosa muestran que las ratas no pueden volver a los niveles basales de glucemia después de la sobrecarga. Concordantemente con estos resultados, los estudios histológicos de los páncreas muestran islotes claramente reducidos en tamaño y número. Estudios de otros parámetros fisiológicos y bioquímicos prueban un buen estado general de los animales. La ratas ciclan normalmente, como se demuestra en el estudio de exudados vaginales, y presentan útero y ovarios con características normales (resultados histológicos). El estudio de supervivencia llevado a cabo nos permitió comprobar estadísticamente que la diabetes inducida en los animales no afecta significativamente su supervivencia per se y que, por el contario, las ratas diabéticas inyectadas con el carcinógeno sobreviven más tiempo que las no diabéticas igualmente inyectadas con NMU. Esta evaluación resultó de importancia pues permite que el modelo tumoral sea empleado en estudios a largo plazo, como lo serían por ejemplo el efecto de drogas sobre la evolución tumoral y sus posibles mecanismos de acción.22
En cuanto a los tumores mamarios que se desarrollan con el esquema de inducción de la carcinogénesis descrito cuando la diabetes está instalada, demostramos que la incidencia de tumores malignos queda prácticamente suprimida, ya que las lesiones que se desarrollaron fueron preponderantemente benignas, con un claro patrón de desarrollo fibroso; estos tumores presentaron un período de latencia más prolongado y el número de tumores y su tamaño final fueron significativamente menores que aquellos que evolucionaron en animales no diabéticos. La menor proliferación de las células del tejido tumoral también se manifiesta en una menor expresión de la proteína PCNA en los tumores desarrollados en los animales diabéticos.
Correlacionamos estos hallazgos con la influencia que el estado diabético ejerce sobre los niveles circulantes de tIGF-I y la implicancia del IGF-I sobre las etapas de la promoción y progresión tumoral mamaria. Un hallazgo importante es el que muestra que las ratas diabéticas tienen niveles de IGF-I circulante significativamente menores a partir de los 80 días de vida. En el modelo de carcinogénesis empleado, la fecha de la primera administración del carcinógeno coincide con la ventana de desarrollo de la glándula mamaria de la rata (45-55 días), y las otras dos inyecciones se efectúan durante el período de promoción de la carcinogénesis. Consideramos que el más bajo nivel de tIGF-I en ese período implica un menor estímulo para el desarrollo tumoral. Kleimberg y col.3 habían demostrado la importancia del IGF-I en el desarrollo de la glándula mamaria normal y que el sistema IGF-I difiere con la edad.3 En nuestro modelo, como señalamos, un hallazgo significativamente importante fue que en los animales diabéticos el valor de IGF-I circulante era menor durante el período de promoción/progresión tumoral.
En este trabajo determinamos también los niveles de tIGF-I circulantes a diferentes edades del desarrollo de ratas hembras normales de la cepa Sprague-Dawley. Las determinaciones se realizaron a los 50, 80 y 110 días de vida, momentos correspondientes a distintas etapas del desarrollo de la glándula mamaria de estos animales. Estas edades coinciden además con los tiempos en los que se efectúan las inyecciones del carcinógeno químico NMU empleado para la inducción del tumor mamario. En estos estudios detectamos una significativa dependencia de los niveles circulantes de tIGF-I con la edad de las ratas: hallamos una tendencia no significativa al aumento de los valores a los 80 días de vida de los animales respecto del día 50 y una disminución de los niveles al día 110. Los niveles circulantes de tIGF-I que detectamos al día 80 fueron similares a los informados por Velasco y col.23 en ratas hembra de la cepa Wistar. Estos autores informaron además una fuerte disminución de los niveles en los animales adultos.23 Frystyk y col.24 estudiaron tIGF-I circulante en ratas hembra de la cepa Wistar. En ratas púberes hallaron que los niveles de tIGF-I están elevados tanto en machos como en hembras, mientras que en el estado adulto se hallaron niveles más altos en los machos. En ratas, los niveles de tIGF-I alcanzan un pico en la pubertad. En humanos, aparentemente esto ocurriría 1 año antes en las niñas que en los niños, mientras que en la vida adulta esta dependencia del sexo parece no ser tan notoria. Con algunas diferencias en los valores de tIGF-I informados, todos los grupos de investigadores coincidimos en el hallazgo de una importante correlación entre los niveles circulantes de tIGF-I y la edad de ratas normales.
Por otra parte, numerosos grupos de investigadores informaron que altos niveles circulantes de IGF-I en humanos están asociados con un aumento del riesgo de cáncer de mama,25-28 habiéndose sugerido que la determinación de los niveles séricos de tIGF-I podría ser un buen estimador del riesgo de contraer esta enfermedad.29 En nuestro modelo se observa claramente un retraso en la aparición de lesiones y un patrón netamente benigno en ellas, coincidentemente con bajos niveles de IGF-I circulante.
Trabajos en curso en nuestro laboratorio también muestran una temprana expresión del receptor a IGF-I en los ductos de las glándulas mamarias de ratas inyectadas con el carcinógeno NMU, lo que es apreciable en menor proporción en las ratas diabéticas. Este receptor es activado por su ligando IGF-I; el factor IGF-I, como ya se expresara, regula la apoptosis y la supervivencia de las células epiteliales mamarias y, junto a otros factores como los esteroides, factor de crecimiento epidérmico, factor de crecimiento fibroblástico y otros,5,30 lo que constituye un complejo e intrincado mecanismo que regula el crecimiento del tejido mamario. Tanto el IGF-I circulante como el secretado por las células estromales favorecen la proliferación epitelial. Se informó también que la sobreexpresión de IGF-IR protege las células de la apoptosis, complementando de esta forma su actividad proliferativa. Guvakova y Surmacz31 propusieron que la sobreexpresión de IGF-IR en tumores mamarios ER+ conduce a la proliferación independiente de estrógenos. El bloqueo de los IGF-IR con anticuerpos anti-IGF-IR inhibe parcialmente el crecimiento de células privadas de estrógeno, lo que sugiere que una regulación positiva por IGF-IR en las células contribuye a mecanismos de adaptación al crecimiento en condiciones de falta de estrógenos, favoreciendo una progresión hacia la independencia hormonal y por tanto a un patrón de mayor malignidad. En nuestro caso, la protección de la célula por el IGF-IR al desencadenamiento de los fenómenos que llevan a la apoptosis acompañaría y complementaría el estímulo proliferativo iniciado por el carcinógeno NMU facilitando el establecimiento del fenotipo maligno. En función de ello, pensamos que existe un mecanismo celular puesto en juego por la célula maligna para impedir su apotosis y favorecer su proliferación, el que estaría al menos retrasado o impedido cuando los niveles de IGF-I circulantes son bajos.
El entorno celular juega un papel crucial que merece un lugar de preferencia a la hora de estudiar los procesos de transformación maligna y las interacciones entre células y matriz son claves para la mejor compresión del desarrollo de los tumores. Nuestro modelo permite comparar el desarrollo de los tumores en entornos muy diferentes y la consecuencia de esto se observa claramente en las diferencias encontradas y que hemos discutido hasta aquí. La caracterización del carcinoma mamario NMU-inducido en ratas diabéticas y la estrecha vinculación hallada con los bajos niveles de tIGF-I permitió establecer un modelo único hasta el presente para el estudio de ambas patologías en conjunto, aportando un nuevo medio biológico para profundizar el estudio de los complejos procesos que llevan al desarrollo de una lesión benigna o a un tumor maligno y la participación del sistema IGF en ellos.
El sistema IGF, particularmente el IGF-I y su receptor, son actualmente objeto de estudio como posible blanco de nuevas terapias,32,33 aun cuando más estudios son necesarios para comprender más acertadamente su papel en el desarrollo y progresión de las neoplasias. Por ello consideramos que este modelo in vivo es una interesante contribución al estudio de ambas patologías conjuntas. Actualmente se están dando los primeros avances en una investigación en pacientes portadoras de ambas patologías: cáncer y diabetes.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Bray F, McCarron P, Parkin DM. The changing global patterns of female breast cancer incidence and mortality. Breast Cancer Res. 2004, 6:229-239.
- Russo H, Russo J. Role of hormones in mammary cancer initiation and progression. J Mammary Gland Biol. Neoplasia 1998, 3:49-81.
- Kieinberg CL, Feldman W, Ruan W. IGF-I: an essential factor in terminal end bud formation and ductal morphogenesis. J. Mammary Gland Biol. Neoplasia 2000. 5:7-17.
- Valentinis B, Baserga R. IGF-I receptor signalling in transformation and differentiation. Mol. Path. 2001, 54:133-137.
- LeRoith D, Roberts CT Jr. The insulin-like growth factor system and cancer. Cancer Lett. 2003, 195:127-37.
- Lee AV, Hilsenbeck SG, Yee D. IGF system components as prognostic markers in breast cancer. Breast Cancer Res. and Treat. 1998, 47: 295-302.
- LeRoith D, Zick Y. Recent advances in our understanding of insulin action and insulin resistanse. Diabetes Care, 2001, 24: 588-597.
- Rhomberg, W. Metastasirendes mammakarzinom und diabetes mellitus - eine prognostisch günstinge krankheitskombination. Dtsch. Med. Wschr. 1975, 100: 2422-2427.
- Kamysheva EP, Abelevich IG, Andriukhina C. Diabetes mellitus and cancer. Ross. Med. Zh. 1992, 2:8-11.
- Levin E, Levin RW. Better evolution of breast cancer in type II diabetic patients under tamoxifen hypoglycemic sulfonylureas treatment. Abstracts V Int. Congress Hormones & Cancer, Quebec, 1995. Comunicación a congreso.
- Rivera E, Melito G, Davio C, y col. Histopathology and influence of the estral cycle on NMU-induced tumors in rats. Cancer Lett . 1994, 86:223-228.
- Guide for the Care and Use of Laboratory Animals, National Research Council, National Academy Press, Washington D.C., 1996. Recomendación.
- Martín G, Rivera E, Davio C y col. Receptors characterization of intraperitoneally N-nitroso-N-methylurea-induced mammary tumors in rats. Cancer Lett. 1996, 101:1-8.
- Martín G, Davio C, Rivera E y col. Hormone dependence of mammary tumors induced in rats by intraperitoneal NMU injection. Cancer Invest. 1997, 15:8-17.
- Martín G, Cricco G, Davio C y col. Epidermal growth factor in NMU-induced mammary tumors in rats. Breast Cancer Res. and Treat. 1998, 48:175-185.
- Actis A, Cocca, Gutiéerrez A y col. Estrogen receptor profiles: Changes in mouse and rat mammary tumors by SERMs treatment. Medical Principles and Practice 2004, 13:220-226, 2004.
- Weir GC, Clare ET, Zmachinski CJ y col. Islet secretion in a new experimental model for non-insulin-dependent diabetes. Diabetes 1981, 30:590-595.
- Cocca C, Martín G, Rivera E y col. An experimental model of Diabetes and Cancer in rats. Eur. J. Cancer 34:889-894; 1998.
- Cocca C, Gutiérrez A, Núñez M y col. Suppression of mammary carcinogenesis in diabetic rats. Cancer Detect. and Prev. 2003, 27:37-46.
- Russo J, Russo IH, Rogers MJ. Tumors of the mammary gland. Pathology of tumors in laboratory animals. Vol 1: Tumors of the rats. In: Turusov, V. S.; Mohr, U., eds. IARC Scientific Publications No 99, Lyon, France, 1990. Libro.
- Frystyk J, Gronbaek H, Skjaerbaek C, Flyvbjerg A, Orskov H, Baxter RC. Endocrinology 1998, 139:4286-4292.
- Núñez M, Martín G, Cocca C y col. Antitumoral action of rosiglitazona. in vivo and in vitro studies. Anticancer Research 2004, 24 (5D): 41, 3434. Resumen de congreso.
- Velasco B, Cacicedo L, Escalada J, Lopez-Fernandez J, Sanchez-Franco F. Growth hormone gene expression and secretion in aging rats is age dependent and not age-associated weight increase related. Endocrinology 1998, 139:1314-1320.
- Frystyk J, Gronbaek H, Skjaerbaek C, Flyvbjerg A, Orskov H, Baxter RC. Developmental changes in serum levels of free and total insulin-like growth factor I (IGF-I), IGF-binding protein-1 and -3, and the acid-labile subunit in rats. Endocrinology 1998, 139:4286-4292.
- Pollak MN, Huynh HT, Lefebvre SP. Tamoxifen reduces serum insulin-like growth factor I (IGF-I). Breast Cancer Res. and Treat. 1992, 22:91-100.
- Hankinson SE, Willett WC, Colditz GA, Hunter DJ, Michaud DS, Deroo B, Rosner B, Speizer FE, Pollak M. Circulating concentrations of insulin-like growth factor-I and risk of breast cancer. Lancet 1998, 351:1393-1396.
- Li BD, Khosravi MJ, Berkel HJ, Diamandi A, Dayton MA, Smith M, Yu H. Free insulin-like growth factor-I and breast cancer risk. Int. J. Cancer 2001, 91:736-739.
- Borofsky ND, Massardo S, Orentreich N. Insulin-like growth factor I (IGF-I), IGF-binding proteins, and breast cancer. Cancer Epidemiol Biomarkers Prev. 2002, 11:1566-73.
- Borofsky ND, Vogelman JH, Krajcik RA, Orentreich N. Utility of insulin-like growth factor-1 as a biomarker in epidemiologic studies. Clin Chem. 2002, 48:2248-2251.
- Rosfjord EC, Dickson RB. Growth factors, apoptosis, and survival of mammary epithelial cells. J. Mammary Gland Biol Neoplasia 1999, 4:229-237.
- Guvakova MA, Surmacz E. Overexpressed IGF-I receptors reduce estrogen growth requirements, enhance survival, and promote E-cadherin-mediated cell-cell adhesion in human breast cancer cells. Exp. Cell Res. 1997, 231:149-162.
- Van Golen CM, Castle VP, Feldman EL. IGF-I receptor activation and Bcl-2-overexpression prevent early apoptotic events in human neuroblastoma. Cell Death Differ 2000. 7:654-665.
- Cocca C, Núñez M, Gutiérrez A y col. IGF-I in mammary tumorigenesis and diabetes. Anticancer Research 2004, 24:2953-2966.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento
























