PREVALENCIA DE LA INFECCION POR HELICOBACTER PYLORI EN COMUNIDADES DE LA ETNIA WARAO DEL ESTADO DELTA AMACURO, VENEZUELA
(especial para SIIC © Derechos reservados)
Coautores
María Eugenia Cavazza* Orquídea Rodríguez* Isabel Hagel* María Correnti** Jacinto Convit*
Instituto de Biomedicina Ministerio de Salud y Desarrollo Social –Universidad Central de Venezuela*
Instituto de Hematología y Oncología UCV**
Recepción del artículo: 31 de enero, 2005
Aprobación: 22 de febrero, 2005
 Conclusión breve
En las comunidades estudiadas existe alta prevalencia de infección por Helicobacter pylori, con condiciones ambientales que incrementan el riesgo de infección.
Conclusión breve
En las comunidades estudiadas existe alta prevalencia de infección por Helicobacter pylori, con condiciones ambientales que incrementan el riesgo de infección.
 Resumen
El objetivo de este trabajo fue evaluar la prevalencia de Helicobacter pylori en niños y adultos de comunidades indígenas del estado Delta Amacuro, Venezuela, que son diferentes en cuanto a condiciones higiénicas y de alojamiento. Se evaluaron 98 niños (7 ± 3.37 años) y sus madres (33.96 ± 13.77 años) de dos comunidades indígenas de la etnia warao del estado Delta Amacuro, Venezuela. Se determinaron anticuerpos séricos IgG anti-H. pylori e IgA secretora total y específicos, además de antígenos de H. pylori en heces. Se encontró un 38% de seroprevalencia en la población infantil y un 84% en las madres. En los niños de la comunidad que tiene condiciones sanitarias y ambientales más deficientes, los títulos de anticuerpos IgG específicos y los niveles de IgA secretora total fueron significativamente (p < 0.0001) más bajos, encontrándose un alto porcentaje de niños que presentaron antígenos de H. pylori en heces (p < 0.0001). Los niveles de IgA secretora específica fueron positivos y similares en ambos grupos. Además, los estudios de calidad de agua reflejaron mayor cantidad de bacterias coliformes y sólidos totales en la población de Isla Misteriosa que en Playa Sucia. Los resultados indican que en estas poblaciones existe una alta prevalencia de infección por H. pylori y que las condiciones ambientales pueden incrementar el riesgo de infección y el daño en la mucosa gastrointestinal.
Resumen
El objetivo de este trabajo fue evaluar la prevalencia de Helicobacter pylori en niños y adultos de comunidades indígenas del estado Delta Amacuro, Venezuela, que son diferentes en cuanto a condiciones higiénicas y de alojamiento. Se evaluaron 98 niños (7 ± 3.37 años) y sus madres (33.96 ± 13.77 años) de dos comunidades indígenas de la etnia warao del estado Delta Amacuro, Venezuela. Se determinaron anticuerpos séricos IgG anti-H. pylori e IgA secretora total y específicos, además de antígenos de H. pylori en heces. Se encontró un 38% de seroprevalencia en la población infantil y un 84% en las madres. En los niños de la comunidad que tiene condiciones sanitarias y ambientales más deficientes, los títulos de anticuerpos IgG específicos y los niveles de IgA secretora total fueron significativamente (p < 0.0001) más bajos, encontrándose un alto porcentaje de niños que presentaron antígenos de H. pylori en heces (p < 0.0001). Los niveles de IgA secretora específica fueron positivos y similares en ambos grupos. Además, los estudios de calidad de agua reflejaron mayor cantidad de bacterias coliformes y sólidos totales en la población de Isla Misteriosa que en Playa Sucia. Los resultados indican que en estas poblaciones existe una alta prevalencia de infección por H. pylori y que las condiciones ambientales pueden incrementar el riesgo de infección y el daño en la mucosa gastrointestinal.
 Palabras clave
Helicobacter pylori, IgA secretora, seroprevalencia, calidad de agua, Venezuela
Clasificación en siicsalud
Palabras clave
Helicobacter pylori, IgA secretora, seroprevalencia, calidad de agua, Venezuela
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/72375
Especialidades
 Principal: Gastroenterología, Infectología,
Principal: Gastroenterología, Infectología,
 Relacionadas: Bioquímica, Diagnóstico por Laboratorio, Epidemiología, Medicina Interna, Salud Pública,
Relacionadas: Bioquímica, Diagnóstico por Laboratorio, Epidemiología, Medicina Interna, Salud Pública,
 Enviar correspondencia a:
Enviar correspondencia a:
Lic. Diana Ortiz Princz. San Nicolás a Providencia, Parroquia San José, Instituto de Biomedicina, piso 3, Laboratorio de Histoquímica, Caracas, Venezuela.
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Esta investigación fue financiada por el proyecto CONICIT S1-96001408 y por el Programa de Atención Especial al Indígena. Agradecimientos: Agradecemos a la Dra. Marian Ulrich y al Dr. Mario Sánchez Borges por la revisión de este manuscrito; a los Licenciados Federico Gonzales y Erwin Müller y al ingeniero Rina Rodríguez por su colaboración en los estudios realizados de calidad del agua; a las autoridades locales del estado Delta Amacuro; a las señoras Niria Zabaleta y Lourdes Becerra por su colaboración en la evaluación de los niños; muy especialmente a nuestros indígenas warao, por permitirnos entrar y compartir en sus comunidades.
PREVALENCE OF HELICOBACTER PYLORI INFECTION IN WARAO LINEAGE COMMUNITIES OF DELTA AMACURO STATE, VENEZUELA
 Abstract
Abstract
The purpose of this study was the evaluation of Helicobacter pylori infections in children and adults from two indigenous communities of Delta Amacuro State, Venezuela, that differ in hygienic conditions of the housing. The evaluation was performed in 98 children (mean age 7 ± 3.37 years) and their mothers (33.96 ± 13.77 years) from two communities of Warao lineage. Anti-H. pylori serum IgG and secretory anti-H. pylori IgA antibodies were determined, as well as total secretory IgA and H. pylori antigens in feces. Serological prevalence of H. pylori infection was 38% in children and 84% their in mothers. Children from the community that had the most deficient sanitary and hygienic conditions had significantly lower titers of specific IgG antibodies and total secretory IgA (p 0.0001) and a high percentage of them had H. pylori antigens in their feces (p 0.0001). The levels of specific IgA were similar in both groups. The water studies reported a larger number of total coliform counts. The results indicate that in these populations there is a high prevalence of H. pylori infection and that poor hygienic conditions can increase the risk of infection and damage to the gastrointestinal tract.
 Key words
Key words
Helicobacter pylori, secretory IgA, seroprevalence, quality water, Venezuela
PREVALENCIA DE LA INFECCION POR HELICOBACTER PYLORI EN COMUNIDADES DE LA ETNIA WARAO DEL ESTADO DELTA AMACURO, VENEZUELA
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Helicobacter pylori coloniza aproximadamente el 50% de la población mundial, y menos del 20% de los individuos infectados pueden llegar a contraer enfermedades gastroduodenales. Las enfermedades gastroduodenales asociadas con H. pylori se presentan mayormente en adultos. Sin embargo, es usual que la infección se adquiera durante la infancia1 y es posible que las respuestas humoral y de la mucosa en ese momento puedan determinar más tarde parcialmente el curso natural de la infección.2
Se sugiere que la mayoría de los individuos adquieren la infección en la niñez y predominantemente son infectados otros miembros de la familia.3,4 Cuando se adquiere la bacteria, ésta puede persistir en el hábitat gástrico por décadas. Durante ese tiempo puede sufrir considerables evoluciones genéticas, que podrían facilitar la persistencia de la bacteria en el ecosistema gástrico del huésped, incluyendo cambios en el ambiente que intervengan en la colonización de H. pylori.5 Cepas de H. pylori aisladas de individuos relacionados han sido genéticamente diferentes, de manera que pueden ser consideradas “cuasiespecies”.6
A nivel mundial se ha informado que en poblaciones infantiles la prevalencia de H. pylori varía del 10% al 80%.2,7 Las prevalencias más bajas se observaron en poblaciones del norte y del este de Europa, Japón y otras poblaciones de Asia. Las prevalencias altas fueron bien documentadas en la India y Bangladesh y en ciudades de Africa y América latina.2
En un estudio en el que se examinó la prevalencia por etnias, el incremento se observó en grupos inmigrantes de regiones de alta prevalencia y en grupos étnicos que están en riesgo, de bajo nivel socioeconómico.8,9
Diversos factores de riesgo de la infección por H. pylori, como el incremento en la edad, el bajo nivel socioeconómico y educativo, la raza, el hacinamiento en la vivienda, migraciones desde regiones de alta prevalencia, antecedentes de parientes infectados por H. pylori, indicadores de mal estado nutricional, y el consumo de agua y vegetales sin la higiene adecuada fueron bien documentados en el incremento de esta infección.2,10,11
Pocos estudios examinaron la incidencia de infección por H. pylori en niños, posiblemente debido a las dificultades de realizar pruebas invasivas en grupos de esta edad que realmente no lo requieran; por otro lado, los estudios en comunidades indígenas se dificultan por lo complicado de su acceso –tanto físico como cultural– y el mantenimiento de la logística para la continuidad de las investigaciones. El objetivo de este trabajo fue evaluar la prevalencia de H. pylori en niños y adultos de comunidades indígenas del estado Delta Amacuro, en Venezuela.
Materiales y métodos
Poblaciones estudiadas
Se evaluaron 98 niños de ambos sexos de edades comprendidas entre 1 y 14 años (7 ± 3.37 años) y 32 mujeres adultas (33.96 ± 13.77 años) de dos comunidades indígenas de la etnia warao del municipio Pedernales, estado Delta Amacuro (tabla 1). Este estado tiene un clima tropical lluvioso y suelos pantanosos del tipo hidromórfico tropical, sus comunidades de recolectores se encuentran dispersas a lo largo de las riberas del Delta del Orinoco, viven principalmente de la cacería y la pesca.

El protocolo de estudio fue aprobado por la comisión ética del Instituto de Biomedicina, Facultad de Medicina de la Universidad Central de Venezuela, y por las autoridades competentes del estado Delta Amacuro.
Las características de la población de estudio fueron comparadas con valores obtenidos de individuos venezolanos no indígenas, no infectados por H. pylori que viven en condiciones higiénicas adecuadas.
Determinación serológica de IgG anti-H. pylori
La determinación de anticuerpos IgG específicos fue realizada utilizando un kit inmunoenzimático comercial (Pyloriset EIA-G) de Orion. Se leyó la placa en un espectrofotómetro a 405 nm y las unidades de densidad óptica fueron extrapoladas en una gráfica de papel semilogarítmico, usando como referencia los calibradores suministrados por el kit, obteniendo así los resultados expresados en títulos de anticuerpos, tomando como positivos aquellos títulos mayores o iguales a 300.
Determinación de IgA secretora específica anti-H. pylori en saliva
La IgA secretora específica anti-H. pylori en saliva se determinó utilizando la técnica de ELISA estandarizada en nuestro laboratorio. Para ello se recolectó la saliva de cada sujeto directamente en su boca. Las muestras se conservaron en tubos Vacutainer con etilendiaminatetraacético (EDTA) a -20°C hasta su uso en el ensayo. Se sensibilizó la placa de poliestireno (Nunc MaxiSorp) con el antígeno de Helicobacter pylori (2.5 μg por pozo) diluido en coating buffer pH 9.6, 2 horas a 37ºC. Se bloquearon las uniones inespecíficas con PBST-BSA 0.5% 2 horas a 37ºC, luego se incubaron las muestras de saliva durante una hora a 37ºC a una dilución 1/10 con PBST-BSA 0.5%. Se utilizó como conjugado una anti-IgA marcada con peroxidasa (SIGMA) diluida 1/1 000 en PBST-BSA 0.5% incubándose a 37ºC por una hora y, por último, se revelaron los resultados con ortofenilenodiamina (SIGMA), leyendo la absorbancia a 492 nm. Se consideraron positivos aquellos valores obtenidos por encima de 0.300 unidades de densidad óptica, este punto de corte fue obtenido en trabajos anteriores.12
Preparación de antígeno de H. pylori
El antígeno crudo fue preparado a partir de cinco cepas aisladas de pacientes con úlcera duodenal (UD) e infección por H. pylori confirmada por los cuatro criterios convencionales.13 Las cepas aisladas de H. pylori se sembraron en los medios de cultivo apropiados y la recolección de los microorganismos se realizó agregando 2 ml de PBS estéril a las placas de agar y cosechando las bacterias mediante un rastrillo; las bacterias cosechadas se centrifugaron a 2 000 rpm para obtener el sedimento celular, el cual se lavó 2 veces con PBS; las células se someten a 5 ciclos de sonicación de 30 segundos cada uno, luego las muestras se centrifugaron a 14 000 rpm en una centrífuga de Eppendorf y en el sobrenadante se determinó la concentración de proteínas por el método de Lowry.14 Se realizó electroforesis en gel de poliacrilamida-SDS (10%) al sonicado celular para visualizar las bandas proteicas, para lo cual se diluyó en buffer muestra (0.06M Tris HCL, pH 6.8, 2% SDS, a 0% glicerol, 5% de 2-mercaptoetanol, 0.001% de azul de bromofenol).
Determinación de IgA secretora total en saliva
Para determinar anticuerpos IgA secretores totales en saliva se utilizó la técnica de ELISA descrita previamente.12
Determinación de antígenos de H. pylori en heces
Para la determinación de antígenos de H. pylori en materia fecal se utilizó un método de diagnóstico cualitativo inmunoenzimático comercial (Kit Premier Platinum HpSA); la placa se leyó a una absorbancia de 450 nm. Aquellas muestras cuyos valores de absorbancia fueron menores a 0.140 se consideraron negativas; entre 0.140 y 0.160, ambiguas, y positivas aquellas mayores o iguales a 0.160.
Análisis de la calidad del agua
Se tomaron muestras de agua del río en las zonas de consumo y uso por parte de los habitantes de cada comunidad y se examinaron para la determinación de sólidos totales y análisis microbiológico según los métodos estándar para el análisis de agua de la Asociación Americana de Salud Pública.15
Análisis estadístico
Se calcularon las medias geométricas y desviaciones estándar de los títulos de anticuerpos específicos de IgG, así como de los valores de IgA secretora total y específica. Las comparaciones entre los diferentes grupos se realizaron mediante la prueba t de Student y las diferencias entre proporciones se compararon aplicando la prueba de ji al cuadrado (χ2).
Resultados
Con respecto a los valores inmunológicos estudiados en el grupo de niños, se encontró un 38% de seroprevalencia al evaluar anticuerpos IgG séricos anti-H. pylori, encontrándose títulos altamente positivos de este anticuerpo (828 ± 583), que fueron significativamente más elevados en la comunidad de Playa Sucia que en Isla Misteriosa (p < 0.0001). La media de los valores detectados de IgA secretora total medida en la saliva de los niños de ambas comunidades fue de 0.64 ± 0.25 UDO; los niveles detectados de este anticuerpo fueron significativamente más elevados (p < 0.001) en los niños de la comunidad de Playa Sucia que en los de la comunidad de Isla Misteriosa; sin embargo, los niveles de IgA secretora anti-H. pylori en saliva fueron homogéneos y positivos en ambos grupos (0.47 ± 0.22 UDO). Por otra parte, al evaluar la presencia de antígenos de H. pylori en heces se encontró 95% de positividad en los niños de Isla Misteriosa, en contraste con 10% en el grupo de Playa Sucia (tabla 2).

Al estudiar el grupo de mujeres adultas se encontró 84% de seropositividad para IgG específica con una media de títulos elevados (2 288 ± 2 005); además, se detectaron niveles elevados de IgA secretora total (0.82 ± 0.32 UDO) y los valores de IgA secretora específica anti-H. pylori en saliva (0.57 ± 0.21 UDO) fueron significativamente más altos (p < 0.05) que en adultos no infectados por H. pylori. Los antígenos en heces no pudieron ser evaluados en este grupo.
El estudio de anticuerpos con respecto a la edad mostró un progresivo aumento de los niveles de IgA secretora total y específica anti-H. pylori (figura 2), medidos en saliva, así como de títulos de anticuerpos específicos de IgG (figura 1a, 1b). La seroprevalencia se incrementa con la edad, observándose los títulos más elevados a los 40 años, edad a partir de la cual comienzan a descender. Se observó una clara tendencia al aumento proporcional de los niveles de IgA secretora total con respecto a la edad; la IgA secretora específica anti-H.pylori también aumenta progresivamente con la edad y parece permanecer estable a partir de los 35 años (figura 2).



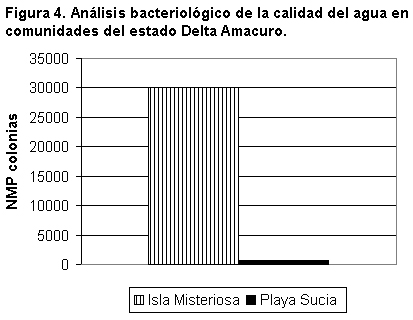
Por otra parte, el estudio de calidad del agua mostró, en la población de Isla Misteriosa, mayor cantidad de sólidos disueltos, suspendidos y sedimentables (mg/l) (figura 3) que en Playa Sucia, además de un significativo mayor número probable de coliformes (figura 4).

Discusión
En nuestro país existe una alta prevalencia de infección por H. pylori en poblaciones adultas e infantiles.12,16 A pesar de que muchas investigaciones informaron la prevalencia de infección por esta bacteria, los estudios realizados en poblaciones infantiles indígenas son escasos.
Los títulos de IgG específica anti-H. pylori de los niños evaluados en las comunidades del estado Delta Amacuro fueron elevados con respecto a los valores normales. No se reflejó ninguna diferencia entre la seroprevalencia de ambas comunidades. La seroprevalencia encontrada es similar a la informada en otras poblaciones rurales infantiles de nuestro país12,16 y de otros países.17-19 Esto es importante ya que se comunicó que los títulos altos están probablemente asociados con el posible desarrollo de carcinoma gástrico comparados con los títulos bajos.20 Por otra parte, la media de los niveles de IgA secretora total detectados fueron más bajos que los encontrados en grupos de niños de otras comunidades rurales no indígenas de Venezuela21 y también significativamente más bajos que en niños sanos sin ninguna patología gástrica. En la inmunidad de las mucosas, anticuerpos IgA secretores locales desempeñan un papel primordial en la protección contra antígenos foráneos.22 Además, las deficiencias en la producción de estos anticuerpos podría ser un indicador de daño del tejido de la mucosa. Tomando en cuenta que las condiciones higiénicas, ambientales y socioeconómicas en las que se desenvuelven estos niños son deficientes, y que están permanentemente expuestos a infecciones que comprometen la mucosa gástrica, es posible que existan alteraciones en la inmunidad de la mucosa gastrointestinal que generen deficiencias en la producción de IgA secretora o que inhiban la exposición de antígenos luminales por las células Th2 que favorecen la respuesta de anticuerpos IgA positivamente seleccionada,23 de manera que alteraciones en los mecanismos de regulación de la respuesta inmune podrían dirigirla hacia un proceso de inflamación crónica de la mucosa. Por otro lado, es posible que exista algún efecto de susceptibilidad de la etnia.
No se encontraron diferencias en los niveles de IgA secretora específica anti-H. pylori entre ambas comunidades; sin embargo, los valores están por encima del punto de corte establecido en ensayos anteriores,21 lo cual evidencia el desarrollo de una respuesta inmune local específica a través de la producción de anticuerpos IgA secretores anti-H. pylori, ya que se informó que durante la infección se incrementan los niveles de anticuerpos locales y específicos contra H. pylori.24,25
Al comparar ambas comunidades encontramos que el promedio de edad de los niños de la comunidad de Playa Sucia fue mayor, éste podría ser uno de los aspectos que explique que los niveles de IgA secretora total y los títulos de IgG anti-H. pylori sean significativamente mayores que los encontrados en los niños de Isla Misteriosa, ya que el desarrollo de la respuesta inmune de memoria y los títulos de anticuerpos aumentan progresivamente con la edad.10 Además, encontramos mayor porcentaje de niños con antígenos de H. pylori en heces en la comunidad de Isla Misteriosa, lo cual sugiere probablemente que hay más niños con infección reciente en esta población.
Las condiciones ambientales pueden influir de manera significativa en el estado de salud de las personas, modulando la respuesta inmune,21 y altas tasas de la infección están asociadas con bajo nivel socioeconómico, alta densidad de la población y condiciones higiénicas inadecuadas.26 Los estudios de calidad del agua realizados en esta evaluación reflejaron que en la comunidad de Isla Misteriosa el agua tiene mayor cantidad de agentes contaminantes, como colonias de coliformes y sólidos totales. Si bien es cierto que las dos comunidades estudiadas pertenecen a la etnia warao y sus características geográficas son similares, debe tomarse en cuenta que Playa Sucia es una comunidad organizada a través de un programa piloto llevado a cabo por la Dirección Regional de Saneamiento Ambiental del Ministerio de Salud y Desarrollo Social de Venezuela, desde 1998, donde se han llevado a cabo políticas que mejoran las condiciones de la vivienda y saneamiento ambiental; además, en esta comunidad las viviendas están construidas en el suelo paralelo a la ribera del río; por el contrario, en la comunidad de Isla Misteriosa las condiciones higiénicas y sanitarias son muy deficientes, las viviendas son palafitos construidos a orillas del río, donde abundan estancamientos de agua y formas pantanosas que proporcionan condiciones óptimas para el desarrollo de microorganismos y otros agentes infecciosos generando una fuente permanente de infección para sus habitantes. Aunque las vías de transmisión de H. pylori no están bien establecidas, modos de transmisión fecal-oral y oral-oral han sido bien sugeridos27 y la transmisión intrafamiliar es importante en la adquisición de la infección.28,29 Helicobacter pylori ha sido cultivado a partir de vómito, saliva y heces diarreicas.30
Los resultados de este estudio indican que estas comunidades presentan una alta prevalencia de infección por H. pylori y que las condiciones higiénicas pueden influir el la prevalencia de la infección, incrementando así el riesgo de ocasionar daños en la mucosa gastrointestinal, dirigiendo el curso de la infección. Es importante continuar estudios en este tipo de comunidades donde las infecciones son recurrentes y el daño a la mucosa gastrointestinal puede convertirse en un problema crónico que genera permanentemente un reto inmunológico, por lo tanto, los datos obtenidos en esta investigación pueden ser importantes para diseñar y ejecutar medidas epidemiológicas locales y estudiar el desarrollo de la respuesta inmune en distintos grupos étnicos.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Wotherspoon A, Doglioni C, Diss T, Pan l, Moschini A, de Boni M, Isaacson P 1993. Regression of primary low-grade B-Cell gastric lymphoma of mucosal-associated lymphoid tissue type after eradication of Helicobacter pylori. Lancet 342:575-577.
- Torres J, Pérez-Pérez G, Goodman K, Atherton J, Gold B, Harris P, Madrazo de la Garza A, Guarner J, Muñoz O 2000. A comprehensive review of the natural history of Helicobacter pylori infection in children. Archives of Medical Research 31:431-469.
- Brenner, H et al. 1999. Active infection with Helicobacter pylori in healthy couples. Epidemiol. Infect. 122:91-95.
- Rothenbacher D, Bode G, Berg G, Knajer U, Gonser T, Adler G, Brenner H 1999. Helicobacter pylori among preschool children and their parents: evidence of parent-child transmission. J Infect Dis 179:398-402.
- Falk PG, Syder A, Guruge J, et al. 2000. Theroretical and experimental approaches for studying factors defining the Helicobacter pylori-host relationship. Trends Microbiol. 8:321-329.
- Covacci A, Falkow S, Berg D, Rappouli R. 1997. did the inheritance of a pathogenicitu island modify the virulence of H. pylori Trends Microbiol 5:205-208.
- Vaira D, Miglidi M, Mule P, holton J, Menegatti M, Vergura M, Biasco G, Corte R, Logan RP, Barbar L 1994. Prevalence of peptic ulcer in Helicobacter pylori positive blood donors. Gut 35:309-312.
- Ma J, You W, Gail MH, Zhang L, Blot WJ, Chang Y, Jiang J, Liu W, Hu Y, Brown LM, Xu G, Fraumeni JF. Helicobacter pylori in a longitudinal study of New Zealanders at ages 11 and 21. Aust N Z J Med 1998; 28:585.
- Vorobjova T, Grünberg H, Oona M, Maaroos HI, Nilsson I, Walström T, Covacci A, Uibo R 2000. Seropositivity to Helicobacter pylori and CagA protein in schoolchildren of different ages living in urban and rural areas in southern Estonia. Eur J Gastroenterol Hepatol 12:97.
- Graham DY, Malaty HM, Evans DG, Evans DJ, Klein PD, Adam E. Epidemiology of Helicobacter pylori in an asymptomatic population in the United States. Effect of age, race, an socioeconomic status. Gastroenterology 1991; 100:1495-501.
- Smoat BL, Kelly PW, Taylor DN 1994. Seroprevalence of Helicobacter pylori infection in a cohort of US Army recruits. Am J Epidemiology 193:513-9.
- Ortiz D, Daoud G, Daoud N, Cavazza ME, Urrestarazu MI, Rodríguez N, Correnti M, Avila M. 2001. Evaluación de los niveles de IgA secretora en saliva de niños con Helicobacter pylori. Archivos Venezolanos de Puericultura y Pediatría 65:44-49.
- Chacón E, Correnti M, Salma N, Serrano N, Piñero R, Cavazza M, Urrestarazu M. (1995). Ensayo inmunoenzimático para el serodiagnóstico de la infección por Helicobacter pylori. Gen, 49, 208-211.
- Lowry O, Rosebrough N, Farr A, Randall R. 1951. Protein measurement with the folin phenol reagent. J Biol Chem 193:265-275.
- American Public Health Association (1995). Standard Methods for the Examination of Water and Wastewater. APHA-AWWA-WAF.
- Piñero R, Plasencío A, Avila M, Urrestarazu MI, Serrano N, Correnti M, Cavazza ME 2000. Helicobacter pylori en niños de “El Clavo”, una población rural venezolana. Gen revista de la Sociedad Venezolana de Gastroenterología 54:12-17.
- Bode G, Rothenbacher D, Brenner H, Adler G. (1998). Variation in the 13C- urea breath test value by nationality in Helicobacter pylori-infected children. Scand Journal Gastroenterology 33:468-472.
- Elitsur Y, Short JP, Neace C. (1998). Prevalence of Helicobacter pylori infection in children from urban and rural West Virginia. Dig Dis Sci 43:773-778.
- Torres J, Leal Herrera Y, Pérez Pérez G, Gómez A, Camorlinga Ponce M, Cedillo Rivera R, Tapia Conyer R, Muñoz O. 1998. A community-based seroepidemiologic study of Helicobacter pylori infection in Mexico. J Infect Dis 178:1089-94.
- Fujioka N, Fahey MT, Hamada GS. 2001. Serological immunoglobulin G antibody titers to H. pylori in Japanese Brazilian and non-Japanese Brazilian gastric cancer patients and controls in Sao Paulo. Jpn J Cancer Res 92:829-835.
- Ortiz D, Cavazza ME, López T, Avila M, Lecuna V, Correnti M, Perrone M 2000. Determinación de los niveles de IgA secretora específica anti-Helicobacter pylori en saliva en población venezolana. Enfermedades infecciosas y microbiología X Congreso de la Asociación Panamericana de Infectología 21:38.
- Goto T, Nishizono A, Fujioka T, Ikewai J, Mifune K, Nasu M. 1999. Local secretory immunoglobulin A and post-immunization gastritis correlate with protection against Helicobacter pylori infection after oral vaccination of mice. Infect Immun 67:2531-2539.
- Ernest PB, Song F, Klimpel GR, Haeberle KB, Bamford SE, Crowe G, Ye G, Reyes VE. (1999). Regulation of the mucosal immune response. Am. J. Trop. Med 60(4):2-9.
- Taylor DE, Blazer MJ 1991. The Epidemiology of Helicobacter pylori Infection. Epidemiol Rev 13:42-59.
- Wyatt JI, Rathbone BJ 1988. Immune Response of the Gastric Mucosa to Campylobacter pylori. Scand J Gastroenterol Suppl 142:44-49.
- Mitchell H, Mégraud F. 2002. Epidemiology and diagnosis of H. pylori infection. Helicobacter 7:8-16.
- Grübel P, Huang L, Masubuchi N, Stutzenberger F, Cave D. (1998) Detection of Helicobacter pylori DNA in houseflies (Musca domestica) on three continents. The Lancet. 352:788-789.
- Miyazaki, Kato M, Takata T, Une H. 2002 Intrafamilial transmission of Helicobacter pylori: the association between a parent andoffspring with respect to the presence of anti-CagA antibody. J Infect Chemother 8:70-75.
- Taneike I, Tamura Y, Shimizu T, Yamashiro Y, Yamamoto T. 2001. Helicobacter pylori intrafamilial infections: Change in source of infection of a child from father to mother after eradication therapy. Clin Diagn Laboratory Immunol 8:731-739.
- Smith K, Parsonnet J 1998. In Bacterial Infections of humans: Epidemiology and control, Evans AS and Brachman PS, Eds. 337-353.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento






