COMPARACIONES Y RESULTADOS CLINICOS EN EL CANCER DE MAMA: TAMOXIFENO E INHIBIDORES DE LA AROMATASA ADYUVANTES
(especial para SIIC © Derechos reservados)
Coautores
E. Jane Macaskill* Juliette Jackson* Lorna Renshaw** William R. Miller***
MBChB, MRCS. Edinburgh Breast Unit, Western General Hospital*
RGN. Edinburgh Breast Unit, Western General Hospital**
BSc, PhD, DSc. Edinburgh Breast Unit, Western General Hospital***
Recepción del artículo: 11 de enero, 2005
Aprobación: 17 de enero, 2005
 Conclusión breve
Revisión de las diversas estrategias farmacológicas disponibles en el tratamiento del cáncer de mama, a través del análisis de la eficacia de los distintas terapias neoadyuvantes con los inhibidores de la aromatasa en comparación con la utilización del tamoxifeno.
Conclusión breve
Revisión de las diversas estrategias farmacológicas disponibles en el tratamiento del cáncer de mama, a través del análisis de la eficacia de los distintas terapias neoadyuvantes con los inhibidores de la aromatasa en comparación con la utilización del tamoxifeno.
 Resumen
La terapia hormonal neoadyuvante en las pacientes posmenopáusicas con cáncer mamario positivo para los receptores estrogénicos (ER) o de progesterona (PgR), ya sean tumores grandes y resecables o con enfermedad local avanzada, es una opción terapéutica efectiva y segura a la quimioterapia. Los ensayos aleatorizados demostraron que la tasa de respuesta obtenida con el inhibidor de la aromatasa letrozol es mayor que con tamoxifeno. La incidencia y la capacidad de retrogradar el estadio tumoral (downstaging) es superior con el letrozol y el anastrozol que con el tamoxifeno. Los tumores de cualquier nivel de ER parecen responder mejor al letrozol que al tamoxifeno, pero los que poseen niveles de ER bajos solamente responden al letrozol y no al tamoxifeno. Aquellas mujeres que expresen los niveles más altos de ER (Allred 7 y 8) serán quienes más se beneficien con la terapia adyuvante, obteniéndose así las mayores reducciones del tamaño tumoral. Tanto el letrozol como el anastrozol parecen ser más efectivos que el tamoxifeno en los cánceres de mama positivos para el HER2. Para determinar si un tumor responderá a la terapia son necesarios tres meses de tratamiento. La tasa de recurrencia anual es menor al 1% tras la cirugía mamaria conservadora y la radioterapia posteriores a la retrogradación del estadio tumoral con la terapia endocrina neoadyuvante.
Resumen
La terapia hormonal neoadyuvante en las pacientes posmenopáusicas con cáncer mamario positivo para los receptores estrogénicos (ER) o de progesterona (PgR), ya sean tumores grandes y resecables o con enfermedad local avanzada, es una opción terapéutica efectiva y segura a la quimioterapia. Los ensayos aleatorizados demostraron que la tasa de respuesta obtenida con el inhibidor de la aromatasa letrozol es mayor que con tamoxifeno. La incidencia y la capacidad de retrogradar el estadio tumoral (downstaging) es superior con el letrozol y el anastrozol que con el tamoxifeno. Los tumores de cualquier nivel de ER parecen responder mejor al letrozol que al tamoxifeno, pero los que poseen niveles de ER bajos solamente responden al letrozol y no al tamoxifeno. Aquellas mujeres que expresen los niveles más altos de ER (Allred 7 y 8) serán quienes más se beneficien con la terapia adyuvante, obteniéndose así las mayores reducciones del tamaño tumoral. Tanto el letrozol como el anastrozol parecen ser más efectivos que el tamoxifeno en los cánceres de mama positivos para el HER2. Para determinar si un tumor responderá a la terapia son necesarios tres meses de tratamiento. La tasa de recurrencia anual es menor al 1% tras la cirugía mamaria conservadora y la radioterapia posteriores a la retrogradación del estadio tumoral con la terapia endocrina neoadyuvante.
 Palabras clave
Neoadyuvante, tamoxifeno, inhibidores de la aromatasa, cáncer de mama
Clasificación en siicsalud
Palabras clave
Neoadyuvante, tamoxifeno, inhibidores de la aromatasa, cáncer de mama
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/71974
Especialidades
 Principal: Oncología,
Principal: Oncología,
 Relacionadas: Farmacología, Medicina Familiar, Medicina Farmacéutica, Medicina Interna, Obstetricia y Ginecología,
Relacionadas: Farmacología, Medicina Familiar, Medicina Farmacéutica, Medicina Interna, Obstetricia y Ginecología,
 Enviar correspondencia a:
Enviar correspondencia a:
J. Michael Dixon, MD. Consultant Surgeon. Edinburgh Breast Unit. Western General Hospital. Crewe Road South. Edinburgh. Scotland, UK. EH4 2XU.
COMPARISONS AND CLINICAL OUTCOMES IN BREAST CANCER: NEOADJUVANT TAMOXIFEN AND AROMATASE INHIBITORS
 Abstract
Abstract
Neoadjuvant hormonal therapy for post menopausal patients with oestrogen receptor (ER) and/or progesterone receptor (PgR) positive large operable or locally advanced breast cancer is an effective and safe alternative to chemotherapy. Randomised trials have demonstrated that the response rate with the aromatase inhibitor letrozole is greater than with tamoxifen. The incidence and degree of downstaging is greater with both letrozole and anastrozole than with tamoxifen. Tumours at all levels of ER appear to respond better to letrozole than tamoxifen, but at low levels of ER responses are seen only with letrozole and not with tamoxifen. Patients most likely to benefit from neoadjuvant therapy and those who achieve the greatest reduction in tumour volume are those patients whose tumours express high levels of ER (Allred category scores 7 and 8). Both letrozole and anastrozole appear more effective than tamoxifen in HER2 positive breast cancers. Three months of treatment is adequate to determine if a tumour will respond. Following breast-conserving surgery and radiotherapy after down staging with neoadjuvant endocrine therapy, the annual local recurrence rate is less than 1%.
 Key words
Key words
Neoadjuvant, tamoxifen, aromatase inhibitors, breast cancer
COMPARACIONES Y RESULTADOS CLINICOS EN EL CANCER DE MAMA: TAMOXIFENO E INHIBIDORES DE LA AROMATASA ADYUVANTES
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Hasta hace poco el tratamiento neoadyuvante para el cáncer de mama consistía principalmente en la quimioterapia citotóxica.1-4 El tratamiento endocrino actualmente en auge es una alternativa atractiva para las mujeres posmenopáusicas con cánceres mamarios positivos para los receptores hormonales, muchas de las cuales no podrían tolerar la toxicidad del tratamiento quimioterapéutico. Un estudio ruso reciente comparó el uso de quimioterapia neoadyuvante con anastrozol, y encontró en el grupo medicado con este fármaco tasas de respuestas objetivas similares y mayor conversión a la cirugía mamaria conservadora. Estos resultados confirman que la terapia hormonal neoadyuvante es segura, que es efectiva como quimioterapia neoadyuvante en los cánceres positivos para receptores hormonales y que se asocia con baja toxicidad.5
Recientemente se llevaron a cabo algunos estudios controlados de terapia endocrina neoadyuvante que compararon el tamoxifeno con los inhibidores de la aromatasa.6-8 Los estudios preliminares utilizaron tamoxifeno pero no seleccionaron las pacientes sobre la base de sus receptores estrogénicos (ER) o progestagénicos (PgR) a fin de determinar la mayor probabilidad de respuesta.9
Estudios con tamoxifeno
La mayoría de los estudios con tamoxifeno como tratamiento primario fue realizada en pacientes ancianas, y compararon la utilización de cirugía con tamoxifeno y sin tamoxifeno con esta droga sola. Dichos estudios no fueron diseñados para evaluar el uso del tamoxifeno en el contexto neoadyuvante luego de la cirugía. Se llevaron a cabo tres grandes estudios aleatorizados que compararon el uso de tamoxifeno en monoterapia con cirugía.10-12 Las pacientes de estos estudios se seleccionaron en virtud de la presencia de cánceres de mama positivos para ER o PgR. Un estudio no mostró diferencias entre los dos tratamientos a los dos años,12 pero el estudio Nottingham encontró en el grupo medicado con tamoxifeno un aumento significativo de la progresión local;11 esto fue confirmado por un estudio multicéntrico europeo12 en el que se observó también un tiempo inferior hacia la progresión y de la supervivencia libre de enfermedad, así como un control locorregional modesto en las pacientes que recibieron dicho fármaco. En estos dos últimos estudios, la mediana del seguimiento fue de 145 y 120 meses, respectivamente.
Tres estudios aleatorizados compararon tamoxifeno en monoterapia con la cirugía seguida de tamoxifeno con un seguimiento de 6 años13 y 12 años,14,15 en los que hubo un aumento significativo de las recurrencias locales en el grupo que recibió este fármaco únicamente. En dos de los estudios se observaron mortalidad global y por cáncer de mama significativamente superiores en los grupos que recibieron solamente tamoxifeno,14,15 aunque en un estudio el aumento de la mortalidad fue evidente luego de transcurridos tres años.14
Estos hallazgos sugieren que el tratamiento hormonal por largo plazo con tamoxifeno sin cirugía debería reservarse para las pacientes cuya esperanza de vida es limitada. Todavía es prematuro afirmar si esto también se aplica a los inhibidores de la aromatasa.
En Edimburgo se han tratado muchas pacientes con tamoxifeno neoadyuvante y las tres generaciones de inhibidores de la aromatasa, letrozol, anastrozol y exemestano. Aunque las pacientes no fueron aleatorizadas y las muestras eran pequeñas se han obtenido resultados extraordinarios con los inhibidores de la aromatasa. La tabla 1 muestra el número de pacientes que presentaron disminución de más del 50% en el tamaño del tumor a través del control ecográfico. Se observó que el 46% de las pacientes tratadas con tamoxifeno, el 88% de las medicadas con letrozol y el 78% de las que recibieron anastrozol redujeron el tamaño tumoral en más del 50%. Con relación a todo el grupo, solamente dos pacientes tuvieron progresión durante el tratamiento.

Posteriormente se realizaron grandes estudios aleatorizados del tratamiento neoadyuvante con tamoxifeno e inhibidores de la aromatasa6-8 tras la publicación de estos resultados preliminares favorables, los que se discutirán a continuación.
Estudios con letrozol
Los primeros estudios llevados a cabo en Edimburgo con este fármaco, un inhibidor de la aromatasa altamente selectivo, sugirieron que podrían obtenerse más beneficios con el letrozol en las pacientes posmenopáusicas positivas para los ER que con el tamoxifeno.16 Esto motivó la realización del estudio aleatorizado PO24 en el cual se compararon 4 meses de terapia neoadyuvante con letrozol con tamoxifeno en mujeres posmenopáusicas con cáncer mamario grande que requirieron mastectomía o con enfermedad local avanzada, ya fueran ER o PgR positivas.8 Este estudio demostró que con el letrozol se obtuvieron tasas de respuesta clínica significativamente superiores a través de la palpación respecto del tamoxifeno (55% vs. 36%; p < 0.001), lo que permitió que fueran sometidas a cirugía conservadora de mama más pacientes medicadas con letrozol que con tamoxifeno (45% vs. 35%, tabla 2). La mediana del tiempo a la respuesta fue de 66 días en el grupo letrozol y de 70 días para los que recibieron tamoxifeno. Se utilizaron criterios modificados de la OMS para cuantificar la respuesta del tumor en el marco de la terapia neoadyuvante.

Las pacientes con tumores T2 fueron las candidatas más probables para la cirugía conservadora comparadas con las que presentaron tumores grandes (p = 0.0001). En este estudio aleatorizado el letrozol fue tan bien tolerado como el tamoxifeno.
Además, la respuesta del tumor se relacionó con el estado ER o PgR.9 Hubo más respuestas significativas en los pacientes en los que posteriormente se confirmó el carácter ER positivo de los tumores en comparación a los que presentaron tumores ER negativos (tabla 3). Para cada categoría ER, las tasas de respuesta fueron superiores para el letrozol respecto del tamoxifeno.
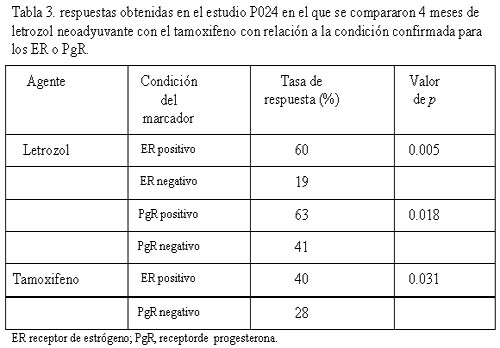
Los tumores ricos en receptores estrogénicos pueden ser caracterizados según distintos criterios. En el estudio aleatorizado P024 de letrozol prequirúrgico comparado con tamoxifeno, las respuestas clínicas se relacionaron con el nivel de expresión de los ER determinados por inmunohistoquímica a través del puntaje de Allred semicuantitativo (0-8 puntos).
No hubo respuestas inducidas por el tamoxifeno a niveles de ER por debajo de 6 puntos, en contraste con las respuestas mayores al 30% inducidas por el letrozol aun a niveles tan bajos como los de 3-5 puntos.
Estudios con anastrozol
Se publicaron dos grandes estudios aleatorizados multicéntricos, a doble ciego y con doble simulación en los que se comparó la eficacia de la utilización prequirúrgica del anastrozol y el tamoxifeno en mujeres posmenopáusicas con tumores positivos para los receptores hormonales.6,7
El estudio Immediate Preoperative Arimidex, Tamoxifen or Combined with Tamoxifen (IMPACT) seleccionó 292 pacientes del Reino Unido y de Alemania aleatorizadas para recibir anastrozol, tamoxifeno o ambos durante 3 meses previos a la cirugía.6
Las pacientes fueron sometidas a una evaluación prequirúrgica para mastectomía o cirugía conservadora de mama. El criterio de valoración principal fue la respuesta clínica objetiva medida a través de calibres. Se midió la respuesta ecográfica como criterio de valoración secundario. El estudio mostró que no existieron diferencias significativas de las respuestas objetivas entre los tres tratamientos, según lo cuantificado a través de calibres y ecografías, aunque no para las pacientes con tumores HER2+ o las que recibieron la combinación, en las que se observaron mayores tasas de respuesta clínica con anastrozol que con tamoxifeno (p = 0.09). También se encontró que el anastrozol permitió acceder significativamente a la cirugía mamaria conservadora en aquellas pacientes en las que inicialmente se planteó la mastectomía, en comparación con el tamoxifeno o la combinación (anastrozol 46%, tamoxifeno 22%, p = 0.03).
El ensayo Preoperative Arimidex Compared with Tamoxifen (PROACT) fue un estudio multicéntrico llevado a cabo en Europa y EE.UU. que incluyó mujeres posmenopáusicas con criterios similares a los del IMPACT aunque también aquellas inoperables y las que estaban medicadas con quimioterapia.7 Las pacientes fueron aleatorizadas a recibir 1 mg de anastrozol (n = 202) o 20 mg de tamoxifeno (n = 201), ambos grupos con placebo, por un período de 3 meses. El criterio de valoración principal fue la respuesta objetiva del tumor controlado ecográficamente. La medición con calibres fue incluida como criterio de valoración secundario desde la evaluación prequirúrgica hasta finalizar el período de 3 meses. No se observaron diferencias significativas en las tasas de respuesta objetiva (ORR) entre los distintos grupos de tratamiento, aunque se constató una leve tendencia a favor de anastrozol en aquellas pacientes que recibieron solamente la terapia hormonal (36.2 vs. 26.4 según ecografía; p = 0.07 y 49.7 vs. 39.7% con calibre; p = 0.08). Sin embargo, se observaron cifras más altas de ORR a favor del anastrozol en aquellas pacientes a las que en la evaluación inicial se les había indicado mastectomía (36.6 vs. 24.2% con ecografía; p = 0.03; y 48.6 vs. 35.8% vs. 35.8% con calibre, p = 0.04).
Esto se tradujo, además, en una mejoría quirúrgica significativa para aquellas pacientes que inicialmente hubiesen requerido mastectomía, de las cuales el 43% de las tratadas con anastrozol fueron sometidas a cirugía conservadora de mama, comparadas con el 30% de las que recibieron tamoxifeno (p = 0.04), así como un mayor número de pacientes que inicialmente presentaron tumores inoperables se beneficiaron de un procedimiento quirúrgico al ser medicadas con anastrozol. No se observaron eventos adversos significativos.
Posteriormente se realizó un análisis combinado de estos dos estudios, lo que representó un total de 535 pacientes, en los que se estudió la ORR y la mejoría quirúrgica.17 Se encontró una tendencia a favor del anastrozol cuando se analizó la ORR a través de calibres y ecografía en todo el grupo, aunque no significativa. Sin embargo, se observó una ORR significativamente superior para el anastrozol en el subgrupo de pacientes que hubiesen requerido mastectomía o con tumores inoperables (47 vs. 35%; p = 0.026, con calibres y 36% vs. 26% con ecografía; p = 0.048).
Hubo una mejoría quirúrgica significativa (anastrozol 43% vs. tamoxifeno 31%; p = 0.019) en aquellas pacientes con tumores que hubiesen requerido mastectomía o aquellos inoperables en la evaluación inicial. Por lo tanto, parece que el anastrozol es significativamente superior con respecto al tamoxifeno en la capacidad para retrogradar los estadios tumorales (tabla 4).

Estudios con exemestano
Los estudios iniciales de terapia neoadyuvante realizados con esta droga en Edimburgo mostraron que 10 de 12 pacientes presentaron reducción de más del 50% del tamaño tumoral, resultados considerados prometedores (tabla 1).
En Rusia se realizó un estudio pequeño en el que se comparó el uso neoadyuvante de exemestano con tamoxifeno18 y en donde 73 mujeres posmenopáusicas con cáncer de mama positivo para receptores hormonales fueron aleatorizadas para recibir exemestano o tamoxifeno por un período de 3 meses. El criterio de valoración primario fue la respuesta objetiva a través de la palpación, y como criterios secundarios la OR cuantificada a través de mamografías y ecografías y el número de pacientes sometidas a cirugía conservadora de mama.
La tasa de respuesta objetiva clínica fue superior para el exemestano (88.6%) comparada con la del tamoxifeno (57.3%; p < 0.05) aunque no resultó significativamente superior cuando se la evaluó a través de las mamografías o ecografías. Hubo significativamente más mujeres medicadas con exemestano (38.7%) que fueron sometidas a cirugía conservadora de la mama que las del grupo tratadas con tamoxifeno (10.8%; p < 0.05).
Selección de pacientes para la terapia neoadyuvante
Los resultados publicados indican que la selección para la terapia neoadyuvante endocrina debe basarse fundamentalmente en el estado ER y en grado menor al de los PgR.9 Aunque el ensayo PO24 sugirió que una de las diferencias entre el tamoxifeno y el letrozol se debía a que las pacientes con niveles más bajos de ER tenían más posibilidades de responder al segundo que al primero, dichas diferencias resultaron demasiado pequeñas, por lo que mantenemos la estrategia de tratar con terapia neoadyuvante a las pacientes candidatas a la cirugía con puntaje de Allred igual o mayor a 6, debido a que estas mujeres son las que probablemente mejor respondan y obtengan más beneficios clínicos en virtud de la reducción del tamaño tumoral.
En Edimburgo, series de 24 mujeres posmenopáusicas con grandes tumores operables, ricos en receptores de estrógenos, recibieron tratamiento neoadyuvante con anastrozol por 3 meses.19 Veintidós pacientes tenían tumores lo suficientemente extensos para evaluar el estado erbB2 previo al tratamiento y estudiar los cambios en la proliferación a través del anticuerpo Ki67 y el PgR con el anticuerpo DAKO.20 Hubo 6 tumores erbB2 3+ y otros 16 tumores resultaron negativos o 1+. No hubo diferencias en la respuesta clínica entre los dos grupos (tabla 5), así como en la proliferación inicial, los cambios en la proliferación o el PgR. Estos resultados muestran que el anastrozol es clínica y biológicamente efectivo tanto en los tumores erbB2 positivos como negativos. En series con mayor número de pacientes se observaron resultados similares con el uso de letrozol neadyuvante.21

En el estudio PO24 con letrozol se observó una diferencia particular en las tasas de respuesta de los tumores ER positivos que sobreexpresaban los erbB1 o los erbB2 (HER1 o HER2), con una tasa del 88% en el grupo medicado con letrozol comparada con el 21% de las que recibieron tamoxifeno (p = 0.0004).9
Aunque el tamoxifeno ha sido el tratamiento endocrino de referencia para el cáncer de mama por casi 30 años, habiendo demostrado buena eficacia y tolerabilidad tanto en el marco adyuvante como en la enfermedad avanzada, los datos clínicos indican que los tumores erbB2 positivos pueden ser resistentes a este fármaco, si bien no todos los estudios concuerdan al respecto.20
Los inhibidores de la aromatasa son los agentes neoadyuvantes de elección debido a su mejor eficacia general, particularmente para los tumores erbB1 y erbB2 positivos.
Duración de la terapia neodyuvante
La práctica estándar con quimioterapia adyuvante consiste en la administración de 3 a 6 ciclos previos a la cirugía, lapso considerado adecuado para distinguir las que responden al tratamiento de las que no lo hacen.22 En un estudio llevado a cabo en la Edinburgh Breast Unit se administró tamoxifeno neoadyuvante a 100 pacientes mayores de 70 años con cáncer de mama enriquecido con ER (> 20 fmol/mg de proteínas citosólicas).23 Luego de 3 meses, en 72 pacientes los tumores habían respondido (sobre la base de una reducción del 25% en el tamaño del tumor según ecografía) y en una paciente se constató la progresión de la enfermedad. Las 27 mujeres restantes continuaron recibiendo tamoxifeno por 3 meses adicionales, en los cuales 18 pacientes no modificaron el curso de su enfermedad, 4 respondieron y 5 progresaron. Teniendo en cuenta estos resultados puede concluirse que si las pacientes no responden en 3 meses, es poco probable que lo hagan y preocupa el hecho de que si son medicadas solamente con tamoxifeno la enfermedad progrese.Por lo tanto, 3 meses parecen ser suficientes para demostrar si el tumor responde o no. Sin embargo, las respuestas máximas pueden insumir mucho más de 3 meses, la duración óptima del tratamiento depende del tamaño inicial del tumor y de los objetivos de la terapia neoadyuvante. Si dichos objetivos consisten en la retrogradación del tumor para permitir la cirugía conservadora de mama, para la mayoría de los pacientes esto puede lograrse con 3 a 4 meses de tratamiento.
Casi todos los estudios de neoadyuvancia realizados con inhibidores de la aromatasa trataron las pacientes por 3 a 4 meses, período en el cual muchos tumores respondieron lo suficiente para retrogradar el procedimiento quirúrgico requerido para remover el tumor. Sin embargo, algunos permanecen inoperables o requieren mastectomía. Un estudio prospectivo de 142 mujeres posmenopáusicas con grandes tumores de mama o enfermedad local avanzada (con ER Allred > 6) analizó en Edimburgo la respuesta clínica al letrozol.24 Transcurridos 3 meses, 100 pacientes respondieron lo suficiente para permitir la cirugía conservadora de mama, a la que se procedió. Las 42 pacientes restantes continuaron recibiendo el fármaco por al menos tres meses adicionales. A los 12 meses, 22 continuaban recibiendo el letrozol. La reducción porcentual mediana del tamaño del tumor fue del 52% en el periodo de 0 a 3 meses, 57% en el de 3 a 6 meses y del 66% entre los meses 6 y 12, mostrando que el tamaño del tumor continuó reduciéndose en el período de estudio de 12 meses. La tasa de respuesta completa también se incrementó a lo largo del tiempo, observándose 9.5% a los 3 meses, 29% a los 6 meses y 36% a los 12 meses. Estos resultados muestran que el letrozol puede ser utilizado con seguridad hasta los 12 meses.
Respuestas y retrogradación en el cáncer de mama
Las tasas de respuesta a la quimioterapia prequirúrgica oscilan generalmente alrededor del 80%, más allá del régimen utilizado.25 En pacientes apropiadamente seleccionadas, la terapia endocrina neoadyuvante también produce resultados similares (tabla 5). En series de pacientes con cáncer de mama local avanzado tratadas con quimioterapia neoadyuvante previa a la cirugía, el 62.5% de las pacientes mostró focos múltiples del tumor remanentes tras la escisión.26 Esto contrasta con nuestra experiencia preliminar con 47 pacientes tratadas con cirugía de mama conservadora luego de la neoadyuvancia con tamoxifeno y en la cual en un solo caso se realizó una escisión incompleta en una paciente con cáncer lobular invasivo.27

Una revisión reciente llevada a cabo en Edimburgo analizó diversas series de escisiones locales ampliadas realizadas en pacientes que recibieron o no tratamiento prequirúrgico y mostraron buenos resultados con la terapia neoadyuvante. De 1 374 pacientes sometidas a dicho procedimiento sin tratamiento previo, 156 (11.4%) requirieron una nueva escisión sobre los márgenes y 78 (5.7%) requirieron mastectomía. En las pacientes que habían recibido la terapia neoadyuvante, un número significativamente menor (n = 6 (4.1%); p = 0.007) requirió nueva escisión y otras 6 pacientes (4.1%) fueron sometidas a mastectomía. No hubo una proporción significativamente mayor de pacientes del grupo neoadyuvante que haya conservado la mama exitosamente en un único procedimiento en comparación con aquellas que no habían recibido tratamiento prequirúrgico (92% vs. 83 %; p = 0.006).
Recurrencia local tras terapia endocrina neoadyuvante seguida de terapia conservadora de mama
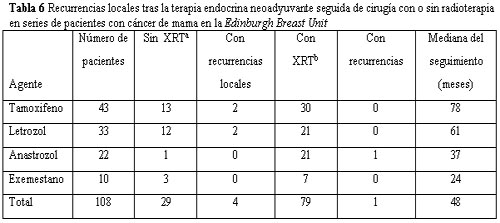
Muchos estudios evaluaron las tasas de recurrencia del tumor tras la terapia neoadyuvante seguida de cirugía. Veronesi y col. comunicaron 12 casos de recurrencia local en 203 pacientes a través de un periodo de seguimiento promedio de hasta 3 años posteriores a la quimioterapia prequirúrgica.28 Esto resultó considerablemente mejor que la tasa de recurrencia del 22% observada en pacientes sometidas a mastectomía, ya que luego de la quimioterapia no eran candidatas para la cirugía conservadora de mama. En otro estudio, las tasas de recurrencia resultaron similares para las pacientes que habían recibido quimioterapia endocrina inicial con valores del 3.5% comparados con las tratadas en forma convencional (cirugía seguida de terapia sistémica), en donde la tasa de recurrencia fue del 2.7%.29 Los únicos datos disponibles en cuanto a la recurrencia local tras la cirugía conservadora en pacientes que recibieron terapia endocrina neoadyuvante se presentan en la tabla 6. Estos datos de estudios realizados en Edimburgo resaltan la importancia de que las pacientes reciban radioterapia posquirúrgica. Más del 25% de las pacientes desarrolló recurrencias locales luego de la terapia endocrina neoadyuvante y escisiones amplias sin radioterapia a los 5 años,27 pero solamente 2 pacientes de un total de 85 que fueron sometidas a radioterapia desarrollaron recurrencias locales con una mediana de seguimiento de 5 años. Estos resultados indican que la cirugía conservadora de mama seguida de radioterapia brinda un control satisfactorio de la enfermedad local que puede ser obtenido por las pacientes que retrogradaron con la terapia endocrina neoadyuvante.
La población de pacientes tratada con terapia endocrina neoadyuvante tiende a ser de ancianas, las cuales presentan comorbilidades significativas, es decir que muchas pacientes morirán por causas distintas del cáncer de mama. Debido a esto, es difícil comparar la supervivencia a largo plazo de las series de pacientes tratadas con este tipo de terapia.
Se ha comunicado que tanto la supervivencia libre de enfermedad como la supervivencia general han sido similares en las pacientes tratadas con quimioterapia neoadyuvante prequirúrgica o en aquellas tratadas con terapia sistémica posquirúrgica.30-33 Un estudio recientemente presentado comparó el uso de neoadyuvancia prequirúrgica dirigida contra los ER con la terapia adyuvante, sin que se observaran diferencias de supervivencia en las pacientes tratadas con terapia endocrina o con quimioterapia comparadas con las que fueron sometidas inicialmente a cirugía seguida de terapia sistémica.34
Conclusión
La terapia endocrina neoadyuvante es efectiva en pacientes apropiadamente seleccionadas. Las reducciones del tamaño tumoral que se obtienen con la terapia endocrina primaria son similares a las comunicadas para la quimioterapia neoadyuvante en mujeres jóvenes. Por el contrario, la toxicidad es más baja con la terapia endocrina, un tratamiento muy bien tolerado con pocas pacientes que se vean en la necesidad de discontinuarlo en virtud de sus efectos colaterales.
Desde una perspectiva quirúrgica, la capacidad de llevar a cabo cirugías menos extensas con la terapia endocrina constituye una ventaja, sobre todo teniendo en cuenta las comorbilidades y el estado general de muchas de las pacientes que la reciben. Los datos disponibles en la actualidad sugieren que la cirugía conservadora de mama seguida de radioterapia resulta en bajas tasas de recurrencia en pacientes que retrogradaron su estadio tumoral con la terapia endocrina neoadyuvante. Las pacientes que tienen más probabilidades de responder a este tratamiento son aquellas cuyos tumores poseen niveles aumentados de ER (Allred ≥ 6).
Las tasas de respuesta a la terapia neoadyuvante en las mujeres posmenopáusicas mostraron ser superiores cuando se utilizan inhibidores de la aromatasa, en comparación con tamoxifeno. Esto quizá se deba a que los inhibidores de la aromatasa son efectivos tanto para los tumores erbB2 positivos como los negativos y a que el tamoxifeno es menos efectivo en los erbB2; en segundo lugar, los inhibidores de la aromatasa producen respuestas en aquellos tumores con menores niveles de ER, mientras que el tamoxifeno no lo hace.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Bear H. Indications for neoadjuvant therapy for breast cancer. Semin Oncol 1998; 25 Suppl 3:3-12.
- Perloff M, LesnickGJ. Chemotherapy before and after mastectomy in stage III breast cancer. Arch Surg 1982;117:879-881.
- Schick P, Goodstein J, Moor J, Butler J, Senter KL. Preoperative chemotherapy followed by mastectomy for locally advanced breast cancer. J Surg Oncol 1983; 22:278-282.
- Bonadonna G, Veronesi U, Brambilla C et al. Primary chemotherapy to avoid mastectomy in tumors with diameters of 3 cm or more. J Natl Cancer Inst 1990; 82:1539-1545.
- Semiglazov VF, Semiglazov V, Ivanov V et al. The relative efficacy of neoadjuvant endocrine therapy vs. chemotherapy in postmenopausal women with ER- positive breast cancer. J Clin Onc 2004; 22 (14s):519.
- Smith I, Dowsett M, on behalf of the IMPACT Trialists. Comparison of anastrozole vs. tamoxifen alone and in combination as neoadjuvant treatment of estrogen receptor-positive (ER+) operable breast cancer in postmenopausal women: the IMPACT trial. 26th Annual San Antonio Breast Cancer Symposium, Abstract 1 Presented Dec 3, 2003.
- Cataliotti L on behalf of the PROACT trialists. Efficacy of PreOperative Anastrozole Compared with Tamoxifen in postmenopausal women with hormone receptor positive breast cancer. Eur J Ca 2004; in press.
- Eiermann W, Paepke S, Appfelstaedt J et al., Preoperative treatment of postmenopausal breast cancer patients with letrozole: a randomized double-blind multicenter study. Ann Oncol 2001;12:1527-1532.
- Ellis MJ, Coop A, Singh B et al., Letrozole is more effective neoadjuvant endocrine therapy than tamoxifen for erbB-1- and/or erbB-2-positive, oestrogen receptor-positive primary breast cancer: evidence from a phase III randomized trial. J Clin Oncol 2001;19:3808-3816.
- Gazet JC, Ford HT, Coombes RC, et al., Prospective randomized trial of tamoxifen vs. surgery in elderly patients with breast cancer. Eur J Surg Oncol 1994; 20(3):207-14.
- Kenny FS, Robertson JFR, Ellis IO, Elston CW, Blamey RW. Long-term follow-up of elderly patients randomised to primary tamoxifen or wedge mastectomy as initial therapy for operable breast cancer. The Breast 1998; 7:335-339.
- Fentiman IS, Christiaens MR, Paridaens R et al., Treatment of operable breast cancer in the elderly: a randomised clinical trial EORTC 10851 comparing tamoxifen alone with modified radical mastectomy. Eur J Ca 2003; 39:306-316.
- Mustacchi G, Ceccherini R, Milani S et al., Tamoxifen alone versus adjuvant tamoxifen for operable breast cancer of the elderly: long-term results of the phase III randomized controlled multicenter GRETA trial. Ann Oncol 2003; 14(3):414-20.
- Fennessy, M, Bates T, MacRae K, Riley D, Houghton J, Baum M, on behalf of the Closed Trials Working Party of the Cancer Research UK Breast Cancer Trials Group. Late follow-up of a randomized trial of surgery plus tamoxifen versus tamoxifen alone in women aged over 70 years with operable breast cancer. Br J Surg 2004; 91(6):699-704.
- Bates T, Fennessy M, Riley DL, Baum M, Houghton J, MacRae K. On behalf of the CRC Breast Cancer Trails Group UK. Breast Cancer in the Elderly: Surgery improves survival. The results of a Cancer Research Campaign Trial. Eur J Ca 2001; 37 (supp 5):0-19.
- Dixon JM, Love CDB, Bellamy COC et al. Letrozole as primary medical therapy for locally advanced and large operable breast cancer. Breast Cancer Res Treat 2001; 66 (3):191-199.
- Smith I. Anastrozole versus tamoxifen as preoperative therapy for oestrogen receptor-positive breast cancer in postmenopausal women: Combined analysis of the IMPACT and PROACT trials. Presented at 4th European Breast Cancer Conference 2004, Hamburg, Germany.
- Semiglazov VF, Semiglazov VV, Ivanov VG. Neoadjuvant endocrine therapy: exemestane (E) vs tamoxifen (T) in postmenopausal ER+ breast cancer patients (T1-4N1-2MO) 26th Annual San Antonio Breast Cancer Symposium 2003; Abs 111.
- Dixon JM, Renshaw L, Bellamy C, Stuart M, Hoctin-Boes G and Miller WR. The effects of neoadjuvant anastrozole (Arimidex) on tumor volume in postmenopausal women with breast cancer: a randomized, double-blind, single-center study. Clin Cancer Res 2000; 6:2229-2235.
- Dixon JM, Jackson J, Hills M, Renshaw L, Cameron DA, Anderson TJ, Miller WR, Dowsett M. Anastrozole demonstrates clinical and biological effectiveness in erbB2 ER positive breast cancers. Eur J Ca, in press.
- Young O, Murray J, Renshaw L et al. Neoadjuvant letrozole is equally effective in HER2 positive and negative breast cancers. 27th Annual San Antonio Breast Cancer Symposium 2004 Abstract to be presented.
- Goldie JH. Scientific basis for adjuvant and primary (neoadjuvant) chemotherapy. Semin Oncol 1987;14:1.
- Dixon JM. Neoadjuvant therapy: surgical perspectives, in: W.R. Miller, J.N. Ingle (Eds.), Endocrine Therapy in Breast Cancer, Marcel Dekker, New York, 2002, pp. 197-212.
- Dixon JM, Renshaw L, Murray J et al. Is there an optimal duration of neoadjuvant letrozole therapy 27th Annual San Antonio Breast Cancer Symposium 2004 Abstract to be presented.
- Bonadonna G, Valagussa P, Brambilla C et al., Adjuvant and neoadjuvant treatment of breast cancer with chemotherapy and/or endocrine therapy. Semin Oncol 1991; 15:515-524.
- Moneer M, El-Didi M, Khaled H. Breast conservation surgery: is it appropriate for locally advanced breast cancer following downstaging by neoadjuvant chemotherapy–a pathological assessment. The Breast 1999; 8:315-319.
- Dixon JM, Anderson TJ, Miller WR. Neoadjuvant endocrine therapy of breast cancer: a surgical perspective. Eur J Cancer, in press.
- Veronesi U, Bonadonna G, Zurrida S et al., Conservation surgery after primary chemotherapy in large carcinomas of the breast. Ann Surg 1995; 222:612-618.
- Makris A, Powles TJ, Ashley SE, et al., A reduction in the requirements for mastectomy in a randomised trial of neoadjuvant chemoendocrine therapy in primary breast cancer. Ann Oncol 1998; 9:1179-1184.
- Kurtz JM. Should surgery remain the initial treatment of operable breast cancer Eur J Cancer 1991; 27(12): 1539-1542.
- Fisher B, Bryant J, Womark N, et al. Effect of preoperative chemotherapy on the outcome of women with operable breast cancer. J Clin Oncol 1998; 16(8):2672-2678.
- Mauriac L, Durand M, Avril A, Dilhuydy JM. Effects of primary chemotherapy in conservative treatment of breast cancer patients with operable tumours larger than 3 cm. Results of a randomised trial in a single centre. Ann Oncol 1991;2(5):347-354.
- Semiglazov VF, Topuzov EE, Bavli JL et al., Primary (neoadjuvant) chemotherapy and radiotherapy compared with primary radiotherapy alone in stage IIb–IIIa breast cancer. Ann Oncol 1994; 5 (7):591-595.
- Cameron DA, Jack W, Forouhi P, Keen J, Dixon JM, Leonard RCF, Chetty U. Oestrogen receptor directed primary systemic therapy: a randomised trial compared with conventional therapy in operable breast cancer. Breast Cancer Res Treat 2002; 76 Suppl. S5 Abstract 157.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:





