LA CABERGOLINA EN EL TRATAMIENTO DE LA ENFERMEDAD DE PARKINSON
(especial para SIIC © Derechos reservados)
Coautor
Eduardo Tolosa*
Unidad de Parkinson y Movimientos Anormales. Servicio de Neurología, Institut Clínic de Malalties del Sistema Nerviós, IDIBAPS. Hospital Clínic, Facultad de Medicina de la Universidad de Barcelona, Ba*
Recepción del artículo: 11 de enero, 2005
Aprobación: 22 de febrero, 2005
 Conclusión breve
La cabergolina es una opción adecuada para los pacientes con enfermedad de Parkinson de novo.
Conclusión breve
La cabergolina es una opción adecuada para los pacientes con enfermedad de Parkinson de novo.
 Resumen
La cabergolina (1-[(6-alelilergolin-8 beta-il)carbonil]-1-[3-(dimetilamino)propil]-3-etilurea) es un novedoso agonista de los receptores dopaminérgicos D2 para la terapia farmacológica en la enfermedad de Parkinson (EP). La cabergolina tiene una vida media larga (alrededor de 68 horas) lo que permite su administración en dosis única diaria. En base a la información disponible en monoterapia, la cabergolina induce una mejoría de los síntomas similar al proporcionado por otros agonistas dopaminérgicos. En pacientes con EP de novo, la cabergolina en monoterapia representa una opción adecuada para el tratamiento sintomático ya que mejora los síntomas motores, retrasa la aparición de complicaciones motoras por levoterapia y disminuye los requerimientos de levodopa. Como tratamiento coadyuvante a la levodopa es un fármaco apropiado debido a que mejora la función motora, reduce la intensidad y duración de los periodos off y reduce los requerimientos de levodopa. Estudios preliminares sugieren que la cabergolina es eficaz en el tratamiento de la acinesia y la distonía nocturna en la EP avanzada. La cabergolina es bien tolerada. Los efectos colaterales se producen principalmente a nivel del sistema nervioso central y del aparato digestivo. La eficacia de la cabergolina con respecto a otros agonistas dopaminérgicos en el control de los síntomas de la EP debe ser analizada en futuros estudios.
Resumen
La cabergolina (1-[(6-alelilergolin-8 beta-il)carbonil]-1-[3-(dimetilamino)propil]-3-etilurea) es un novedoso agonista de los receptores dopaminérgicos D2 para la terapia farmacológica en la enfermedad de Parkinson (EP). La cabergolina tiene una vida media larga (alrededor de 68 horas) lo que permite su administración en dosis única diaria. En base a la información disponible en monoterapia, la cabergolina induce una mejoría de los síntomas similar al proporcionado por otros agonistas dopaminérgicos. En pacientes con EP de novo, la cabergolina en monoterapia representa una opción adecuada para el tratamiento sintomático ya que mejora los síntomas motores, retrasa la aparición de complicaciones motoras por levoterapia y disminuye los requerimientos de levodopa. Como tratamiento coadyuvante a la levodopa es un fármaco apropiado debido a que mejora la función motora, reduce la intensidad y duración de los periodos off y reduce los requerimientos de levodopa. Estudios preliminares sugieren que la cabergolina es eficaz en el tratamiento de la acinesia y la distonía nocturna en la EP avanzada. La cabergolina es bien tolerada. Los efectos colaterales se producen principalmente a nivel del sistema nervioso central y del aparato digestivo. La eficacia de la cabergolina con respecto a otros agonistas dopaminérgicos en el control de los síntomas de la EP debe ser analizada en futuros estudios.
 Palabras clave
Cabergolina, enfermedad de Parkinson, agonistas dopaminérgicos
Clasificación en siicsalud
Palabras clave
Cabergolina, enfermedad de Parkinson, agonistas dopaminérgicos
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/71970
Especialidades
 Principal: Neurología,
Principal: Neurología,
 Relacionadas: Farmacología, Medicina Farmacéutica, Medicina Interna,
Relacionadas: Farmacología, Medicina Farmacéutica, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Pau Pastor. Department of Psychiatry and Genetics, Washington University School of Medicine Campus Box 8134, 660 South Euclid Avenue, St. Louis, Missouri 63110. EE.UU.
CABERGOLINE USED IN THE TREATMENT OF PARKINSON’S DISEASE
 Abstract
Abstract
Cabergoline (1-[(6-allelylergolin-8 beta-yl)carbonyl]-1-[3-(dimethylamino)propyl]-3-ethyl-urea) is a new agonist of the D2 dopaminergic receptors used in the treatment of Parkinson’s disease. Cabergoline is characterized by unique pharmacologic properties, such as its long plasma half-life (about 68 hours), which allows for once a day administration. Cabergoline is well tolerated, as has been shown in several clinical trials. Based on the information available, we suggest that cabergoline produces an improvement in the symptoms of Parkinson disease similar to those produced by other dopaminergic agonists. Cabergoline monotherapy, when used in previously untreated patients, is an appropriate option for the symptomatic treatment of Parkinson disease. Cabergoline improves motor symptoms, delays the presentation of levodopa-induced motor complications, and diminishes the amount of levodopa required for the control of the symptoms. We suggest that cabergoline is an adequate adjuvant treatment for Parkinson disease. There is improvement in motor symptoms (without substantially increased dyskinesias), reduced severity and duration of the wearing-off period, and diminished need for levodopa. Cabergoline can also be useful in the treatment of sleep disturbances associated with advanced Parkinson disease such as nocturnal akynesia and dystonia. However, additional studies on cabergoline’s effects in nocturnal disturbances associated with Parkinson disease are still required. Cabergoline is a well tolerated drug. Its side effects are seen mainly in the digestive and nervous system (central and peripheral). The efficacy of cabergoline in comparison to other dopaminergic agonists should be tested in future clinical studies.
 Key words
Key words
Cabergoline, Parkinson disease, dopaminergic agonists
LA CABERGOLINA EN EL TRATAMIENTO DE LA ENFERMEDAD DE PARKINSON
(especial para SIIC © Derechos reservados)
Artículo completo
El tratamiento farmacológico actual de la enfermedad de Parkinson (EP) consiste en restablecer la transmisión dopaminérgica de la vía nigroestriada. La levodopa demostró ser un fármaco efectivo en el control de los síntomas. Sin embargo, su uso es limitado, por una moderada pérdida de eficacia a largo plazo y por la aparición de fluctuaciones motoras (disminución del efecto de la levodopa y los fenómenos on-off), discinesias y alteraciones neuropsiquiátricas. Se postula que las complicaciones motoras por levodopa se relacionan con factores periféricos que modifican la concentración plasmática de dopamina y con factores centrales que impiden el almacenamiento de dopamina.
La otra línea de tratamiento en la EP son los agonistas dopaminérgicos (AD) que actúan directamente sobre los receptores postsinápticos D2. Han sido utilizados como terapia adyuvante de la levodopa, y como tratamiento de las fluctuaciones motoras asociadas al tratamiento prologado con levodopa. Recientemente se han empleado en monoterapia o, preferentemente, en combinación con levodopa en la EP de reciente comienzo.
Los AD poseen algunas ventajas sobre la levodopa,1 a saber: a) estimulan directamente los receptores postsinápticos dopaminérgicos independientemente del número de neuronas nigroestriadas degeneradas; b) no requieren la conversión previa en metabolitos activos por enzimas como las descarboxilasas, cuya actividad disminuye con la edad; c) no producen metabolitos tóxicos; d) no generan radicales libres ni inducen el estrés oxidativo.
Actualmente disponemos de AD ergóticos (bromocriptina, lisuride, pergolida y cabergolina) y no ergóticos (ropirinol y pramipexol), que se distinguen por el perfil farmacológico y por la distinta afinidad hacia los diversos receptores dopaminérgicos.
La cabergolina es un agonista de los receptores dopaminérgicos D2 que posee una propiedad farmacocinética distintiva: tener una vida media de más de 65 horas,2 que le confiere la capacidad teórica de producir una estimulación dopaminérgica continua. Esto justifica que pueda administrarse en dosis diarias únicas. Ensayos clínicos recientes demostraron su eficacia en el tratamiento de la EP inicial, durante un período de tiempo superior a un año, siendo sólo menos eficaz que la levodopa.3 Se evaluó también la eficacia de la cabergolina como terapia coadyuvante de la levodopa en pacientes con EP.
Perfil básico
Farmacodinamia
La cabergolina (1-[(6-alilergolin-8beta-il)carbonil]-1-[3-(dimetilamino)propil]-3-etilurea) (Figura 1) tiene elevada afinidad por los receptores dopaminérgicos D2. La unión de la cabergolina con los receptores dopaminérgicos es detectable 72 horas después de la administración en adenohipófisis y en núcleo estriado.4 Además, la cabergolina tiene moderada afinidad por los receptores alfa2 y serotoninérgicos 5HT1, y afinidad mínima por los receptores alfa1 y 5HT2. La cabergolina fue utilizada inicialmente como un fármaco inhibidor de la lactancia, por su potente efecto supresor de la prolactina. La actividad central de la cabergolina como AD se demostró en animales con previa depleción estriatal de dopamina.5 La cabergolina produce discinesias transitorias y un efecto antiparkinsoniano sostenido en monos parkinsonizados.6

Farmacocinética
La absorción de la cabergolina no parece modificarse por la comida. La concentración máxima plasmática puede observarse tras 1 o 2 horas de la administración. La cabergolina es extensamente metabolizada en el hígado. Tras la administración oral sólo se recupera 14% a 20% de fármaco no metabolizado en orina.2,7 Este agonista se elimina predominantemente en las heces, pues el 72% de la dosis administrada se recupera en las siguientes 240 horas.2,7 La vida media de eliminación plasmática es de 63 a 68 horas.
Eficacia clínica: estudios comparativos de cabergolina
En la mayoría de los ensayos clínicos realizados con cabergolina se valoró su efecto como tratamiento adyuvante en pacientes con EP avanzada y con fluctuaciones motoras secundarias a levoterapia prolongada. Los datos sobre el uso de cabergolina en monoterapia son limitados. La evaluación de la eficacia del fármaco o placebo se ha realizado mediante escalas sobre los síntomas parkinsonianos (rigidez, bradicinesia, pérdida de movimientos asociados y temblor), actividades de la vida diaria (AVD), y la escala UPDRS (Unified Parkinson’s Disease Rating Scale)8 que incluye, además de la evaluación motora, la valoración del estado mental y la evaluación de complicaciones motoras secundarias a la levodopa. Otra medida indirecta de la eficacia de la cabergolina es la dosis de levodopa requerida por los pacientes para el control de los síntomas.
Enfermedad de Parkinson avanzada
Disponemos de estudios comparativos pequeños que valoran el efecto de la cabergolina en el control de los síntomas en la EP avanzada.9 Dichos estudios comparan el efecto de la cabergolina con placebo,10,11 bromocriptina12 o pergolida.13 Además, disponemos de estudios fase III en los que se evalúa el efecto de la cabergolina en comparación con placebo14,15 o bromocriptina.16-18 Sólo dos de los estudios de fase III se publicaron totalmente,14,17 y los datos adicionales de dos estudios más16,18 se publicaron conjuntamente en una revisión.19 Los pacientes seleccionados fueron mantenidos con dosis estables de levodopa junto con un inhibidor periférico de la enzima dopa-descarboxilasa durante el mes previo al estudio y presentaban deterioro de fin de dosis. La reducción de la dosis de levodopa fue permitida durante el trascurso del ensayo.
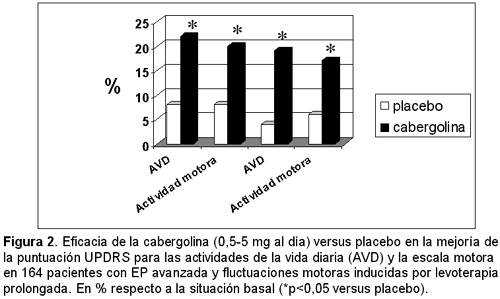
Comparación de la eficacia de cabergolina con placebo Los estudios de Musch15 y Hutton,14 incluyeron 188 y 218 pacientes, respectivamente, en un régimen subóptimo estable de levodopa y con deterioro de fin de dosis. Ambos estudios mostraron un efecto significativo de la cabergolina sobre la gravedad de los síntomas y sobre el porcentaje del tiempo en off. A los 6 meses se confirmó que la cabergolina añadida al tratamiento con levodopa/carbidopa es beneficiosa en pacientes con EP avanzada y con fluctuaciones motoras. Además, se vio una mejoría significativa en la puntuación de la UPDRS y la función motora de la AVD en los pacientes que recibieron cabergolina, tras 12 y 24 semanas de tratamiento, siendo menores los requerimientos de levodopa tras 24 meses en los pacientes que tomaban cabergolina, en comparación con el grupo placebo (p < 0.001)14 (Figura 2). Musch y col. observaron una disminución media de los requerimientos de levodopa de 80 mg del grupo de cabergolina en comparación con el grupo placebo.15
Comparación de la eficacia de la cabergolina con otros AD
Bromocriptina: La administración de cabergolina en una dosis única diaria, de hasta 6 mg/día,16 produjo mejorías en la escala motora de la UPDRS similares o mayores que la de la bromocriptina administrada tres veces al día, ya que se redujo el tiempo off en un 63% y al 55% con cabergolina y bromocriptina, respectivamente, en referencia al nivel basal.
Un estudio a doble ciego, aleatorizado y paralelo de 9 meses de duración comparó la eficacia de la cabergolina con la de la bromocriptina en pacientes (n = 44) con fluctuaciones motoras.12 La cabergolina (3.18 mg/día) y la bromocriptina (22 mg/día) produjeron un efecto comparable en la mayoría de las escalas utilizadas.
Pergolida: En un estudio cruzado, realizado en 44 pacientes, ambos fármacos, 6 mg/día de cabergolina tuvieron una eficacia similar a 15 mg/día de pergolida en términos de mejoría de la parte motora de la escala UPDRS (p < 0.001 en comparación con la línea de base). La mejoría de la UPDRS durante los períodos off fue más significativa con cabergolina que con pergolida13 (véase Tabla 1).

Efecto de la cabergolina en el retraso de complicaciones motoras en la EP
Un estudio controlado mencionado previamente20 valoró el efecto en el retraso de las complicaciones motoras de la EP. Después de 5 años de seguimiento, el riesgo de complicaciones motoras fue significativamente menor en el grupo de pacientes con cabergolina (22%) que en el grupo en monoterapia con levodopa (34%; p < 0.05)20,21 (Figura 3).

Efecto de la cabergolina en el tratamiento de las alteraciones nocturnas de la EP
Varios estudios abiertos encontraron un efecto positivo de la cabergolina en las molestias nocturnas de la EP.22-25 En uno de ellos22 se compararon dos grupos de pacientes. A 25 pacientes se les administró una dosis nocturna (18 horas) de cabergolina, y al otro, de 15 pacientes, una dosis de preparación retardada de levodopa/carbidopa. La evaluación de los síntomas nocturnos se efectuó a las 9 de la mañana del día siguiente a los 3 y 6 meses después de la fase de titulación del fármaco. La cabergolina redujo significativamente las discinesias y la distonía dolorosa nocturnas y los episodios de acinesia nocturna. Los pacientes con cabergolina refirieron una mejoría de la calidad del sueño y del estado clínico general del 88%, mientras que la mejoría en el grupo de levodopa retardada fue del 27%. Otro estudio abierto que incluyó 33 pacientes con cabergolina (dosis media: 2.6 mg/día) y 28 con pergolida (dosis de inicio: 2 mg/día), mostró que la cabergolina es más eficaz en el control de los despertares nocturnos, la distonía matutina y el dolor distónico.13
EP inicial
Cabergolina en monoterapia: Se valoró la eficacia de la cabergolina (4 mg/día) comparada con levodopa en un estudio aleatorizado de 5 años en pacientes con EP de novo.3,20,26 El objetivo el estudio fue evaluar la aparición de complicaciones motoras a los 3 meses, 6 meses y a los 5 años de seguimiento (Tabla 2). Se excluyeron todos los pacientes que habían recibido tratamiento previo, excepto los pacientes que recibieron amantadina o anticolinérgicos, a quienes se les discontinúo el tratamiento cuatro semanas antes de ser incluidos en el estudio. Se añadió levodopa abiertamente a ambos grupos cuando la disminución de la función motora evaluada mediante la escala UPDRS fue menor del 30% que la función motora basal. La cabergolina (con levodopa o sin ella) fue tan efectiva como la levodopa sola durante el primer año de tratamiento (81% versus 87%, respectivamente, experimentaron una mejoría mayor del 30% de la función motora de la UPDRS). Sin embargo, hubo una disminución gradual de la mejoría en la UPDRS que fue observado en mejoría a los 5 años en el 46% del grupo de cabergolina (con levodopa o sin ella) y del 68% del grupo de levodopa sola. Las puntuaciones en la media de la escala motora de la UPDRS fueron significativamente más bajas en el grupo de levodopa sola que en el grupo de cabergolina (con levodopa o sin ella). En la escala de las AVD de la UPDRS los dos grupos mejoraron de manera similar durante el primer año con un decremento de la mejoría diferente entre los dos grupos (p < 0.05). Con el paso del tiempo, 64% de los pacientes del grupo de cabergolina requirieron suplementos con levodopa, en comparación con el 46% de los pacientes en el grupo de levodopa sola (p < 0.0001). Los suplementos acumulativos de levodopa fueron menores en el grupo de cabergolina que en el de levodopa (304 versus 761 gramos por paciente). Al final del estudio no hubo diferencias significativas en la gravedad de la enfermedad entre los pacientes que necesitaron suplementos de levodopa y los pacientes que permanecieron con cabergolina sola. Otro aspecto interesante de este estudio fue que el grupo de cabergolina (con levodopa o sin ella) presentó menor incidencia de complicaciones motoras (deterioro de fin de dosis y discinesias) que el grupo con levodopa sola (22% versus 34%; p < 0.05). El riesgo acumulado de desarrollar discinesias fue significativamente más bajo en pacientes con cabergolina (con o sin levodopa) en comparación con el grupo con levodopa (p < 0.001). En los pacientes que permanecieron con monoterapia sin levodopa adicional las complicaciones motoras fueron más frecuentes en el grupo de levodopa que en el de cabergolina (15.5% versus 5.3%). Las complicaciones motoras en los pacientes que requirieron suplementos de levodopa fueron menos frecuentes en el grupo de cabergolina que en el de levodopa (31.9% versus 54.1%).

Tolerabilidad y seguridad
El perfil de tolerabilidad de la cabergolina en pacientes con EP, evaluado a partir de ensayos clínicos publicados hasta la fecha, parece similar al de otros AD.27-30 Los efectos colaterales de la cabergolina son generalmente transitorios, de leve o moderada intensidad y desaparecen con la disminución de la dosis o bien con la interrupción de la cabergolina. Las alteraciones en el sistema nervioso central son principalmente: alucinaciones visuales, confusión, aumento de la libido, discinesias, mareo, insomnio y somnolencia. Otros efectos relacionados con afección periférica son: hipotensión ortostática, náuseas, vómitos, malestar gástrico, sequedad de boca, edemas maleolares y fallo cardíaco. La retirada de la medicación debida a efectos adversos graves fue necesaria en < 9% de los pacientes que recibieron cabergolina en dosis de 0.5-5 mg/día. Estos efectos adversos fueron: confusión, hipotensión, fallo cardíaco y angina de pecho.3 En un estudio de 208 pacientes, 16 (7.7%) abandonaron el tratamiento con cabergolina a causa de efectos adversos intolerables3 (Tabla 3).

En un estudio aleatorizado y a doble ciego, en el que se incluyeron 188 pacientes con EP avanzada y con fluctuaciones motoras asociadas al tratamiento con levodopa,14 la incidencia de efectos adversos en los pacientes que recibieron cabergolina fue similar a la del grupo placebo. Sin embargo, la incidencia de hipotensión postural fue significativamente mayor en los pacientes que recibieron cabergolina. En el estudio comparativo cabergolina versus levodopa en pacientes con enfermedad en fase inicial,3 la incidencia de acontecimientos adversos fue mayor en el grupo con cabergolina que en el grupo con levodopa (76% versus 66%). La tasa de retirada por acontecimientos adversos intolerables fue de 7.7% en los pacientes que recibieron cabergolina y de 5.4% en los que recibieron levodopa/carbidopa.
En un estudio retrospectivo que incluyó 299 pacientes con cabergolina31 que valoró la tolerabilidad tras un seguimiento de 6 meses, sólo 54 pacientes interrumpieron el tratamiento con cabergolina, 7 por falta de eficacia y 7 por la presencia de alucinaciones. En un metaanálisis de ensayos clínicos con pacientes (n = 1 069) con EP que recibieron levodopa, la incidencia de efectos colaterales en el grupo de pacientes que recibieron tratamiento coadyuvante con cabergolina (74%) fue similar a los que recibieron placebo (68%) o tratamiento con bromocriptina (74%).32
Un estudio multicéntrico retrospectivo mostró que la cabergolina en monoterapia o como adyuvante de la levoterapia fue bien tolerada en pacientes ancianos (n = 102; intervalo de edad 65-75 años) y en los pacientes de avanzada edad (n = 60; edad > 75 años).33
Se publicaron casos de somnolencia diurna excesiva asociada al tratamiento con cabergolina administrada en monoterapia o juntamente con levodopa.34-38 Aunque los casos de somnolencia diurna excesiva o los ataques de sueño son limitados. Un estudio alemán35 registró ataques de sueño en 6.2% con signos de alarma o sin ellos en los pacientes que recibían cabergolina (dosis media: 4.2 mg/día; n = 401). En 3% de los pacientes los ataques de sueño no fueron precedidos de signos de alarma. La frecuencia de ataques de sueño sin signos de alarma en pacientes tratados con distintos AD como ropinirol (dosis media: 7.0 mg/día) y pramiprexol (dosis media: 2.0 mg/día) fue de 5.4% y 5.6%, respectivamente. Según un estudio abierto de tres meses de duración en nueve enfermos con EP37 el cambio de otros AD, como ropinirol, pramiprexol o pergolida, a carbergolina en monoterapia (4.7 mg/día administrados antes del descanso nocturno) resultó en una reducción del 70% de la somnolencia diurna.
Se han descrito casos aislados de fibrosis pleuropulmonar y otras reacciones fibróticas inflamatorias en pacientes con EP, ya conocidas para otros AD ergóticos.39-42 En una revisión reciente de las bases de datos International Drug Monitoring Uppsala Database y Medline se observó mayor incidencia de reacciones fibróticas producidas por la pergolida en comparación con la cabergolina (131 versus 13 reacciones fibróticas, respectivamente).43
Los datos de los estudios disponibles sugieren que la prescripción de cabergolina conlleva un riesgo aceptable. Este riesgo es similar al de los otros AD utilizados en EP.44 La Medicine Control Agency Data sugiere que antes de iniciar tratamiento con cualquier derivado ergótico es apropiado realizar un estudio basal del paciente que consista en VSG, urea, perfil iónico, radiografía de tórax y una prueba de función pulmonar.45
La cabergolina se debe utilizar con cautela en pacientes con historia o síntomas clínicos de trastornos del tejido conectivo, con fibrosis pulmonar, enfermedad cardiovascular grave, insuficiencia hepática, síndrome de Raynaud, ulcus péptico o historia de enfermedad psicótica. La hipotensión ortostática es más frecuente si la cabergolina se asocia concomitantemente a otros fármacos hipotensores. La cabergolina no debe administrarse junto con macrólidos.
Dosis y administración
Las recomendaciones para el inicio del tratamiento y el ajuste de la medicación varían, sin embargo, según los distintos países. El tratamiento con cabergolina en monoterapia se inicia con 0.5 mg/día y la dosis se incrementa semanalmente 0.5 mg hasta 2 a 6 mg/día, dependiendo de la respuesta terapéutica.36 Se pueden observar mejorías modestas en los signos parkinsonianos con una dosis de 0.5 mg/día, pero para obtener un efecto más importante sobre los síntomas se requieren dosis mayores.
En pacientes con levoterapia se recomienda reducir discretamente la dosis de levodopa/carbidopa, mientras se incrementa la de cabergolina, hasta obtener una respuesta favorable. La dosis recomendada en pacientes con levodopa es de 2 a 6 mg/día, aunque una dosis de cabergolina de hasta 3 mg/día puede ser suficiente.46 Especialmente en los pacientes con síntomas nocturnos, se recomienda administrar 2 a 4 mg/día de cabergolina en dosis única vespertina.47
En pacientes que necesiten un cambio de AD las equivalencias recomendadas son 3.8/1 para bromocriptina/cabergolina, 0.5-1/1 para lisuride/cabergolina, 0.7-1/1 para pergolida/cabergolina, 1-1.5/1 para pramipexol/cabergolina y 1.6-4/1 para ropinirol/cabergolina.46,47
Papel de la cabergolina en el manejo de la enfermedad de Parkinson
Enfermedad de Parkinson de novo
El uso de AD como tratamiento de primera línea en la EP inicial recibió renovada atención en los últimos años.48,49 Algunos investigadores piensan que el uso inicial de AD, sobre todo en la EP de inicio precoz, reduce y retrasa la aparición de las complicaciones motoras secundarias a levodopa.21 Dado que, potencialmente, los pacientes jóvenes tienen riesgo más elevado de presentar complicaciones motoras a lo largo de la enfermedad, la terapia inicial con un AD en estos casos debe ser considerada como de elección, ya que a menudo permite un adecuado control de los síntomas.50 Sin embargo, se requieren más estudios para valorar las ventajas a largo plazo de la administración de AD en la EP inicial. La cabergolina en la EP de novo es al menos tan eficaz como los otros AD empleados como el ropinirol, la pergolida o el pramipexol.
Considerando el tratamiento en monoterapia de la EP que requiera tratamiento y ajustándonos a las recomendaciones de la Academia Neurológica Norteamericana (AAN) podemos concluir que levodopa, cabergolina, ropirinol y pramiprexol son efectivos en la mejora de los síntomas motores y actividad diaria de la EP. Sin embargo, la levodopa es más efectiva que la cabergolina, ropirinol y pramiprexol para el tratamiento de los síntomas de la EP.51
Enfermedad de Parkinson avanzada
La cabergolina mejora el control de los síntomas en pacientes con EP avanzada que recibieron tratamiento prolongado con levodopa/carbidopa. Esta mejoría se refleja en una mejor función motora con reducción en las puntuaciones de la escalas motoras (UPDRS) en los periodos on y off, reducción del tiempo en off y mejoras en las escalas funcionales de AVD. La terapia coadyuvante con cabergolina reduce los requerimientos de levodopa/carbidopa para el control de los síntomas.
Varios estudios muestran que la cabergolina es al menos tan efectiva como la bromocriptina en el tratamiento sintomático de la EP. Los datos comparativos de la cabergolina con otros AD en EP avanzada y con fluctuaciones motoras son limitados.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Stocchi F. Dopamine agonists in Parkinson’s disease: what is their role in early treatment CNS Drugs 1998;10:159-170.
- Cocchiara G, Benedetti MS. Excretion balance and urinary metabolic pattern of [3H]cabergoline in man. Drug Metabol Drug Interact 1992;10(3):199-211.
- Rinne UK, Bracco F, Chouza C, Dupont E, Gershanik O, Marti Masso JF, et al. Cabergoline in the treatment of early Parkinson’s disease: results of the first year of treatment in a double-blind comparison of cabergoline and levodopa. The PKDS009 Collaborative Study Group. Neurology 1997;48(2):363-8.
- Benedetti MS, Dostert P, Barone D, Efthymiopoulos C, Peretti G, Roncucci R. In vivo interaction of cabergoline with rat brain dopamine receptors labelled with [3H]N-n-propylnorapomorphine. Eur J Pharmacol 1990;187(3):399-408.
- Fariello RG. Pharmacodynamic and pharmacokinetic features of cabergoline. Rationale for use in Parkinson’s disease. Drugs 1998;55 Suppl 1:10-6.
- Grondin R, Goulet M, Di Paolo T, Bedard PJ. Cabergoline, a long-acting dopamine D2-like receptor agonist, produces a sustained antiparkinsonian effect with transient dyskinesias in parkinsonian drug-naive primates. Brain Res 1996;735(2):298-306.
- Battaglia R, Strolin Benedetti M, Mantegani S, Castelli MG, Cocchiara G, Dostert P. Disposition and urinary metabolic pattern of cabergoline, a potent dopaminergic agonist, in rat, monkey and man. Xenobiotica 1993;23(12):1377-89.
- Fahn S, Elton RL, Committee MotUD. Unified Parkinson’s disease Rating Scale. In: Fahn S, Marsden CD, Calne DB, et al., editors. Recent developments in Parkinson’s disease. Vol 2. Florham Park (NJ). MacMillan Healthcare information 1987:153-163.
- Curran MP, Perry CM. Cabergoline: a review of its use in the treatment of Parkinson’s disease. Drugs 2004;64(18):2125-41.
- Steiger MJ, El-Debas T, Anderson T, Findley LJ, Marsden CD. Double-blind study of the activity and tolerability of cabergoline versus placebo in parkinsonians with motor fluctuations. J Neurol 1996;243(1):68-72.
- Ahlskog JE, Wright KF, Muenter MD, Adler CH. Adjunctive cabergoline therapy of Parkinson’s disease: comparison with placebo and assessment of dose responses and duration of effect. Clin Neuropharmacol 1996;19(3):202-12.
- Inzelberg R, Nisipeanu P, Rabey JM, Orlov E, Catz T, Kippervasser S, et al. Double-blind comparison of cabergoline and bromocriptine in Parkinson’s disease patients with motor fluctuations. Neurology 1996;47(3):785-8.
- Ulm G, Schüler P, MODAC study group. Cabergoline versus pergolide: a video-blinded, randomized, multicenter crossover study. Aktuel Neurol 1999;25:360-365.
- Hutton JT, Koller WC, Ahlskog JE, Pahwa R, Hurtig HI, Stern MB, et al. Multicenter, placebo-controlled trial of cabergoline taken once daily in the treatment of Parkinson’s disease. Neurology 1996;46(4):1062-5.
- Musch B, Bonura L. Cabergoline once a day as adjuntive therapy to levodopa in Parkinson’s disease [abstract no.3]. Movement Disorders 2000;15(Suppl. 3):121.
- Destee A, Schneider E, Gershanik O, Dom R, Tichy J, Korczyn AD. Efficacy and tolerability of cabergoline compared to bromocriptine in patients suffering from levodopa associated motor complications. (not on treatment with DA-agents). Mov Dis 1996;11 suppl 1:269.
- Yanagisawa N, Kowa H, Mizuno Y, et al. The clinical evaluation of GC-101 (cabergoline) in Parkinson’s disease with combined use of L-DOPA: a multi-center duoble-blind comparative study vs. bromocriptine mesylate. Rinsho Iyaku 1996;12(17):3757-3798.
- Schneider E, Gershanik O, Dom R, et al. Efficacy and tolerability of cabergoline compared to bromocriptine in patients suffering from levodopa associated motor complications (on treatment with DA-agents) [abstract no. SS27]. Movement Disorders 1996;11(Suppl 1):29.
- Clarke CE, Deane KD. Cabergoline versus bromocriptine for levodopa-induced complications in Parkinson’s disease. Cochrane Database Syst Rev 2003;3.
- Rinne UK, Bracco F, Chouza C, Dupont E, Gershanik O, Marti Masso JF, et al. Early treatment of Parkinson’s disease with cabergoline delays the onset of motor complications. Results of a double-blind levodopa controlled trial. The PKDS009 Study Group. Drugs 1998;55 Suppl 1:23-30.
- Rinne UK, and the PKDS009 Collaborative Study Group. A five-year, double-blind study with cabergolina versus levodopa. Parkinsonism and Related Disorders 1999;5 (suppl):74.
- Chaudhuri KR, Bhattacharya K, Agapito C, Porter MC, Mills J, Clough C. The use of cabergoline in nocturnal parkinsonian disabilities causing sleep disruption: A parallel study with controlled release levodopa. Eur J Neurol 1999;6(suppl 5):S11-S15.
- Chaudhuri KR, Agapito C, Porter MC, et al. Cabergoline, along-acting dopamine agonist, overcomes levodopa refractory nocturnal disabilities in Parkinson’s disease. Neurology 1999;52(Suppl. 2):263.
- Ghatani T, Agapito C, Bhattacharya KF, et al. Comparative audit of pergolide and cabergoline therapy in the treatment of nocturnal "off" periods causing sleep disruption in Parkinson’s disease. European Journal of Neurology 2001;8(Suppl. 1):8-11.
- Hogl B, Rothdach A, Wetter TC, Trenkwalder C. The effect of cabergoline on sleep, periodic leg movements in sleep, and early morning motor function in patients with Parkinson’s disease. Neuropsychopharmacology 2003;28(10):1866-70.
- Bracco F, Battaglia A, Chouza C, Dupont E, Gershanik O, Marti Masso JF, et al. The long-acting dopamine receptor agonist cabergoline in early Parkinson’s disease: final results of a 5-year, double-blind, levodopa-controlled study. CNS Drugs 2004;18(11):733-46.
- Lera G, Vaamonde J, Rodriguez M, Obeso JA. Cabergoline in Parkinson’s disease: long-term follow-up. Neurology 1993;43(12):2587-90.
- Jori MC, Franceschi M, Giusti MC, Canal N, Piolti R, Frattola L, et al. Clinical experience with cabergoline, a new ergoline derivative, in the treatment of Parkinson’s disease. Adv Neurol 1990;53:539-43.
- Hutton JT, Morris JL, Brewer MA. Controlled study of the antiparkinsonian activity and tolerability of cabergoline. Neurology 1993;43(3 Pt 1):613-6.
- Lieberman A, Imke S, Muenter M, Wheeler K, Ahlskog JE, Matsumoto JY, et al. Multicenter study of cabergoline, a long-acting dopamine receptor agonist, in Parkinson’s disease patients with fluctuating responses to levodopa/carbidopa. Neurology 1993;43(10):1981-4.
- Appiah-Kubi L, Nisbet A, Burn DJ, Ray CK. Cabergoline monotherapy in clinical practice: A two year observational study of tolerability and efficacy in young, old and very elderly patients with Parkinson’s disease. J Neurol Neurosurg Psychiatry 2002;73:231.
- Marsden CD. Clinical experience with cabergoline in patients with advanced Parkinson’s disease treated with levodopa. Drugs 1998;55 Suppl 1:17-22.
- Forbes A, Brechany U, Stegie F. Use and tolerability of cabergoline in young and older people with Parkinson’s disease: a multi-center observational study. J Appl Res 2003;3(4):356-362.
- Pal S, Bhattacharya KF, Agapito C, Chaudhuri KR. A study of excessive daytime sleepiness and its clinical significance in three groups of Parkinson’s disease patients taking pramipexole, cabergoline and levodopa mono and combination therapy. J Neural Transm 2001;108(1):71-7.
- Paus S, Brecht HM, Koster J, Seeger G, Klockgether T, Wullner U. Sleep attacks, daytime sleepiness, and dopamine agonists in Parkinson's disease. Mov Disord 2003;18(6):659-67.
- Pharmacia. Cabser tablets 1 mg [UK prescribing information]. Pharmacia: Milton Keynes 2003.
- Del Dotto P, Gambaccini G, Caneparo D, Berti C, Bernardini S, Bonuccelli U. Bedtime cabergoline in Parkinson’s disease patients with excessive daytime sleepiness induced by dopamine agonists. Neurol Sci 2003;24(3):170-1.
- Ferreira JJ, Pona N, Costa J, et al. Somnolence as an adverse drug reaction od antiparkinsonian drugs: a meta-analysis of published randomised placebo-controlled trials [abstrac no. P659]. Movement Disorders 2000;15(Suppl. 3):128.
- Bhatt MH, Keenan SP, Fleetham JA, Calne DB. Pleuropulmonary disease associated with dopamine agonist therapy. Ann Neurol 1991;30(4):613-6.
- Frans E, Dom R, Demedts M. Pleuropulmonary changes during treatment of Parkinson’s disease with a long-acting ergot derivative, cabergoline. Eur Respir J 1992;5(2):263-5.
- Ling LH, Ahlskog JE, Munger TM, Limper AH, Oh JK. Constrictive pericarditis and pleuropulmonary disease linked to ergot dopamine agonist therapy (cabergoline) for Parkinson’s disease. Mayo Clin Proc 1999;74(4):371-5.
- Townsend M, MacIver DH. Constrictive pericarditis and pleuropulmonary fibrosis secondary to cabergoline treatment for Parkinson’s disease. Heart 2004;90(8):e47.
- Muller T, Fritze J. Fibrosis Associated With Dopamine Agonist Therapy in Parkinson’s Disease. Clinical Neuropharmacology 2003;26(3):109-111.
- DA agonists – Ergot derivatives: Cabergoline: Management of Parkinson's disease. Mov Disord 2002;17 Suppl 4:S68-71.
- Agency MC. Committee on Safety of Medicines. Current Problems in Pharmacovigilance 2002;28.
- Baas HK, Schueler P. Efficacy of cabergoline in long-term use: results of three observational studies in 1,500 patients with Parkinson’s disease. Eur Neurol 2001;46 Suppl 1:18-23.
- Porter MC, Appiah-Kubf LS, Chaudhuri KR. Treatment of Parkinson’s disease and restless legs syndrome with cabergoline, a long-acting dopamine agonist. Int J Clin Pract 2002;56(6):468-74.
- Olanow CW, Koller WC. An algorithm (decision tree) for the management of Parkinson’s disease: treatment guidelines.American Academy of Neurology. Neurology 1998;50(3 Suppl 3):S1-57.
- Lees AJ, Stern GM. Sustained bromocriptine therapy in previously untreated patients with Parkinson’s disease. J Neurol Neurosurg Psychiatry 1981;44(11):1020-3.
- Hubble JP. Long-term studies of dopamine agonists. Neurology 2002;58(4 Suppl 1):S42-50.
- Miyasaki JM, Martin W, Suchowersky O, Weiner WJ, Lang AE. Practice parameter: initiation of treatment for Parkinson’s disease: an evidence-based review: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2002;58(1):11-7.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:




