ENFERMEDAD DE CHAGAS: LOS RECEPTORES SOLUBLES COMO REGULADORES DE LA ACTIVIDAD BIOLOGICA DEL FACTOR DE NECROSIS TUMORAL
(especial para SIIC © Derechos reservados)
Coautor
Beatriz Basso*
Dra. en Bioquímica, Especialista en MicrobiologíaProfesora Adjunta, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba y Jefa del Laboratorio de Parasitología, Departamento de Diagnóstico y*
Recepción del artículo: 6 de diciembre, 2004
Aprobación: 30 de diciembre, 2004
 Conclusión breve
El equilibrio entre el factor de necrosis tumoral alfa y las formas solubles de sus receptores parece desempeñar un papel importante en la resolución de la infección.
Conclusión breve
El equilibrio entre el factor de necrosis tumoral alfa y las formas solubles de sus receptores parece desempeñar un papel importante en la resolución de la infección.
 Resumen
El factor de necrosis tumoral alfa (TNFα) actúa sobre las células blanco a través de sus receptores TNFR1 (o p55) y TNFR2 (p75), cuyas formas solubles (TNFRs) son capaces de unirse al TNFα con alta afinidad. En este trabajo se efectúa una breve revisión acerca del posible papel del equilibrio TNFα/TNFRs en la enfermedad de Chagas experimental, y se presentan los resultados de un estudio en niños chagásicos. En el modelo experimental, los ratones susceptibles a la infección por T. cruzi tuvieron, en el período agudo, valores séricos de TNFα, medidos por ELISA, marcadamente aumentados respecto de ratones resistentes. En cambio estos últimos mostraron un gran exceso de receptor libre, determinado por la relación molar p55/TNF y p75/TNF. En animales infectados y tratados con benznidazol, el perfil fue idéntico al de ratones no infectados. En niños chagásicos se observó un discreto incremento de TNFα, en tanto ambos receptores estuvieron significativamente elevados, así como la relación p55/TNF y p75/TNF. Estos resultados sugieren que en enfermedad de Chagas experimental y humana, el equilibrio entre TNFα y TNFRs puede tener un papel importante en la resolución de la infección, posiblemente por neutralización de los efectos deletéreos del TNFα a nivel sistémico mediada por sus receptores solubles.
Resumen
El factor de necrosis tumoral alfa (TNFα) actúa sobre las células blanco a través de sus receptores TNFR1 (o p55) y TNFR2 (p75), cuyas formas solubles (TNFRs) son capaces de unirse al TNFα con alta afinidad. En este trabajo se efectúa una breve revisión acerca del posible papel del equilibrio TNFα/TNFRs en la enfermedad de Chagas experimental, y se presentan los resultados de un estudio en niños chagásicos. En el modelo experimental, los ratones susceptibles a la infección por T. cruzi tuvieron, en el período agudo, valores séricos de TNFα, medidos por ELISA, marcadamente aumentados respecto de ratones resistentes. En cambio estos últimos mostraron un gran exceso de receptor libre, determinado por la relación molar p55/TNF y p75/TNF. En animales infectados y tratados con benznidazol, el perfil fue idéntico al de ratones no infectados. En niños chagásicos se observó un discreto incremento de TNFα, en tanto ambos receptores estuvieron significativamente elevados, así como la relación p55/TNF y p75/TNF. Estos resultados sugieren que en enfermedad de Chagas experimental y humana, el equilibrio entre TNFα y TNFRs puede tener un papel importante en la resolución de la infección, posiblemente por neutralización de los efectos deletéreos del TNFα a nivel sistémico mediada por sus receptores solubles.
 Palabras clave
Enfermedad de Chagas, Tripanosoma cruzi, factor de necrosis tumoral, receptores solubles, citoquinas
Clasificación en siicsalud
Palabras clave
Enfermedad de Chagas, Tripanosoma cruzi, factor de necrosis tumoral, receptores solubles, citoquinas
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/71432
Especialidades
 Principal: Infectología,
Principal: Infectología,
 Relacionadas: Farmacología, Inmunología, Medicina Interna,
Relacionadas: Farmacología, Inmunología, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Edgardo Moretti. Güemes 383, 5000 Córdoba, Argentina.
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Agradecimientos: Los autores agradecen al Dr. Gustavo Barbieri, Director del Centro de Chagas y Patología Regional de Santiago del Estero, por la selección y envío de los sueros de pacientes agudos, a la Dra. Irma Castro, Jefa del Departamento de Diagnóstico y Tratamiento del Servicio Nacional de Chagas, por su permanente apoyo y sugerencias, al Dr. Yves Carlier, Director del Laboratoire de Parasitologie, Faculte de Medecine, Universite Libre de Bruxelles, Bruselas, Bélgica, por sus sugerencias y la gentileza de facilitarnos los reactivos para dosaje de receptores en suero de ratones, y a la Sra. Patricia Gil, Técnica de Laboratorio del Servicio Nacional de Chagas. Los trabajos citados fueron realizados con fondos provenientes del Servicio Nacional de Chagas, de la Universidad Nacional de Córdoba y del Consejo de Investigaciones de la Provincia de Córdoba.
CHAGAS’ DISEASE: SOLUBLE TNFα RECEPTORS IN THE REGULATION OF TNFα BIOLOGICAL ACTIVITY
 Abstract
Abstract
TNFα provided signals to the target cells through two receptors TNFR1 (p55) and TNFR2 (p75), whose soluble forms (sTNFR) can bind TNFα with high affinity. The present report briefly reviews the role of the balance TNFα/sTNFR in experimental Chagas’ disease and shows the results of a study in chagasic children. In the experimental model, mice susceptible to T. cruzi infection showed, in the acute period, serum levels of TNFα, measured through ELISA technique, dramatically increased when compared with resistant mice. Otherwise, resistant mice showed a great excess of soluble receptors, as measured by the ratio p55/TNF and p75/TNF. In infected and benznidazol treated mice, the patterns were identical to non infected mice. In chagasic children TNFα was slightly or moderate increased in most patients, meanwhile the levels of both, p55 and p75, were significantly elevated in infected children, as well as the ratios p55/TNF and p75/TNF. These studies suggest that, in the experimental and human Chagas’ disease, the balance among TNFα and their soluble receptors could be important in the resistance to the infection, probably by neutralization of the deleterious systemic effects of this proinflammatory cytokine.
 Key words
Key words
Chagas’ disease, Tripanosoma cruzi, tumoral necrosis factor, soluble receptors, cytokines
ENFERMEDAD DE CHAGAS: LOS RECEPTORES SOLUBLES COMO REGULADORES DE LA ACTIVIDAD BIOLOGICA DEL FACTOR DE NECROSIS TUMORAL
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Las citoquinas (CK) son moléculas clave en la iniciación, la regulación y el mantenimiento de la respuesta inmune y desempeñan un papel fundamental en la defensa contra las infecciones.1 En condiciones fisiológicas, las CK actúan a corta distancia, en forma autocrina y paracrina, y tienen una vida media breve. En cambio, cuando la producción de CK, particularmente las proinflamatorias como la interleuquina (IL) 6 y el factor de necrosis tumoral alfa (TNFα) exceden la producción local y alcanzan elevados niveles sistémicos, el mismo mecanismo que actúa como protector se transforma en deletéreo, con vasodilatación, extravasación de líquidos, hipovolemia y shock. Así, por ejemplo, es muy conocido que el TNFα, producido principalmente por macrófagos, desempeña un papel central en malaria, al inhibir el desarrollo del parásito y facilitar la fagocitosis y muerte por neutrófilos pero, en contraste, se ha observado que altos niveles séricos de TNFα se correlacionan con la gravedad de la enfermedad y que esta CK es en gran parte responsable de los síntomas de la malaria a nivel cerebral.2
El TNFα produce señales a las células blanco a través de dos receptores denominados TNFR1 (o p55) y TNFR2 (p75), presentes en virtualmente todas las células excepto los glóbulos rojos. Aun cuando los dominios extracelulares de ambos receptores son similares, sus dominios transmembrana e intracitoplasmáticos son diferentes, lo que sugiere que desencadenan distintas vías intracelulares, lo cual podría explicar el amplio rango de actividades biológicas del TNFα.3 Ambos receptores existen también en formas solubles, producidas por clivaje proteolítico de los receptores de membrana citoplasmática que se encuentran presentes en suero, orina, líquido ascítico y sinovial en condiciones normales y patológicas.4
Los receptores solubles (TNFRs) son capaces de unirse al TNFα con alta afinidad y pueden actuar como agonistas o inhibidores de la bioactividad de esta CK. En bajas concentraciones, estabilizan la estructura trimérica del TNFα, prolongando su vida media y, por lo tanto, su actividad biológica. Por el contrario, en elevadas concentraciones inhiben la bioactividad del TNFα por competición con los receptores celulares, lo cual puede tener consecuencias en la relación entre parásito y huésped.
La enfermedad de Chagas, producida por el Trypanosoma cruzi, afecta a aproximadamente 20 millones de personas en América latina. Los casos agudos tienen su mayor incidencia en niños, mientras que durante la etapa crónica la enfermedad puede producir alteraciones cardíacas o digestivas de distinta gravedad. En modelos experimentales se demostró claramente que algunas CK como interferón gamma (IFNγ), IL-2, IL-12, IL-18 desempeñan un papel importante en la defensa contra el T. cruzi durante etapas tempranas de la infección, en tanto que CK proinflamatorias pueden estar involucradas en la patogenia de la enfermedad.5-8 En la infección humana, si bien se han realizado estudios tendientes a conocer el perfil de la CK, poco es lo que se conoce acerca de su papel en las diferentes etapas de la enfermedad. En los últimos años se ha sugerido que las CK podrían desempeñar un rol en la patogenia de las lesiones de la enfermedad de Chagas crónica, sobre un sustrato de daño tisular producido por el parásito y posiblemente amplificado por la respuesta inmune autorreactiva.
En el presente trabajo efectuaremos una breve revisión acerca del posible papel desempeñado por el TNFα y sus receptores, así como del equilibrio entre ligando y receptor en la enfermedad de Chagas experimental, y presentaremos los resultados de un estudio sobre el perfil sérico de TNFα y TNFRs en niños chagásicos.
El sistema TNFα-TNFR en enfermedad de Chagas experimental
El papel del TNFα en la enfermedad de Chapas no está aun suficientemente establecido; al respecto se conocen resultados discordantes en diferentes modelos experimentales. Así, por ejemplo, Truyens y col.9 encuentran que la elevación de los niveles de TNFα en ratones infectados por T. cruzi se asocia con caquexia y mayor mortalidad; por el contrario, Lima y col.10 encuentran indicios del papel protector del TNFα en la infección aguda en ratones.
En nuestro laboratorio desarrollamos un modelo experimental,11 en el cual empleamos básicamente tres grupos de animales:
1- ratones BALB/c, susceptibles a la infección por T. cruzi;
2- ratones de la misma cepa en los cuales se indujo resistencia a la infección mediante vacunación previa;
3- ratones susceptibles a la infección, tratados con benznidazol (BNZ), droga de acción tripanomicida utilizada actualmente para la terapéutica en humanos.
En dicho modelo analizamos distintos parámetros de la inmunidad asociados a la protección conferida por la vacunación con Trypanosoma rangeli ante la infección por T. cruzi en ratones.12-16 En lo específicamente relacionado con el TNFα, como se puede observar en la Figura 1, sus concentraciones séricas sufrieron un marcado incremento en los animales susceptibles a la infección, que presentaron parasitemia elevada y una tasa de mortalidad del 100%. Por el contrario, en los ratones resistentes, en los cuales la parasitemia fue baja y sobrevivieron a la infección, los niveles de TNFα se acercaron a los valores normales. Los animales tratados con BNZ presentaron valores aun menores, comparables a los ratones sin infectar.17

Figura 1. Niveles séricos de TNFα y parasitemias (TM) en función de los días posinfección en ratones susceptibles (barras y línea oscuras) o resistentes (barras claras y línea punteada) a la infección por T. cruzi. La línea de puntos horizontal representa el intervalo de confianza del 95% obtenido con ratones sin infección; * p < 0.05 respecto de resistentes y controles, # p < 0.001 respecto de resistentes.
A su vez, los niveles plasmáticos de p55 y p75 alcanzaron valores elevados tanto en los animales susceptibles como en los resistentes, significativamente diferentes de los controles en ambos grupos. Nuevamente, los animales infectados y tratados con BNZ se comportaron igual que los ratones no infectados.
Sobre la base del conocimiento previo de que concentraciones elevadas de TNFα a nivel sistémico resultan deletéreas para los animales infectados, y de que los receptores solubles pueden actuar como antiCK,4 se calcularon las relaciones molares entre TNR y TNFα en los distintos grupos experimentales. Resultó interesante la comprobación de que los animales resistentes a la infección mostraron relaciones receptor/CK claramente superiores a las observadas en los ratones susceptibles a la infección. En la Figura 2 se ejemplifica lo observado al estudiar la relación TNFRp75/ TNFα a los 15 y 20 días luego de la infección.

Figura 2. Relaciones molares entre el receptor soluble de TNFα p75 y TNFα en función de los días p.i. en ratones susceptibles (barras oscuras) o resistentes (barras claras) a la infección por T. cruzi. * p < 0.05 respecto de susceptibles.
Nuestros resultados concuerdan con Truyens y col,18 quienes demostraron que la fase parasitémica de la infección por T. cruzi en ratones se asocia con elevados niveles de TNFα y TNFR, lo que resulta en la formacion de complejos receptor-CK y en algún grado de neutralización de la bioactividad en la CK. A su vez, Castaño Vélez y col.19 demostraron que ratones deficientes en TNFR1 tuvieron exacerbacion de la parasitemia y de la mortalidad por T. cruzi. Es interesante destacar que estos ratones mostraron una reducción en la capacidad de los fagocitos activados por IFNγ para matar al parásito, lo que sugiere que el TNFR1 podría estar involucrado en la acción parasiticida mediada por IFNγ.
El sistema TNFα-TNFR en enfermedad de Chagas humana
En nuestro laboratorio realizamos un estudio en niños que cursaban distintos períodos de la enfermedad de Chagas con el objeto de conocer el perfil sérico de los niveles de CK y de receptores solubles en la infección chagásica humana, analizar su posible utilidad como marcadores inmunológicos de la infección y de eficacia terapéutica y avanzar en el conocimiento de los mecanismos involucrados en la respuesta temprana contra el T. cruzi. Los principales resultados de dicho estudio, realizados midiendo las concentraciones mediante la técnica de ELISA, fueron la elevación del receptor soluble de IL-2 (sIL-2R) y del receptor soluble de linfocitos CD8 (sCD8) en niños con enfermedad de Chagas aguda, y su normalización tras el tratamiento con BNZ.20
En lo que respecta al TNFα, los niños con infección chagásica mostraron un comportamiento dispar, aunque con una tendencia a presentar valores más elevados que en niños de la misma edad sin la enfermedad.21 Esta tendencia, si bien fue más notoria en niños con infección aguda, también pudo observarse en niños con enfermedad de Chagas en período indeterminado (Figura 3). En concordancia con estos resultados, Ferreyra y col.22 informaron que el TNFα sérico se encuentra incrementado en pacientes con infección chagásica en período indeterminado y con miocardiopatía chagásica crónica con respecto a individuos no chagásicos. Asimismo, encontraron asociación entre el grado de disfunción ventricular y los niveles séricos de TNFα.

Figura 3. Niveles séricos de TNFα en niños con infección chagásica aguda (AGU), luego del tratamiento con benznidazol (PT), con infección en período indeterminado (ID) y en niños no chagásicos (NCh). Las líneas horizontales representan el promedio de concentración obtenido en cada uno de los grupos.
Es de interés destacar que, a semejanza de lo observado a nivel experimental, el tratamiento con BNZ se asoció a una disminución de los niveles séricos de TNFα.
Por otra parte, los niños chagásicos mostraron valores significativamente más elevados los receptores solubles de TNFα (TNFR p55 y TNFR p75) respecto de los no chagásicos (p < 0.01).23 En la Figura 4 se muestran los resultados obtenidos al medir los niveles del receptor p75. Se puede observar, asimismo, que en los niños en los cuales se analizaron los niveles de receptor soluble inmediatamente de finalizado el tratamiento con BNZ, existió una tendencia a la disminución, aunque sin llegar a normalizarse.

Figura 4. Niveles séricos del receptor soluble de TNFα p75 en niños con infección chagásica aguda (AGU), luego del tratamiento con benznidazol (PT) y en niños sin infección (NCh). Las líneas horizontales representan el promedio de concentración obtenido en cada uno de los grupos.
En la Figura 5 se puede observar que, en la infección chagásica aguda, la relación molar entre el receptor soluble p75 y el TNFα fue significativamente superior a la encontrada en niños no chagásicos. Como era de esperar, en los niños tratados, en los cuales la disminución sérica de TNFα y de TNFR siguió un curso paralelo, las relaciones molares entre ambos se conservaron elevadas. Idéntico comportamiento presentó el TNFR p55.
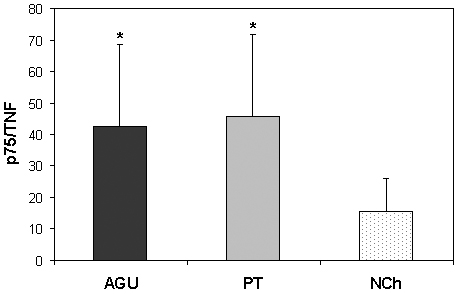
Figura 5. Relaciones molares entre el receptor soluble de TNFα p75 y TNFα en niños con infección chagásica aguda (AGU), luego del tratamiento con benznidazol (PT) y en niños sin infección (NCh). * p < 0.05 respecto del grupo controles.
Conclusiones
La defensa contra parásitos es compleja y multifactorial, con características que generalmente convierten estas infecciones en una prolongada relación entre parásito y huésped, que se traduce en enfermedades de larga evolución.24 Las CK en general y, particularmente, la vía TNFα/TNFR parece ser importante en varios pasos de esta respuesta.25 En las enfermedades producidas por protozoos como el T. cruzi los receptores solubles de TNFα están involucrados en una variedad de reacciones tales como control de la multiplicación y diferenciación, inflamación, inducción de moléculas de adhesión celular y lesiones inducidas por respuesta tisular.3
Para que la respuesta inflamatoria mediada por TNFα no sea perjudicial, la fracción biológicamente activa de dicha CK debe ser mantenida en concentraciones fisiológicas. Una de las formas de limitar la acción de TNFα es a través de la liberación de las formas solubles de sus receptores (p55 y p75), las que compiten con los receptores de membrana por la unión con el ligando.4 Una relación receptor soluble/ TNFα elevada indica que, por cada molecula de TNFα circulante existe un exceso de moléculas de receptores solubles con capacidad de neutralizarla, bloqueando su acción deletérea. Así, se vio en ciertas patologías infecciosas como la meningococcemia, que la relación entre TNFα y sus inhibidores solubles podría determinar el pronóstico de la enfermedad.26 En nuestra experiencia, tanto en el modelo experimental como en la infección humana, el exceso de los niveles de los receptores de TNFα en la etapa aguda de la infección, podría interpretarse como un mecanismo defensivo, hipótesis apoyada en que los ratones resistentes o tratados con BNZ muestran un gran exceso de receptor en comparación con los animales que mueren por la infección.
En lo que respecta a la fisiopatogenia de la cardiopatía chagásica crónica, son interesantes los hallazgos de Ferreira y col,23 quienes sugieren que es posible que el incremento en la producción de TNFα en pacientes chagásicos pueda desempñar un papel en la evolución hacia la miocardiopatía chagásica, a diferencia de otras miocardiopatías, donde el incremento del TNFα plasmático se encuentra solamente en pacientes con insuficiencia cardíaca avanzada. Por otra parte, recientes estudios de Miihdi y col.27 demuestran que, a nivel experimental, la producción placentaria y sistémica de TNFα puede jugar un papel en la mortalidad fetal inducida por T. cruzi en ratones, lo cual agrega una posible nueva línea para el estudio de los mecanismos de la transmisión congénita.
En resumen, durante la infección chagásica existe un delicado equilibrio entre CK y mediadores solubles y la alteración de dicho equilibrio puede determinar la evolución de la infección. Por ello, el mejor conocimiento acerca del papel que CK como TNFα y el equilibrio con sus receptores desempeñan en la infección por T. cruzi podría ser de utilidad en la comprensión de los mecanismos fisiopatogénicos de la enfermedad y en la búsqueda de moléculas blanco para la acción terapéutica. En este sentido, hasta el presente, la terapia con antiCK en infecciones bacterianas28 no ha tenido todo el éxito esperado, posiblemente por la complejidad de la red CK-receptores y sus acciones redundantes, pleiotrópicas, sinérgicas o antagónicas. Es por ello que no debería pensarse que una vía aislada puede resolver la enfermedad y una posible acción terapéutica debería contemplar la multiplicidad de factores involucrados. Adicionalmente, el estudio de CK, receptores solubles, moléculas de adhesión, etc, podría resultar de utilidad en la búsqueda de marcadores evolutivos y de eficacia terapéutica.
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Fresno M, Kopf M y Rivas L. Cytokines and infectious diseases. Immunol. Today 1997, 18:56-58.
- Titus R, Scherry B y Cerami A. The involvement of TNF, IL1 and IL6 in the immune response to protozoan parasites. Immunoparasitology Today. 1991, A13-A16.
- Derouich-Guergour D, Brenier-Pinchart M, Ambroise-Thomas P, Pelloux H. Tumor necrosis factor alfa receptors: role in the physiopatology of protozoan parasite infections. Int. J. Parasitol. 2001, 31:763-769.
- Olson I, Gatanaga T, Gulberg V y col. Tumor necrosis factor (TNF) binding proteins (soluble TNF receptor forms) with possible roles in inflamation and malignancy. Eur. Cytokine Netw. 1993, 4:169-180.
- Abrahamsohn I y Coffman R. Trypanosoma cruzi: IL-10, TNF, IFN-gamma, and IL-12 regulate innate and acquired immunity to infection. Exp. Parasitol. 1996, 84:231-244.
- Cervetta L, Moretti E, Basso B. Experimental Chagas disease. The protection induced by immunization with Trypanosoma rangeli is associated with down-regulation of IL-6, TNF-a and IL-10 synthesis. Acta Parasitologica. 47:73-78.
- Chandrasekar B, Melby P, Troyer D et al. (1996) Induction of proinflammatory cytokine expression in experimental acute chagasic cardiomyopathy. Biochem. Biophys. Res. Commun. 2002, 223:365-371.
- Chandrasekar B, Melby P, Troyer D et al. Temporal expression of pro-inflammatory cytokines and inducible nitric oxide synthasa in experimental acute Chagasic cardiomyopathy. Am. J. of Pathol. 1998, 152:925-934.
- Truyens C, Torrico F, Angelo-Barrios A y col. The cachexia associated with Trypanosoma cruzi acute infection in mice is attenuated by anti-TNF-a, but not by anti-IL-6 or anti-IFN-g antibodies. Parasite Immunol. 1995, 17:561-568.
- Lima S, García I, Vicentelli M y col. Evidence for a protective rol of tumor necrosis factor in the acute phase of Trypanosoma cruzi infecion in mice. Infec. Immun. 1997, 65:457-465.
- Basso B, Moretti E y Vottero-Cima E. Immune response and Trypanosoma cruzi infection in T. rangeli immunized mice. Am. J. Trop. Med. Hyg. 1991, 44:413- 419.
- Introini M V, Basso B y Moretti E. Enfermedad de Chagas experimental: Estudio de diferentes condiciones de inmunización sobre el curso de la infección. Boletín Chileno de Parasitología. 1998, 53:45-51.
- Basso B, Cervetta L y Moretti E. Experimental American trypanosomiasis: Cytokine profiles in infected and immuniced mice. Congreso Europeo de Parasitologia. EMOP VII. Parma, Italia. Abstract en Parassitologia. 1996, 38(1):191.
- Cervetta L, Basso B y Moretti E. Variación en los niveles de INF gamma endógeno en ratones infectados con Trypanosoma cruzi sometidos a distintos tratamientos. XV Reunion Anual Soc. Argentina de Protozoología y Enf. Parasitarias. Abstract en Acta Physiol. Pharmacol. Therap. Latinoam. 47:72, 1996.
- Basso B, Moretti E, Cervetta L y col. Enfermedad de Chagas experimental: Modulación de los niveles de IL10 e IL12 por inmunización de ratones con Trypanosoma rangeli. XLIII Reunión Científica Soc. Arg. Investig. Clínicas y XLVI Reunión Anual Soc. Arg. de Inmunología. Mar del Plata. Nov. 1998 Resumen. Abstract en Medicina (Bs.As.). 1998, 58:639.
- Basso B, Cervetta L, Moretti E. Trypanosoma rangeli induced protection in experimental Chagas disease. Regulation of IL-12 and IL-18 in two vaccination model. 11th International Congress of Immunology. Abstract en Scand. J. Immunol. 2001, 54:92.
- Cervetta L. Enfermedad de Chagas experimental. Efectos de la inmunointervención y la terapéutica en los niveles endógenos de CKs y en la producción de anticuerpos. Tesis doctoral, Facultad de Ciencias Químicas, Universidad Nacional de Córdoba, 2003.
- Truyens C, Torrico F, Lucas R, et al. The endogenous balance of soluble tumor necrosis factor receptors and tumor necrosis factor modulates cachexia and mortality in mice acutely infected with Trypanosoma cruzi. Infec. Immun. 1999, 67:579-5586.
- Castanos-Vélez E, Maerlan S, Osorio I et al. Tripanosoma cruzi infección in TNF receptor p55 deficient mice. Infec. Immun. 1998, 66:2960-2968.
- Moretti E, Basso B, Ledesma O et al. Inmunología de la enfermedad de Chagas: niveles séricos del receptor para interleuquina 2 en niños con infección aguda. Bioquimia. 1994, 19:152-154.
- Moretti E, Basso B, Cervetta L, Brigada A y Barbieri G. Patterns of cytokines and soluble cellular receptors in the serum of children with acute Chagas’ disease. Clin Diagnosis Lab. Immunol. 2002, 9:1324-1327.
- Moretti E, Cervetta L y Basso B. Balance entre TNF y sus receptores solubles en la infección chagásica humana y experimental. Alergia e Inmunología Clínica. 2003, 20:61-66.
- Ferreyra R, Ianny B, Abel L, Buck P, Mady C, Kalil J, Cunha Neto E. Increased plasma levels of tumor necrosis factor alfa in asymptomatic/indeterminate and Chagas disease cardiomyiophatic patients. Mem. Inst. Oswaldo Cruz. 2003, 98:407-411.
- Tarleton R. Immunity to Trypanosoma cruzi. In “Host response to intracellular pathogens”, 1997. R.G. Landers Company.
- Basso B, Cervetta L, Moretti E, Carlier Y, Truyens C. Acute Trypanosoma cruzi infection: IL12, IL18,TNF, sTNFR and NO in T. rangeli vaccinated mice. Vaccine. 2004, 22:1868-1872.
- Girardin E, Roux Lombard P, Grau G. Imbalance between tumor necrosis factor alpha and soluble TNF receptor concentration in severe meningoccaemia. Immunology. 1992, 76:20-23.
- Mjihdi A, Truyens C, Detournay O, Carlier Y. Systemic and placental productions of TNF contribute to induce fetal mortality in mice acutely infected with Trypanosoma cruzi. Exp. Parasitol. 2004, 107:58-64.
- Remick D, Call R, Ebong S. Combinated immunotherapy with soluble tumor necrosis factor receptors plus interleukin 1 receptor antagonist decreases sepsis mortality. Crit. Care Med. 2001, 29:473-481.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento




