QUIMIOTERAPIA ADYUVANTE SEGUIDA DE GOSERELIN VERSUS CUALQUIER MODALIDAD SOLA PARA EL TRATAMIENTO DEL CANCER DE MAMA DE LA PERIMENOPAUSIA CON GANGLIOS LINFATICOS NEGATIVOS: ENSAYO ALEATORIZADO
(especial para SIIC © Derechos reservados)
Coautor
Monica Castiglione-Gertsch*
Prof. Dr. Med. International Breast Cancer Study Group (IBCSG)*
Recepción del artículo: 7 de octubre, 2004
Aprobación: 28 de diciembre, 2004
 Conclusión breve
Las mujeres premenopáusicas con cáncer de mama con receptores estrogénicos negativos y ausencia de compromiso ganglionar deberían recibir quimioterapia adyuvante.
Conclusión breve
Las mujeres premenopáusicas con cáncer de mama con receptores estrogénicos negativos y ausencia de compromiso ganglionar deberían recibir quimioterapia adyuvante.
 Resumen
Antecedentes: En diciembre de 2003, el International Breast Cancer Study Group, (IBCSG) informó los resultados de un ensayo aleatorizado (Trial VIII) en mujeres premenopáusicas y perimenopáusicas con cáncer de mama y ganglios linfáticos negativos que investigó la quimioterapia secuencial y la ablación química del ovario (goserelín) en comparación con cualquiera de las modalidades solas. Pacientes y métodos: Desde marzo de 1990 y hasta octubre de 1999, se aleatorizaron 1 063 pacientes para recibir goserelín por 24 meses (n = 346), 6 cursos de CMF-clásico (ciclofosfamida oral, metotrexato, 5-fluorouracilo) (n = 360), o 6 ciclos de CMF seguidos por 18 meses de goserelín (CMF-goserelín; n = 357). El promedio del seguimiento fue de 7 años, y el resultado primario evaluado fue la supervivencia libre de enfermedad (SLE). Resultados: Las pacientes con tumores con receptores para estrógenos (RE) negativos lograron mejor SLE si fueron tratadas con CMF (SLE a 5 años para CMF y CMF-goserelín = 84% y 88% respectivamente contra 73% para goserelín solo). Para aquellas participantes con RE positivos, el goserelín administrado como única terapéutica arrojó resultados similares a los regímenes con quimioterapia (SLE a 5 años para goserelín solo y para CMF 81%, y para CMF + goserelín, 86%). Conclusiones: Las mujeres premenopáusicas con cáncer de mama RE negativo y ganglios linfáticos negativos deberían recibir quimioterapia adyuvante. Para las pacientes que presentan tumores RE positivos, debería estudiarse con mayor profundidad la combinación de quimioterapia con supresión de la función ovárica u otros agentes endocrinos y el uso de terapia endocrina sola.
Resumen
Antecedentes: En diciembre de 2003, el International Breast Cancer Study Group, (IBCSG) informó los resultados de un ensayo aleatorizado (Trial VIII) en mujeres premenopáusicas y perimenopáusicas con cáncer de mama y ganglios linfáticos negativos que investigó la quimioterapia secuencial y la ablación química del ovario (goserelín) en comparación con cualquiera de las modalidades solas. Pacientes y métodos: Desde marzo de 1990 y hasta octubre de 1999, se aleatorizaron 1 063 pacientes para recibir goserelín por 24 meses (n = 346), 6 cursos de CMF-clásico (ciclofosfamida oral, metotrexato, 5-fluorouracilo) (n = 360), o 6 ciclos de CMF seguidos por 18 meses de goserelín (CMF-goserelín; n = 357). El promedio del seguimiento fue de 7 años, y el resultado primario evaluado fue la supervivencia libre de enfermedad (SLE). Resultados: Las pacientes con tumores con receptores para estrógenos (RE) negativos lograron mejor SLE si fueron tratadas con CMF (SLE a 5 años para CMF y CMF-goserelín = 84% y 88% respectivamente contra 73% para goserelín solo). Para aquellas participantes con RE positivos, el goserelín administrado como única terapéutica arrojó resultados similares a los regímenes con quimioterapia (SLE a 5 años para goserelín solo y para CMF 81%, y para CMF + goserelín, 86%). Conclusiones: Las mujeres premenopáusicas con cáncer de mama RE negativo y ganglios linfáticos negativos deberían recibir quimioterapia adyuvante. Para las pacientes que presentan tumores RE positivos, debería estudiarse con mayor profundidad la combinación de quimioterapia con supresión de la función ovárica u otros agentes endocrinos y el uso de terapia endocrina sola.
 Palabras clave
Cáncer de mama, adyuvante, quimioterapia, goserelín, secuencial
Clasificación en siicsalud
Palabras clave
Cáncer de mama, adyuvante, quimioterapia, goserelín, secuencial
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/70495
Especialidades
 Principal: Obstetricia y Ginecología, Oncología,
Principal: Obstetricia y Ginecología, Oncología,
 Relacionadas: Farmacología, Medicina Farmacéutica, Medicina Interna,
Relacionadas: Farmacología, Medicina Farmacéutica, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Prof. Dr. Med. Monica Castiglione-Gertsch. SIAK/IBCSG Coordinating Center. Effingerstrasse 40. 3008 Bern, Suiza Castiglione, Mónica
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Agradecimientos: Agradecemos a los pacientes, médicos, enfermeras y administradores de datos que participaron en los ensayos del International Breast Cancer Study Group. Reconocemos además el apoyo inicial provisto por el Ludwig Institute for Cancer Research y la Cancer League de Ticino, y el apoyo continuado para la coordinación central, la administración de los datos y las estadísticas aportados por la Swedish Cancer Society, The Cancer Council Australia, Australian New Zealand Breast Cancer Trials Group, the Frontier Science y Technology Research Information, the Swiss Group for Clinical Cancer Research (SAKK), the Swiss Cancer League, y the United States National Cancer Institute (CA-75362). Reconocemos, además, la ayuda brindada a los participantes de Ciudad del Cabo de la Cancer Association of South Africa y a los participantes de St. Gallen de la Foundation for Clinical Cancer Research of Eastern Switzerland.
ADJUVANT CHEMOTHERAPY FOLLOWED BY GOSERELIN VERSUS EITHER MODALITY ALONE FOR PREMENOPAUSAL LYMPH NODE-NEGATIVE BREAST CANCER: A RANDOMIZED TRIAL
 Abstract
Abstract
Background: In December 2003 the International Breast Cancer Study Group (IBCSG) reported the results from a randomized trial for pre- and perimenopausal women with lymph-node-negative breast cancer (Trial VIII), investigating sequential chemotherapy and chemical ovarian ablation (goserelin) compared to either modality alone. Patients and Methods: From March 1990 through October 1999, 1063 patients were randomized to either goserelin for 24 months (n = 346), six courses of classical-CMF (oral cyclophosphamide, methotrexate, 5-fluorouracil) (n = 360), or CMFx6 followed by 18 months of goserelin (CMF-goserelin; n = 357). The median follow-up was 7 years. The primary outcome was disease-free-survival (DFS). Results: Patients with estrogen receptor (ER)-negative tumors achieved better DFS if treated with CMF (5-year DFS for CMF and CMF-goserelin = 84% and 88% respectively vs. 73% for goserelin alone). For patients with ER-positive disease, goserelin alone yielded similar results as chemotherapy-containing regimens (5-year DFS for goserelin alone and for CMF 81%, for CMF-goserelin 86%). Conclusions: Premenopausal women with ER-negative, lymph node–negative breast cancer should receive adjuvant chemotherapy. For patients with ER-positive disease, the combination of chemotherapy with ovarian function suppression or other endocrine agents, and the use of endocrine therapy alone should be further studied.
 Key words
Key words
Breast cancer, adjuvant, chemotherapy, goserelin, sequential
QUIMIOTERAPIA ADYUVANTE SEGUIDA DE GOSERELIN VERSUS CUALQUIER MODALIDAD SOLA PARA EL TRATAMIENTO DEL CANCER DE MAMA DE LA PERIMENOPAUSIA CON GANGLIOS LINFATICOS NEGATIVOS: ENSAYO ALEATORIZADO
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Según la Organización Mundial de la Salud, se les diagnostica anualmente cáncer de mama a más de un millón de mujeres a escala mundial. Las tasas de incidencia de esta neoplasia continúan incrementándose, aunque a un ritmo más lento que en los años previos, en parte debido al incremento en el uso de la mamografía como método de pesquisa.1 Hasta el 80% de las pacientes que tienen diagnóstico nuevo de cáncer de mama en aquellos países donde la mamografía es utilizada como parte de un programa de búsqueda, no se presentan con compromiso de los ganglios linfáticos axilares. A pesar de la cirugía radical, cerca del 40% de las pacientes con patología pero sin ganglios positivos tendrán recaídas durante el seguimiento,2 probablemente debido a micrometástasis no detectadas en el momento del diagnóstico. El cáncer de mama en etapa metastásica todavía es una enfermedad incurable, por lo cual la prevención de la recurrencia es de gran importancia. El objetivo de la terapia adyuvante por vía sistémica es la erradicación de las posibles micrometástasis para evitar la recurrencia. Se vio que las mujeres que reciben este tipo de terapéutica tienen una mejoría clínicamente significativa tanto en la supervivencia libre de enfermedad (SLE) como en la supervivencia general (SG).3-5 Las terapias adyuvantes sistémicas incluyen la quimioterapia citotóxica y las manipulaciones endocrinas o combinaciones de ambas. Durante los últimos años se han desarrollado nuevos agentes como anticuerpos (trastuzumab) que se hallan en investigación en ensayos clínicos.
Los primeros ensayos que estudiaron las terapias adyuvantes se iniciaron hace más de 50 años e investigaron manipulaciones endocrinas (ooforectomía). Los estudios que analizaron la quimioterapia comenzaron hace más de 40 años, como el National Surgical Adjuvant Breast and Bowel Project [NSABP].6 Los beneficios de ambas estrategias fueron demostrados por los resultados de diversos ensayos clínicos y por el Oxford Overview. En este último, publicado inicialmente en 1998 y actualizado con posterioridad, con la ablación ovárica adyuvante se observó un beneficio significativo en pacientes menores de 50 años. Doce estudios que analizaron la ablación ovárica mediante irradiación o castración quirúrgica mostraron una mejoría significativa de 15 años en la supervivencia y en supervivencia libre de recurrencias en comparación con la cirugía como único tratamiento.7 El beneficio fue significativo para pacientes con diseminación axilar o sin ella al momento del diagnóstico; una limitación de muchos de los estudios que se incluyeron en el Overview fue la falta de determinación del contenido de receptores estrogénicos en los tumores primarios, y que el estado menopáusico de las mujeres solamente se definió según la edad (mayor o menor de 50 años).
En 1987, West y col. publicaron el primer informe que mostró que la administración crónica de análogos sintéticos de la hormona liberadora de gonadotrofinas (GnRH) provocó, en mujeres premenopáusicas, un descenso en los valores de estradiol a niveles que se observan en la posmenopausia.8 En forma simultánea, un ensayo pequeño informó que los análogos GnRH produjeron una tasa de respuesta similar a la de la ooforectomía quirúrgica.9 Desde 1987, diversas observaciones demostraron claramente la eficacia de estos compuestos.10,11
En 1989, el Ludwig Breast Cancer Study Group publicó tres estudios12-14 en los que se investigó la quimioterapia sistémica adyuvante en el cáncer de mama con ganglios negativos. Los tres ensayos mostraron un incremento en la SLE en los grupos de pacientes bajo terapia adyuvante. Posiblemente, debido al corto período de seguimiento de estos trabajos, la supervivencia global no se incrementó en el grupo de pacientes tratadas. El Oxford Overview, posteriormente, confirmó la reducción de la recurrencia y del riesgo de mortalidad en pacientes con cáncer de mama con ganglios negativos tratadas con quimioterapia.5
El Trial VIII del IBCSG fue diseñado en el momento que el análisis del Grupo de Colaboración del Early Breast Cancer Trialist (EBCTCG) sugirió que la adición de tamoxifeno (TAM) a la quimioterapia estándar adyuvante para pacientes menores de 50 años fracasaba en mejorar la supervivencia libre de recaídas o la supervivencia global.15 En consecuencia, el Ensayo VIII no incluyó el tamoxifeno en las diferentes ramas del tratamiento.
Sobre la base de estos resultados, en 1990, el IBCSG inició un estudio clínico (Ensayo VIII) para pacientes premenopáusicas y perimenopáusicas con cáncer de mama y ganglios linfáticos negativos para evaluar el papel del tratamiento adyuvante empleando quimioterapia, supresión ovárica con goserelin o la combinación secuencial de ambas modalidades (Figura 1).

Pacientes y métodos
Desde marzo de 1990 y hasta octubre de 1999, 1 063 mujeres premenopáusicas fueron asignadas al azar para recibir tratamiento con goserelin durante 24 meses (n = 346), seis cursos de quimioterapia CMF “clásica” (ciclofosfamida oral, metotrexato y 5-fluorouracilo; n = 360), o seis cursos de CMF clásica seguidos por 18 meses de goserelin (CMF + goserelin; n = 357). Las pacientes se estratificaron de acuerdo con el estado de los receptores estrogénicos (RE) en el tumor primario, en negativo, positivo o desconocido, si estaba planeada o no la realización de radioterapia luego de la cirugía conservadora, y de acuerdo con la institución participante. La mayoría de las pacientes tuvieron tumores clasificados como RE-positivos (68%). El 20% de las mujeres tenían 39 años o menos. La mediana de seguimiento fue de 7 años y el resultado primario fue la SLE.
Resultados
No se observaron diferencias a nivel general entre los tres grupos de tratamiento en cuanto a SLE o supervivencia general (SG) (Figura 2).

La figura 2 fue tomada de Journal of the National Cancer Institute, Vol. 95 (24) 2003 pp. 1833-46, IBCSG Adjuvant Chemotherapy Followed by Goserelin…, y se reproduce con autorización de Oxford University Press.
Sin embargo, se observaron varias diferencias en el análisis por estratificación de poblaciones. Como era de esperar, las pacientes con tumores RE-negativos lograron mejor SLE con CMF (SLE a los 5 años para CMF = 84%; intervalo de confianza del 95% [IC] 77%-91%; SLE a los 5 años para CMF + goserelin = 88%; IC 82%-94%), que si habían recibido goserelin solo (SLE a los 5 años = 73%; IC 64%-81%). En contraste, para las pacientes con tumores RE-positivos, la quimioterapia sola y el goserelin solo aportaron resultados similares (SLE a los 5 años para ambos grupos de tratamiento = 81%; IC 76%-87%), en particular en las participantes de mayor edad (40 años o más). La secuencia CMF más goserelin (SLE a los 5 años = 86%, IC 82%-91%) proveyó una mejoría no significativa desde el punto de vista estadístico en comparación con cada una de las modalidades solas, en particular en la subpoblación de mujeres más jóvenes (39 años o menos) (Figura 3).

La figura 3 fue tomada de Journal of the National Cancer Institute, Vol. 95 (24) 2003 pp. 1833-46, IBCSG Adjuvant Chemotherapy Followed by Goserelin…, y se reproduce con autorización de Oxford University Press.
Discusión
El Trial VIII de IBCSG para mujeres premenopáusicas y perimenopáusicas con cáncer de mama y ganglios linfáticos negativos comenzó en 1990; durante el período de estudio se publicaron algunos otros ensayos y surgió más información acerca de la terapia hormonal, como se detalla en la Tabla 1.
Tabla 1Los resultados del Ensayo VIII confirman y extienden el hallazgo de que la quimioterapia adyuvante es más efectiva que la terapia endocrina en mujeres premenopáusicas con cáncer de mama con RE y ganglios linfáticos negativos. Para las pacientes con RE-positivos, la quimioterapia sola y el goserelin solo aportaron resultados similares, mientras que el tratamiento secuencial (CMF seguido de goserelin) proveyó una mejoría que no es estadísticamente significativa en comparación con cada una de las modalidades solas, en particular en el grupo de pacientes más jóvenes. Estos resultados muestran la importancia del análisis de los subgrupos en los ensayos clínicos: en promedio, las tres opciones terapéuticas arrojaron resultados similares en términos de la SLE. Sin embargo, el análisis diferenciado por factores estratificados, en particular por el contenido de receptores estrogénicos en el tumor primario, permitió definir poblaciones para las cuales la terapia endocrina sola podría ser una opción terapéutica válida. Además, el ensayo permitió realizar la observación que para la subpoblación más joven con RE-positivos la terapia endocrina es una parte muy importante del tratamiento adyuvante.27
Dos ensayos aleatorizados (INT 0101, Arriagada y col.) no hallaron beneficio significativo en la SLE ni en la supervivencia general cuando se agregó LHRH a la quimioterapia adyuvante en pacientes que presentan casi exclusivamente ganglios linfáticos positivos.28,29 Por otro lado, un ensayo de fase III (ECOG-E5188) mostró beneficio significativo en la SLE en mujeres premenopáusicas con cáncer de mama y ganglios positivos cuando se comparó la combinación de quimioterapia más ablación ovárica y tamoxifeno con la quimioterapia sola o la combinación de quimioterapia y ablación ovárica.30
Los resultados del estudio ZIPP, que analizó quimioterapia contra quimioterapia seguida de agonistas LHRH fueron presentados en el encuentro de la ASCO 2001 y no se pudieron observar diferencias significativas en la SLE ni en la general entre las dos opciones terapéuticas. Sin embargo, el ensayo ZIPP incluyó pacientes con ganglios linfáticos positivos y negativos, pero no informó análisis por subgrupos de acuerdo con los ganglios y a la edad.23
El IBCSG llevó a cabo un ensayo clínico aleatorizado (Ensayo IBCSG 11-93) para comparar la eficacia de la ablación ovárica y tamoxifeno contra el mismo tratamiento más el agregado de quimioterapia en mujeres premenopáusicas con ganglios positivos, RE+ y/o receptores para progesterona positivos. Este ensayo se cerró prematuramente debido a la baja tasa de acumulación o incremento. Sin embargo, los resultados son muy interesantes y muestran que la SLE a los 4 años fue similar para ambos grupos. Este ensayo pequeño indica la importancia de efectuar pruebas sobre si la quimioterapia en asociación con el “bloqueo estrogénico completo” (supresión de la función ovárica más tamoxifeno) mejora los resultados en comparación con el “bloqueo estrogénico completo” solo para mujeres premenopáusicas con enfermedad con respuesta endocrina.31
Entre diversos estudios19-21,32 que compararon la quimioterapia adyuvante contra las terapéuticas endocrinas que incluyeron 5 años de tamoxifeno y 2 o 3 años de agonistas de la hormona liberadora de gonadotrofinas (GnRH), el más grande fue el Ensayo 5 del Grupo de Austrian Breast and Colorectal Cancer Study Group (ABSCG),21 el cual arrojó mejores resultados con el tratamiento endocrino combinado que con la quimioterapia sola.Recientemente han surgido datos sobre el empleo de inhibidores de la aromatasa (IA) en el ámbito adyuvante. El anastrozol como tratamiento endocrino adyuvante inicial mostró superioridad sobre el tamoxifeno en términos de SLE33 y se vio una reducción en el riesgo de recurrencia en ensayos que analizaron el uso secuencial de un IA luego de tamoxifeno (letrozol luego de 5 años de tamoxifeno o exemestrano luego de 2 a 3 años de tamoxifeno).34 El seguimiento de estos estudios todavía es corto y aún se conoce muy poco la toxicidad a largo plazo, pero los IA como tratamiento inicial o en secuencia con tamoxifeno están ganando rápidamente adeptos entre oncólogos y pacientes.
En la actualidad, tres estudios multicéntricos coordinados por el IBSCG,35 en cooperación con el Breast International Group y el North American Breast Cancer Intergroup están tratando algunas cuestiones importantes acerca de la mejor terapia hormonal y el programa adyuvante óptimo para pacientes premenopáusicas con cáncer de mama con respuesta a las hormonas. Las cuestiones a aclarar son: el beneficio de la supresión de la función ovárica en asociación con antiestrógenos; el papel de los IA en esta población (obviamente, junto con ablación ovárica) (tanto para mujeres con ganglios positivos como negativos), y la necesidad de empleo de quimioterapia (para pacientes con ganglios negativos tratados de forma óptima con agentes endocrinos).
El diseño de estos estudios se muestra en las Figuras 4, 5 y 6.

Ensayo SOFT (Supression of Ovarian Function Trial): se diseñó para mujeres premenopáusicas que continúan premenopáusicas luego de la cirugía y la quimioterapia (si están indicadas), para comparar la supresión ovárica mediante el análogo GnRH triptorelina, ooforectomía bilateral o irradiación ovárica, más tamoxifeno o exemestano contra tamoxifeno solo.
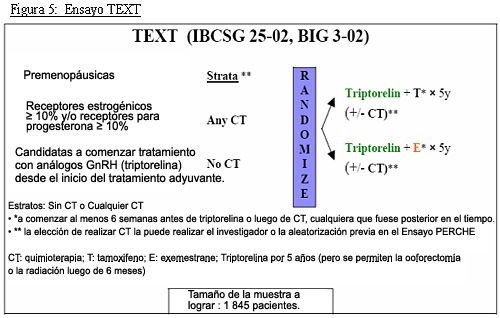
Ensayo TEXT (Complementary Tamoxifen and Exemestane Trial): compara el análogo GnRH triptorelina más tamoxifeno contra triptorelina más exemestano para pacientes que reciben el análogo (con quimioterapia o sin ella) desde el comienzo de su programa de tratamiento adyuvante.
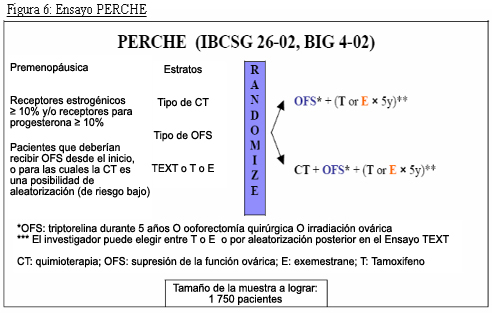
Ensayo PERCHE (Premenopausal Endocrine Responsive Chemotheraphy): se diseñó solamente para pacientes con enfermedad y ganglios negativos y compara la supresión de la función ovárica desde el inicio del programa adyuvante, con quimioterapia o sin ella (primera aleatorización), seguido por tamoxifeno o exemestano (segunda aleatorización).
Debido a que el diagnóstico de cáncer de mama en mujeres premenopáusicas es menos frecuente que en mujeres de mayor edad y debido a la necesidad de mejorar rápidamente el resultado en esta población particular, la colaboración mundial será importante para la realización exitosa de ensayos clínicos como los que están en marcha (SOFT, TEXT y PERCHE), los cuales están tratando de responder preguntas relevantes para nuestras pacientes.
Las autoras no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Jemal A, Tiwari R, Murray T, et al. Cancer Statistics, 2004. CA Cancer J Clin 2004; 54:8-29.
- Colleoni M, Gelber S, Coates A, et al. for the IBCSG. Influence of endocrine-related factors on response to perioperative chemotherapy for patients with node-negative breast cancer. J Clin Oncol 2001;19:4141-9.
- Early Breast Cancer Trialists’ Collaborative Group: Ovarian ablation in early breast cancer: overview of the randomized trials. Lancet 1996;348:1189-96.
- Early Breast Cancer Trialists’ Collaborative Group: Tamoxifen for early breast cancer: an overview of the randomized trials. Lancet 1998;351:1451-67.
- Early Breast Cancer Trialists’ Collaborative Group: Polychemotherapy for early breast cancer: overview of the randomized trials. Lancet 1998;352:930-42
- http://www.themediweb.net/Lecture/historyofmastectomy/htmlpages/page28.htm.
- Early Breast Cancer Trialists' Collaborative Group: Ovarian ablation for early breast cancer (Cochrane Review). Abstract, From The Cochrane Library, Issue 2, 2004.
- West C, Bird D: Suppression of ovarian activity by Zoladex depot (ICI 118 630) a long acting luteinizing hormone releasing hormone agonist analogue. Clin Endocrinol 1987;26:213-220.
- Robertson J, Nicholson R, Walker K, et al. Zoladex in advanced breast cancer. Horm Res 1989;32 Suppl 1:206-208.
- Nicholson R, Walker K.: Gn-RH agonists in breast cancer and gynaecologic cancer treatment. Review. J Steroid Biochem. 1989;33(4B):801-4.
- Sismondi P, Giai M, Defabiani E, et al:LHRH-analogues: clinical results in ovarian and breast cancer. Minerva Ginecol. 1990;42(6):227-37
- The Ludwig Breast Cancer Study Group: Prolonged disease-free survival after one course of perioperative adjuvant chemotherapy for node-negative breast cancer. N Engl J Med. 1989;320 (8):491-496.
- An intergroup study: Efficacy of adjuvant chemotherapy in high-risk node-negative breast cancer. N Engl J Med. 1989;320 (8):485-490.
- Fisher B, Redmond C, Dimitrov N, et al. A randomized clinical trial evaluating sequential methotrexate and fluorouracil in the treatment of patients with node-negative breast cancer who have estrogen-receptor-negative tumors.
- Hortobagyi G, Buzdar A: Current Status of Adjuvant Systemic Therapy for Primary Breast Cancer: Progress and Controversy.CA Cancer J Clin 1995: 45:199-226.
- Boccardo F, Rubagotti A, Perrotta A, et al. Ovarian ablation versus goserelin with or without tamoxifen in pre–perimenopausal patients with advanced breast cancer: results of a multicentric Italian study. Ann Oncol 1994;5:337–42.
- Taylor C, Green S, Dalton W, et al. Multicenter randomized clinical trial of goserelin versus surgical ovariectomy in premenopausal patients with receptor-positive metastatic breast cancer: an intergroup study. J Clin Oncol 1998;16:994–9.
- Jonat W, Kaufman M, Sauerbrei R et al. Goserelin vs cyclophosphamide, methotrexate, and fluorouracil as adjuvant therapy in premenopausal patients with node-positive breast cancer: the zoladex early breast cancer research association study. J Clin Oncol 2002;20:4628-4635.
- Roche H, Kerbrat P, Bonneterre J et al. Complete hormonal blockade vs chemotherapy in premenopausal early-stage breast cancer patients with positive hormone-receptor and 1-3 node positive (N+) tumor: results of the FASG 06 trial. Proc ASCO 2000; 19:72a (abstr 279).
- Boccardo F, Rubagotti A, Amoroso D et al. Cyclophosphamide, methotrexate, and fluorouracil vs TAM plus ovarian suppression as adjuvant treatment of oestrogen receptor-positive pre/perimenopausal breast cancer patients: results of the Italian breast cancer adjuvant study group 02 randomised trial. J Clin oncol 2000;18:2718-2727.
- Jakesz R, Hausmaninger H, Kubista E et al. Randomised adjuvant trial of Tamoxifen and Goserelin versus cyclophosphamide, methotrexate, and fluorouracil: evidence for the superiority of treatment with endocrine blockade in premenopausal patients with hormone responsive breast cancer- Austrian breast and colorectal cancer study group trial 5. J Clin Oncol 2002;20:4621-4627.
- Klijn J, Blamey R, Boccardo F, et al. Combined Tamoxifen and Luteinizing Hormone-Releasing Hormone (LHRH) Agonist Versus LHRH Agonist Alone in Premenopausal Advanced Breast Cancer: A Meta-Analysis of Four Randomized Trials. Journal of Clinical Oncology 2001;19 (2):343-353.
- Baum M, Houghton J, Sawyer W et al. Management of premenopausal women with early breast cancer: is there a role for goserelin. Proc ASCO 2001;21:38a (abstr 103)
- Dowsett M, Doody D, Miall S, et al. Vorozole results in greater oestrogen suppression than formestane in postmenopausal women and when added to goserelin in premenopausal women with advanced breast cancer. Breast Cancer Res Treat 1999;56:25-34.
- Celio L, Martinetti A, Ferrari L, et al. Premenopausal breast cancer patients treated with a gonadotropin-releasing hormone analog alone or in combination with an aromatase inhibitor: a comparative endocrine study. Anticancer Res 1999;16:2261-2268.
- Forward D, Cheung K, Jackson J, et al. Combined use of goserelin and anastrazole (Arimidex) in premenopausal women with metastatic breast cancer. Proc Am Soc Clin Oncol 2000;19:A582.
- Aebi S, Gelber S, Castiglione-Gertsch M, et al for the International Breast Cancer Study Group: Is chemotherapy alone adequate for young women with oestrogen-receptor-positive breast cancer Lancet 2000;355:1869-1874.
- Davidson N, O’Neill A, Vukov A et al. Effect of chemohormonal therapy in pre-menopausal, node (+), receptor (+) breast cancer: an eastern cooperative oncology group phase III Intergroup Trial (E5188,INT-0101). Proc ASCO 2003; (abstr 15).
- Arriagada R, Le MG, Spielman M, et al. Randomized trial of adjuvant ovarian suppression in 926 premenopausal patients with early breast cancer treated with adjuvant chemotherapy. Proc ASCO 2003; (abstr 14).
- Davidson N, O'Neill A, Vukov A, et al. Chemohormonal therapy in premenopausal node-positive, receptor-positive breast cancer: An Eastern Cooperative Oncology Group phase III intergroup trial (E5188,INT-0101). Proc Am Soc Clin Oncol 2003;22: page 5, (abstr 15).
- Thurlimann B, Price K, Castiglione M, et al. Randomized controlled trial of ovarian function suppression plus tamoxifen versus the same endocrine therapy plus chemotherapy: is chemotherapy necessary for premenopausal women with node-positive, endocrine-responsive breast cancer: First results of International Breast Cancer Study Group Trial 11-93. The Breast 2001; 10(3):130-138.
- Roche’ H, Mihura J, de Lafontan B, et al. Castration and tamoxifen versus chemotherapy (FAC) for premenopausal, node and receptor positive breast cancer patients: a randomized trial with a 7 years median follow-up. Proc ASCO 1996; 15:117 (abstr 134).
- Klijn J, for the ATAC Trialists' Group:The ATAC (anastrozole, Tamoxifen, Alone or in Combination) trial. an efficacy update, focusing on breast cancer (BC) events, based on a median follow-up of 47 months. Proc Am Soc Clin Oncol 22: page 85, 2003 (abstr 338).
- Clemons M, Coleman RE, Verma S. Aromatase inhibitors in the adjuvant setting: bringing the gold to a standard. Cancer Treat Rev. 2004 Jun;30(4):325-32.
- www.ibcsg.org.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento





