GENETICA MOLECULAR DEL SISTEMA RH. IMPORTANCIA CLINICA
(especial para SIIC © Derechos reservados)
Coautores
Claudia Silvia Biondi.* Silvia Estela García Borrás.** René Alberto Di Mónaco.*** Amelia Leonor Racca.****
Bioquímica. Especialista en Inmunohematología. Doctora en Bioquímica. Docente e Investigadora del Area Inmunología. Facultad de Ciencias Bioquímicas y Farmacéuticas. Universidad Nacional de Rosario.*
Bioquímica. Docente e Investigadora del Area Inmunología. Facultad de Ciencias Bioquímicas y Farmacéuticas. Universidad Nacional de Rosario.**
Médico. Especialista en Obstetricia. Docente e Investigador de la Cátedra de Obstetricia y Ginecología. Facultad Ciencias Médicas. Universidad Nacional de Rosario.***
Doctora en Bioquímica. Profesora Asociada del Area Inmunología. Investigadora Principal del Consejo de Investigaciones de la Universidad Nacional de Rosario.Facultad de Ciencias Bioquímicas y Farmacéu****
Recepción del artículo: 27 de mayo, 2004
Aprobación: 16 de septiembre, 2004
 Conclusión breve
La genotipificación molecular resulta apropiada para la determinación de antígenos de grupos sanguíneos en pacientes con anemia hemolítica autoinmune y en pacientes politransfundidos. También es una herramienta útil para la selección de unidades de sangre compatible en pacientes aloinmunizados y para la tipificación de glóbulos rojos con expresión alterada del antígeno D.
Conclusión breve
La genotipificación molecular resulta apropiada para la determinación de antígenos de grupos sanguíneos en pacientes con anemia hemolítica autoinmune y en pacientes politransfundidos. También es una herramienta útil para la selección de unidades de sangre compatible en pacientes aloinmunizados y para la tipificación de glóbulos rojos con expresión alterada del antígeno D.
 Resumen
El sistema Rh es el grupo sanguíneo más complejo y polimórfico de la membrana del glóbulo rojo. Este sistema presenta un gran interés clínico debido a que sus antígenos son sumamente inmunogénicos y juegan un papel central en la patogénesis de la enfermedad hemolítica fetoneonatal, en algunas anemias hemolíticas autoinmunes y en reacciones hemolíticas transfusionales. La tipificación del sistema Rh se realiza en el laboratorio clínico por técnicas de hemaglutinación. Esta metodología presenta limitaciones atribuibles a la dificultad para obtener reactivos con alta sensibilidad y a la imposibilidad de acceder al estudio del antígeno en ciertas situaciones clínicas. La determinación de las bases genéticas de este sistema permitió desarrollar métodos de biología molecular, basados principalmente en la reacción en cadena de la polimerasa (PCR), para la genotipificación de estos antígenos. Las técnicas inmunológicas y moleculares, utilizadas en conjunto, permiten el diagnóstico precoz de la incompatibilidad fetomaterna. La genotipificación molecular resulta apropiada para la determinación de antígenos de grupos sanguíneos en pacientes con anemia hemolítica autoinmune por anticuerpos calientes y en pacientes politransfundidos. También es una herramienta útil para la selección de unidades de sangre compatible en pacientes aloinmunizados y para la tipificación de glóbulos rojos con expresión alterada del antígeno D.
Resumen
El sistema Rh es el grupo sanguíneo más complejo y polimórfico de la membrana del glóbulo rojo. Este sistema presenta un gran interés clínico debido a que sus antígenos son sumamente inmunogénicos y juegan un papel central en la patogénesis de la enfermedad hemolítica fetoneonatal, en algunas anemias hemolíticas autoinmunes y en reacciones hemolíticas transfusionales. La tipificación del sistema Rh se realiza en el laboratorio clínico por técnicas de hemaglutinación. Esta metodología presenta limitaciones atribuibles a la dificultad para obtener reactivos con alta sensibilidad y a la imposibilidad de acceder al estudio del antígeno en ciertas situaciones clínicas. La determinación de las bases genéticas de este sistema permitió desarrollar métodos de biología molecular, basados principalmente en la reacción en cadena de la polimerasa (PCR), para la genotipificación de estos antígenos. Las técnicas inmunológicas y moleculares, utilizadas en conjunto, permiten el diagnóstico precoz de la incompatibilidad fetomaterna. La genotipificación molecular resulta apropiada para la determinación de antígenos de grupos sanguíneos en pacientes con anemia hemolítica autoinmune por anticuerpos calientes y en pacientes politransfundidos. También es una herramienta útil para la selección de unidades de sangre compatible en pacientes aloinmunizados y para la tipificación de glóbulos rojos con expresión alterada del antígeno D.
 Palabras clave
Sistema Rh, antígeno D, genotipificación RH, enfermedad hemolítica fetoneonatal, ADN fetal, anemia hemolítica autoinmune, transfusión
Clasificación en siicsalud
Palabras clave
Sistema Rh, antígeno D, genotipificación RH, enfermedad hemolítica fetoneonatal, ADN fetal, anemia hemolítica autoinmune, transfusión
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/68689
Especialidades
 Principal: Genética Humana, Hematología,
Principal: Genética Humana, Hematología,
 Relacionadas: Diagnóstico por Laboratorio, Inmunología, Medicina Interna,
Relacionadas: Diagnóstico por Laboratorio, Inmunología, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Carlos Miguel Cotorruelo. Facultad de Ciencias Bioquímicas y Farmacéuticas. Departamento de Bioquímica Clínica. Laboratorio de Inmunohematología Histocompatibilidad e Inmunogenética. Suipacha 531. 2000 Rosario. Argentina. Cotorruelo, Carlos Miguel
MOLECULAR GENETICS OF THE RH SYSTEM. CLINICAL IMPORTANCE
 Abstract
Abstract
The Rh system is the most polymorphic of all the erythrocyte blood group systems. It is of clinical interest because Rh antigens are highly immunogenic and they are central in the pathogenesis of haemolytic disease of the newborn, haemolytic transfusion reactions and some autoimmune haemolytic anaemias. Routinely, Rh typing is performed by agglutination with polyclonal antibodies and with IgM or blends of IgM and IgG monoclonal antibodies. However, there are some clinical situations in which serological techniques cannot determine the red blood cell phenotype accurately. The determination of the genetic organization of the RH locus has allowed the development of molecular biology methods, mainly based in polymerasa chain reactions, for Rh antigens genotyping. Immunological and molecular methods, in conjunction, are beneficial when attempting to identify antigen incompatibilities between a pregnant woman and her foetus. Molecular genotyping constitute a supplement technique to haemagglutination tests for the determination of the true blood group antigens in cases of warm type autoimmune haemolytic anaemia and polytransfused patients. It is also a useful tool for the selection of compatible blood units for alloimmunized patients and for the characterization of red blood cells with altered expression of the D antigen.
 Key words
Key words
Rh blood group system, D antigen, RH genotyping, haemolytic disease of the newborn, fetal DNA, autoimmune haemolytic anaemia, transfusion
GENETICA MOLECULAR DEL SISTEMA RH. IMPORTANCIA CLINICA
(especial para SIIC © Derechos reservados)
Artículo completo
Genética del sistema Rh
El sistema Rh es el grupo sanguíneo más complejo y polimórfico de la membrana del glóbulo rojo. Está compuesto por más de 45 antígenos definidos por métodos serológicos, los más importantes son los antígenos D, C, c, E y e. La presencia o ausencia del antígeno D en la membrana eritrocitaria define a un individuo como RhD positivo o RhD negativo. El sistema Rh presenta un gran interés clínico en obstetricia y medicina transfusional debido a la participación de sus aloanticuerpos en la destrucción inmune de los glóbulos rojos. Los antígenos de este sistema son sumamente inmunogénicos y juegan un papel central en la patogénesis de la enfermedad hemolítica fetoneonatal, en algunas anemias hemolíticas autoinmunes y en reacciones hemolíticas transfusionales.1
Según la teoría propuesta por Fisher y Race en 1943, el sistema Rh estaría compuesto por tres genes, cada uno con dos alelos. Los productos de estos genes parecen ser los antígenos D/d, C/c y E/e. Los tres loci parecen estar estrechamente ligados en cada cromosoma formando los haplotipos DCe, Dce, DCE, DcE, dce, dCe, dcE y dCE que se transmiten de una generación a otra como una unidad o complejo génico1 (figura 1).
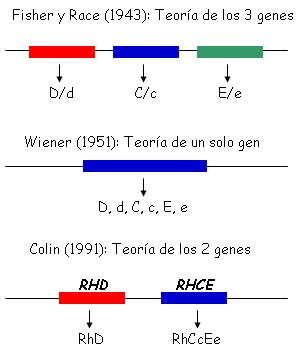
Figura 1: Genética del sistema Rh. Teoría de Fisher y Race: el sistema Rh parece estar compuesto por 3 genes, cada uno con dos alelos cuyos productos parecen ser los antígenos D/d, C/c y E/e. Teoría de Wiener: la herencia del sistema Rh podría depender de un solo gen con múltiples alelos. Cada gen produciría un antígeno sobre el cual podrían identificarse varios factores: D, d, C, c, E, e. Teoría de Colin: el locus del sistema Rh está compuesto por dos genes que dan origen a dos proteínas: RhD, que expresa los epitopes D, y RhCcEe, que expresa los epitopes C, c, E, e.
Wiener propuso en 1951 que la herencia del sistema Rh podría depender de un solo gen con múltiples alelos. Cada gen produciría un antígeno sobre el cual podrían identificarse varios factores, capaces de reaccionar con los anticuerpos específicos1 (figura 1).Estas dos teorías permiten interpretar los hallazgos del laboratorio inmunohematológico, pero no explican el elevado polimorfismo asociado al sistema Rh.
En 1991, Colin2 propuso que el locus del sistema Rh está compuesto por dos genes (figura 1) y estableció las bases genéticas asociadas a los fenotipos RhD positivo y RhD negativo. En resumen:
- El locus RH está compuesto por dos genes homólogos denominados RHD y RHCE.
- Los individuos caucásicos RhD positivos poseen uno o dos genes RHD por célula, mientras que el fenotipo RhD negativo resulta de la ausencia del gen RHD, las personas RhD negativas son homocigotas para la deleción del gen RHD (figura 2).
- El gen RHD codifica la proteína RhD que expresa los epitopes del antígeno D.
- El gen RHCE posee cuatro formas alélicas más comunes: RHCe, RHce, RHcE y RHCE, las cuales determinan la expresión combinada de los antígenos Ce, ce, cE y CE en la proteína RhCcEe.
- Existen variantes alélicas poco frecuentes para ambos genes RHD y RHCE.
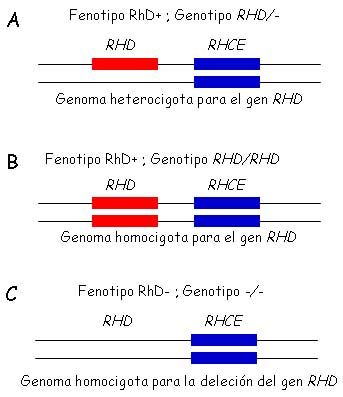
Figura 2. Fenotipo RhD y Genotipo RHD. Los individuos RhD positivos poseen uno (A) o dos (B) genes RHD por célula, mientras que el fenotipo RhD negativo resulta de la ausencia (C) del gen RHD, debida probablemente a un evento de deleción, las personas RhD negativas son homocigotas para esta deleción del gen RHD.
Proteínas Rh: estructura y función
Las proteínas Rh (RhD y RhCcEe) presentan un 92% de homología y están compuestas por una única cadena polipeptídica de 417 residuos de aminoácidos. Este polipéptido atraviesa la membrana eritrocitaria 12 veces, formando 6 dominios extracelulares y posee los extremos amino terminal y carboxilo terminal orientados hacia el citoplasma.3
La expresión de los antígenos del sistema Rh en la membrana eritrocitaria requiere la presencia de una glucoproteína asociada, denominada RhAG. Las proteínas Rh, la glucoproteína RhAG y otras proteínas accesorias (LW, CD47, GPB y Banda 3) se asocian en la membrana del glóbulo rojo formando el complejo Rh. El núcleo central de este complejo está compuesto por un tetrámero formado por dos moléculas RhAG y dos monómeros RhD o RhCcEe estabilizado por asociaciones entre los dominios amino terminal y carboxilo terminal. Las proteínas accesorias se asocian a este tetrámero por uniones no covalentes.4
El antígeno D es un mosaico compuesto por al menos 24 epitopes diferentes expresados sobre el polipéptido RhD. El polimorfismo C/c está asociado principalmente a la sustitución del aminoácido Ser por Pro en la posición 103 presente en el segundo dominio extracelular, mientras que el polimorfismo E/e está asociado a una sustitución del aminoácido Pro por Ala en la posición 226 en el cuarto dominio extracelular de la proteína RhCcEe.3,4
Los antígenos del sistema Rh pueden presentar alteraciones en su expresión dando origen a fenotipos débiles, parciales o delecionados. Estos fenotipos son los productos de las variantes alélicas de los genes RH.
Los glóbulos rojos con fenotipo D débil (Du) poseen un número de sitios antigénicos D menor que los eritrocitos RhD positivos. Los fenotipos D parciales se caracterizan por la ausencia de uno o más epitopes del antígeno D asociado en algunos casos con una expresión antigénica débil. Estas variantes no reaccionan con algunos anticuerpos anti-D monoclonales o son identificadas porque los individuos son capaces de producir aloanticuerpos contra los epitopes que no poseen.1
Sin embargo, los estudios moleculares demostraron que en los fenotipos D débiles la proteína RhD también se encuentra ligeramente modificada, por lo que se llega a la conclusión de que las variantes D débiles y D parciales deberían nombrarse D aberrantes, ya que toda expresión alterada del antígeno D representa un único fenotipo.5
Las funciones biológicas que desempeñan las proteínas del sistema Rh no están aún bien definidas. Estudios recientes sugieren que participarían en el transporte de amonio e incluso se identificaron proteínas no eritroides pertenecientes a la familia Rh.6
El locus RH
El locus RH se encuentra en el brazo corto del cromosoma 1 entre las posiciones 1p34.3 y 1p36.1 y está compuesto por dos genes estructurales y adyacentes denominados RHCE y RHD. Estos genes se encuentran separados por aproximadamente 30 000 pb y presentan una orientación opuesta, enfrentándose por sus extremos 3'. Este espacio intergénico está ocupado por el gen SMP1 y una caja Rhesus. Los genes RHCE y RHD están compuestos por 10 exones cada uno distribuidos en aproximadamente 57 Kb de ADN. Entre estos dos genes existe un 90% de homología en las secuencias nucleotídicas codificantes que indica que surgieron de la duplicación de un gen ancestral común.3,7-9 Los intrones 2, 3 y 4 del gen RHD presentan deleciones de 109 pb, 288 pb y 651 pb, respectivamente. La región 3' no codificante del gen RHD ocupa más de 1 500 pb y es mucho menor en el gen RHCE3 (figura 3).
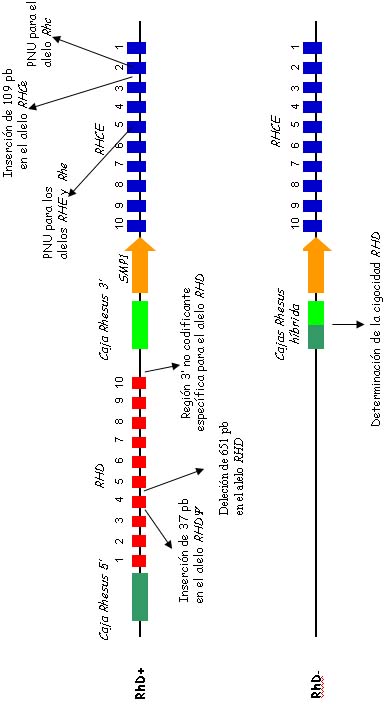
Figura 3. Organización genómica del locus RH en cromosomas de individuos RhD positivos y RhD negativos. Las flechas indican los sitios polimórficos utilizados para la genotipificación RH y la determinación de la cigocidad del gen RHD. El análisis del polimorfismo de nucleótido único (PNU) en los exones 1, 2, 3, 4, 5, 6, 7 y 9 también puede ser utilizado para la genotipificación RHD.
La presencia o ausencia del gen RHD en el ADN humano determina las bases moleculares del polimorfismo asociado a los fenotipos RhD positivo y negativo. Los individuos RhD positivos poseen uno o dos genes RHD por célula, mientras que el fenotipo RhD negativo resulta de la ausencia del gen RHD, debida probablemente a un evento de deleción, siendo las personas RhD negativas homocigotas para esta deleción del gen RHD2 (figura 2).
El gen RHD está flanqueado por secuencias de ADN sumamente homólogas, denominadas cajas Rhesus, que contienen una "región de identidad" de 1 463 pb completamente iguales. La deleción del gen RHD responsable del fenotipo negativo es el resultado del entrecruzamiento desigual entre las regiones de identidad 5' y 3' con la formación de una caja Rhesus híbrida. El análisis de cajas Rhesus híbridas es útil para determinar la cigocidad del gen RHD. La presencia de una copia es predictiva de la heterocigocidad del gen RHD10 (figura 3).
Fenotipos Rh y alelos RH
El gen RHD tiene un alelo de alta frecuencia responsable del fenotipo RhD positivo y distintas variantes alélicas, menos frecuentes, que dan origen a los fenotipos D parcial, D débil y a proteínas RhD que no se expresan en la membrana eritrocitaria.11,12
Los eventos moleculares que conducen a los fenotipos D parciales producen la sustitución de aminoácidos localizados en dominios extracelulares de la proteína RhD modificando el epitope antigénico. Por el contrario, los alelos D débiles son responsables de sustituciones de aminoácidos en los dominios intracelulares o transmembrana de la proteína RhD. Estos cambios de aminoácidos modificarían la estructura secundaria y terciaria del polipéptido RhD o alterarían su integración a la membrana celular provocando una disminución en la expresión de los epitopes D.3,5,8,9
Es importante considerar que algunos individuos RhD negativo, generalmente pertenecientes a poblaciones no caucásicas, presentan secuencias específicas del gen RHD en el locus RH. Los estudios moleculares indican que en algunos casos el gen RHD se encuentra intacto pero no es funcional, dando origen a un gen silencioso, RHDψ, presente en aproximadamente el 70% de individuos africanos de raza negra.13
El gen RHCE posee diferentes alelos responsables de los polimorfismos C/c y E/e. Los alelos RHC y RHc difieren en un nucleótido en el exón 1 y en 5 nucleótidos en el exón 2, mientras que los alelos RHE y RHe se diferencian por un único cambio de base en el exón 5.3,5,7-9
Genotipificación RH
La determinación de las bases genéticas del sistema Rh permitió el desarrollo de métodos de biología molecular para analizar la presencia del gen RHD en el ADN genómico obtenido de sangre periférica, amniocitos, células trofoblásticas e incluso en ADN fetal obtenido del plasma de mujeres embarazadas RhD negativas.14,15
Las metodologías moleculares descritas son numerosas y varían desde el análisis por PCR de polimorfismos presentes en una única región del gen RHD (exón 7, intrón 4 o la región 3' no codificante) hasta estrategias de PCR multiplex con las que se estudian polimorfismos en todos los exones. Debido a la gran heterogeneidad molecular del locus RHD es conveniente utilizar estrategias de PCR multiplex que permitan el análisis simultáneo de dos regiones diferentes y distantes del gen RHD junto con la presencia del gen RHDψ9,14,16 (figura 3).
El análisis del polimorfismo de nucleótido único (PNU) de los exones 5 y 2 del gen RHCE permite la genotipificación de los alelos RHE/RHe y RHc, respectivamente, mientras que el alelo RHC se detecta por una inserción de 109 pb presente en el intrón 2 de este gen9 (figura 3).
Aspectos clínicos de la genotipificación RH
Los antígenos del sistema Rh son detectados en el laboratorio clínico por técnicas de hemaglutinación que utilizan anticuerpos policlonales y monoclonales con alta sensibilidad y especificidad. Sin embargo, en ciertas situaciones clínicas, la metodología clásica presenta limitaciones y no puede ser utilizada para determinar correctamente el fenotipo Rh.17 La genotipificación RH resulta especialmente adecuada para:18
- estudiar antígenos fetales a partir de células del líquido amniótico en la enfermedad hemolítica fetoneonatal, evitando así el alto riesgo que implica la obtención de sangre periumbilical;
- realizar la tipificación Rh en pacientes con anemia hemolítica autoinmune, cuando la presencia de autoanticuerpos unidos al glóbulo rojo dificulta su determinación serológica;
- determinar el fenotipo Rh en pacientes recientemente transfundidos donde las técnicas de hemaglutinación detectarían los antígenos presentes en los eritrocitos del dador y del receptor;
- tipificar eritrocitos que poseen una expresión alterada del antígeno D (variantes cualitativas o cuantitativas) cuando la serología no es concluyente para decidir la terapia transfusional o la profilaxis con inmunoglobulina anti-D.
En estas situaciones, la investigación del polimorfismo a nivel del ADN permite realizar la genotipificación evitando las limitaciones que presentan los estudios inmunohematológicos. Además, la aplicación de técnicas moleculares es una herramienta útil para el estudio de alelos raros cuya identificación depende de la disponibilidad de antisueros obtenidos de individuos inmunizados.
Enfermedad hemolítica fetoneonatal
La enfermedad hemolítica fetoneonatal es causada por anticuerpos maternos dirigidos frecuentemente contra el antígeno D. El uso generalizado de la profilaxis con inmunoglobulina anti-D ha disminuido considerablemente esta inmunización, sin embargo, aproximadamente uno de cada mil recién nacidos es afectado por la enfermedad hemolítica Rh. Los anticuerpos maternos se forman en respuesta a una aloinmunización por el pasaje de eritrocitos incompatibles a la circulación materna. Las consecuencias clínicas de esta sensibilización pueden conducir a anemia hemolítica fetal, hydrops fetalis, muerte intrauterina o necesidad de parto prematuro. En embarazos posteriores es importante investigar la presencia en los eritrocitos fetales del antígeno D, especialmente cuando el padre es heterocigota. Si el padre no es portador del antígeno D, no existe ningún riesgo de enfermedad hemolítica. Hasta hace poco tiempo, las opciones de tratamiento para embarazadas RhD negativas sensibilizadas incluían procedimientos invasivos como amniocentesis seriadas para predecir la anemia fetal y cordocentesis para la determinación serológica del antígeno D, siendo incorporadas a este grupo pacientes cuyos fetos son RhD negativos. Este abordaje implica riesgos para la continuación del embarazo (0.5% a 1%) y puede aumentar la sensibilización como resultado de hemorragias maternofetales (1% a 2%).1,17,19
La determinación de las bases genéticas del sistema Rh impulsó el desarrollo de métodos diagnósticos moleculares útiles para identificar fetos en riesgo de enfermedad hemolítica fetoneonatal. La gran sensibilidad y exactitud de los ensayos basados en PCR permite la determinación del gen RHD y de alelos del gen RHCE en ADN fetal extraído de células del líquido amniótico.9,14 En nuestro laboratorio diseñamos una estrategia de PCR multiplex para determinar precozmente la presencia del antígeno D en eritrocitos fetales, analizando el ADN obtenido de una única amniocentesis de embarazadas aloinmunizadas.20,21 Esta metodología evita la utilización de métodos diagnósticos invasivos y estrategias terapéuticas expansivas y costosas cuando el feto es RhD negativo. La determinación prenatal del genotipo RHD disminuye el número de pérdidas de embarazo debidas a complicaciones ocasionadas por amniocentesis seriadas y cordocentesis. El beneficio dependerá fundamentalmente del esquema de tratamiento utilizado en los servicios de obstetricia para los casos de aloinmunización materna.22,23
En la población de raza blanca la frecuencia del fenotipo RhD negativo es aproximadamente del 15% y la tasa de padres RhD positivos heterocigotas corresponde al 56%. En el 50% de estos casos, el gen delecionado es transmitido al feto. Con esta incidencia, el 28% de los hijos de madres RhD negativas y padres RhD positivos serían RhD negativos.1 Es importante determinar el fenotipo RhD fetal en los casos de madres RhD negativas sensibilizadas con anti-D. Un feto RhD positivo podría ser afectado por la enfermedad hemolítica fetoneonatal, mientras que los fetos RhD negativos no padecerían esta patología.
Algunos investigadores realizaron la genotipificación RHD prenatal utilizando células fetales obtenidas de la circulación materna, evitando los riesgos asociados con la amniocentesis.24 El principal problema de esta metodología es la utilización de técnicas laboriosas y costosas. Además, se ha observado que las células fetales pueden permanecer en la circulación materna hasta más de 10 años, lo que interfiere en el análisis prenatal de mujeres multíparas.25 Otra alternativa es el estudio de ARNm obtenido de eritrocitos fetales nucleados, pero no se obtuvieron resultados concluyentes con respecto a la confiabilidad del método.26
Recientemente, Lo y col. 15 observaron la presencia de ADN fetal libre en plasma de mujeres embarazadas. Este hallazgo provee una nueva posibilidad para la determinación prenatal del estado RHD fetal en muestras obtenidas por procedimientos no invasivos. Se demostró una elevada proporción de ADN fetal, aproximadamente 3% del ADN libre total, en el plasma de mujeres durante el segundo trimestre de gestación. Este ADN fetal es depurado rápidamente del plasma materno luego del nacimiento, lo cual permite su análisis en mujeres multíparas. La determinación prenatal del genotipo RHD fetal se realiza en muestras de plasma de embarazadas RhD negativas utilizando técnicas de PCR convencional y PCR de tiempo real y se obtienen resultados satisfactorios con ambas metodologías.27
Uno de los últimos avances en la enfermedad hemolítica fetoneonatal es la determinación de la cigosidad del gen RHD en padres RhD positivos. Este estudio se realiza mediante una estrategia de PCR que permite detectar la deleción del gen RHD amplificando específicamente la caja Rhesus híbrida10 (figura 3). Esta determinación molecular es simple y confiable y permite un mejor manejo de embarazadas sensibilizadas.
Anemia hemolítica autoinmuneLa anemia hemolítica autoinmune se debe a una destrucción incrementada de los glóbulos rojos por autoanticuerpos. Este síndrome se caracteriza por un estado hemolítico adquirido asociado a la presencia en plasma o sobre los eritrocitos o ambos, de autoanticuerpos dirigidos contra sus propios antígenos eritrocitarios1.
Los autoanticuerpos que recubren los eritrocitos de los pacientes con anemia hemolítica autoinmune dificultan la correcta tipificación del antígeno D. Los reactivos anti-D con alto contenido proteico pueden dar resultados falsos positivos al producir aglutinación espontánea de los eritrocitos sensibilizados, es necesario disociar el autoanticuerpo sin dañar la integridad de la membrana eritrocitaria ni modificar la expresión del antígeno D. En algunos casos se obtienen resultados incorrectos porque la afinidad del autoanticuerpo es elevada y la elución resulta incompleta.17
La genotipificación RHD resulta un recurso apropiado que permite resolver los problemas planteados por las técnicas inmunohematológicas clásicas.20
Transfusión
La determinación del fenotipo Rh en pacientes recientemente transfundidos presenta algunas dificultades ya que las técnicas de hemaglutinación detectan los antígenos presentes en los eritrocitos del dador y del receptor. La imposibilidad para asignar el fenotipo Rh puede dificultar una correcta identificación de aloanticuerpos, frecuentes en pacientes politransfundidos. La genotipificación RH en esta situación clínica permite identificar correctamente los antígenos presentes en el receptor, facilitando el estudio de anticuerpos irregulares. Esta metodología es útil para la selección de sangre negativa para el antígeno contra el cual está dirigido el aloanticuerpo.28
Expresión alterada del antígeno D
Un pequeño porcentaje de individuos de raza blanca (0.2% a 1%) presentan una expresión reducida del antígeno D sobre los glóbulos rojos, detectada por la prueba de la antiglobulina indirecta. Estas células son clasificadas como D débiles (Du) y representan variantes cuantitativas, o en un menor porcentaje variantes cualitativas (D parciales) del antígeno D. Aproximadamente un 5% de individuos tipificados como D débiles pertenecen en realidad a la categoría DVI y son capaces de producir anticuerpos anti-D de gran importancia clínica.1,17
La discriminación serológica de estos fenotipos es, en la mayoría de los casos, dificultosa, ya que depende fundamentalmente de la sensibilidad y disponibilidad de anticuerpos monoclonales dirigidos contra epitopes específicos de la proteína RhD. Las reacciones serológicas presentan patrones de aglutinación muy débiles y confusos, lo cual dificulta su interpretación. La utilización de técnicas de biología molecular es apropiada para resolver aquellos casos donde la caracterización serológica de los eritrocitos no es concluyente.20
La correcta identificación de los fenotipos con expresión aberrante de la proteína RhD es de gran utilidad en medicina transfusional. Los glóbulos rojos RhD positivos débiles podrían estimular una inmunización anti-D en personas RhD negativas. Además, es importante la caracterización del fenotipo DVI en receptores, ya que estos individuos deben recibir sangre RhD negativa para evitar la formación de aloanticuerpos dirigidos contra el antígeno D. Por esta misma razón, las mujeres embarazadas con fenotipo DVI deben realizar la profilaxis con inmunoglobulina anti-D.
Conclusiones
La reacción en cadena de la polimerasa es un método molecular de gran utilidad que permite resolver las limitaciones que presentan las técnicas clásicas de hemaglutinación. Ambas metodologías, utilizadas en conjunto, permiten el diagnóstico precoz de la incompatibilidad Rh fetomaterna y la elección terapéutica adecuada para prevenir la aloinmunización materna. La genotipificación molecular también resulta apropiada para la determinación de antígenos de grupos sanguíneos en pacientes con anemia hemolítica autoinmune por anticuerpos calientes y en pacientes politransfundidos. Además es una herramienta útil para la selección de unidades de sangre compatible en pacientes aloinmunizados y para la tipificación de glóbulos rojos con expresión alterada del antígeno D.
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Mollison PL, Engelfreit CP, Contreras M. Blood Transfusion in Clinical Medicine, 10th Edition, Blackwell Scientific Publications: Oxford, 1997.
- Colin Y, Chérif-Zahar B, Le Van Kim C y col. Genetic basis of the RhD-positive and RhD-negative blood group polymorphism as determined by southern analysis. Blood 1991; 78:2747-2752.
- Avent ND, Reid ME. The Rh blood group system: a review. Blood 2000; 95:375-387.
- Cartron J, Bailly P, Le Van Kim C. Insights into the structure and function of membrane polypeptides carrying blood group antigens. Vox. Sang 1998; 74: 29-64.
- Wagner F, Gassner C, Müller T y col. Molecular basis of weak D phenotypes. Blood 1999; 993:385-393.
- Avent N. A new chapter in Rh research: Rh proteins are ammonium transporters. Trends Mol Med 2001; 7:94-96.
- Okuda H, Suganuma H, Kamesaki T y col. The analysis of nucleotide substitutions, gaps and recombination events between RHD and RHCE genes through complete sequencing. Biochem Biophys Res Commun 2000; 274:670-683.
- Huang C, Liu P, Cheng J. Molecular biology and genetics of the Rh blood group system. Semin Hematol 2000; 37:450-165.
- Avent N. Molecular biology of the Rh blood group system. J Pediatr Hematol Oncol 2001; 23:394-402.
- Wagner FF, Flegel WA. RHD gene deletion occurred in the Rhesus box. Blood 2000; 95:3662-3668.
- http://www.uni-ulm.de/%7Ewflegel/RH/
- http://www.bioc.aecom.yu.edu/bgmut/rh.htm
- Singleton B, Green C, Avent N. An RHD pseudogene containing a 37 bp duplication and a nonsense mutation is present in most Africans with the RhD negative blood group phenotype. Blood 2000; 95:12-18.
- Flegel W, Wagner F, Müller T y col. Rh phenotype prediction by DNA typing and its application to practice. Transfus Med 1998; 8:281-302.
- Lo YMD, Corbetta N, Chamberlain PJ. Presence of fetal DNA in maternal plasma and serum. Lancet 1997; 350:485-487.
- Flegel W, Wagner F. Molecular genetics of RH. Vox Sang 2000; 78:109-115.
- Walker RH. Technical Manual,11th Edition. American Association of Blood Banks: Bethesda, 1993.
- Cotorruelo C, Biondi C, García Borrás S y col. Clinical aspects of Rh genotyping. Clin Lab 2002; 48:271-281.
- Nicolini U, Kochenour N, Greco P. Consequences of fetomaternal hemorrhage after intrauterine transfusion. Br Med J 1998; 297:1379-1381.
- Cotorruelo C, Biondi C, García Borrás S y col. Molecular determination of RhD phenotype by DNA typing. Clinical applications. Ann Clin Bioch 2000; 37:781-789.
- Chan FY, Cowley NM, Wolter L y col. Prenatal RHD gene determination and dosage analysis by PCR: clinical evaluation. Prenat Diagn 2001; 24:321-326.
- Cotorruelo C, Biondi C, García Borrás S y col. Early detection of RhD status in pregnancies at risk of hemolytic disease of the newborn. Clin Exp Med 2002; 2:77-81.
- Cotorruelo C, Biondi C, García Borrás S y col. Genotipificación del sistema Rh en líquido amniótico. Medicina 2001; 61:76-78
- Geifman-Holtzman O, Bernstein I, Berry SM y col. Fetal RhD genotyping in fetal cell flow sorted from maternal blood. Am J Obstet Gynecol 1996; 174:818-822.
- Bianchi D, Zickwolf G, Weil G y col. Male fetal progenitor cells persist in maternal blood for as long as 27 years postpartum. Proc Natl Acad Sc. USA 1996; 93:705-708.
- Hamlington J, Kunningham J, Mason G y col. Prenatal detection of rhesus D genotype. Lancet 1997; 349:540.
- Lo YMD. Fetal DNA in maternal plasma: biology and diagnostic application. Clin Chem 2000; 46:1903-1906.
- Reid ME, Rios M, Powell VI y col. DNA from blood samples can be used to genotype patients who had recently received a transfusion. Transfusion 2000; 40:48-53.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:

