BENZNIDAZOL Y ETANIDAZOL LIPOSOMALES: EXPECTATIVAS DE ACCION ANTICHAGASICA
(especial para SIIC © Derechos reservados)
Coautor
María José Morilla*
Profesora. Universidad Nacional de Quilmes*
Recepción del artículo: 12 de mayo, 2004
Aprobación: 11 de agosto, 2004
 Conclusión breve
Los liposomas sensibles al pH son un ejemplo claro de la aplicación de la nanotecnología para el abordaje de patologías infecciosas, mediante la preparación de fármacos capaces de ingresar selectivamente en grupos celulares infectados, así como en compartimentos intracelulares donde se encuentren agentes infecciosos.
Conclusión breve
Los liposomas sensibles al pH son un ejemplo claro de la aplicación de la nanotecnología para el abordaje de patologías infecciosas, mediante la preparación de fármacos capaces de ingresar selectivamente en grupos celulares infectados, así como en compartimentos intracelulares donde se encuentren agentes infecciosos.
 Resumen
En los últimos diez años, la profundización del conocimiento de las propiedades de autoensamblaje de bloques moleculares en escala nanométrica, así como de los aspectos relativos a la interacción entre materiales bio-inorgánicos y órganos, células y compartimientos intracelulares in vivo, permitió planear el diseño de nanomáquinas que funcionen en entornos fisiológicos y respondan a estímulos programados. Los liposomas sensibles al pH son un ejemplo claro de la aplicación de la nanotecnología para el abordaje de patologías infecciosas, mediante la preparación de fármacos capaces de ingresar selectivamente en grupos celulares infectados, así como en compartimentos intracelulares donde se encuentren agentes infecciosos. En este artículo describiremos nuestra experiencia, decepciones y esperanza en la búsqueda de una estrategia terapéutica contra la enfermedad de Chagas. Desde el diseño de liposomas multilamelares para transportar benzonidazol, que no fueron capaces de erradicar infecciones experimentales in vivo, hasta liposomas unioligolamelares sensibles al pH para transportar etanidazol, que demostraron ser efectivos in vivo aun en dosis inferiores a 200 veces el etanidazol libre, se recorrió un camino promisorio que aún no ha alcanzado su total potencialidad.
Resumen
En los últimos diez años, la profundización del conocimiento de las propiedades de autoensamblaje de bloques moleculares en escala nanométrica, así como de los aspectos relativos a la interacción entre materiales bio-inorgánicos y órganos, células y compartimientos intracelulares in vivo, permitió planear el diseño de nanomáquinas que funcionen en entornos fisiológicos y respondan a estímulos programados. Los liposomas sensibles al pH son un ejemplo claro de la aplicación de la nanotecnología para el abordaje de patologías infecciosas, mediante la preparación de fármacos capaces de ingresar selectivamente en grupos celulares infectados, así como en compartimentos intracelulares donde se encuentren agentes infecciosos. En este artículo describiremos nuestra experiencia, decepciones y esperanza en la búsqueda de una estrategia terapéutica contra la enfermedad de Chagas. Desde el diseño de liposomas multilamelares para transportar benzonidazol, que no fueron capaces de erradicar infecciones experimentales in vivo, hasta liposomas unioligolamelares sensibles al pH para transportar etanidazol, que demostraron ser efectivos in vivo aun en dosis inferiores a 200 veces el etanidazol libre, se recorrió un camino promisorio que aún no ha alcanzado su total potencialidad.
 Palabras clave
Enfermedad de Chagas, nanotecnología, liposomas
Clasificación en siicsalud
Palabras clave
Enfermedad de Chagas, nanotecnología, liposomas
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/68472
Especialidades
 Principal: Infectología,
Principal: Infectología,
 Relacionadas: Bioquímica, Farmacología, Medicina Interna,
Relacionadas: Bioquímica, Farmacología, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Eder Lilia Romero. Universidad Nacional de Quilmes, Departamento de Ciencia y Tecnología, Roque Sáenz Peña 180, Bernal B1876BXD, Buenos Aires, Argentina Romero, Eder Lilia
BENZNIDAZOL Y ETANIDAZOL LIPOSOMALES: EXPECTATIVAS DE ACCION ANTICHAGASICA
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción: ¿nanotecnología aplicada a terapias antiparasitarias
La nanotecnología comprende la manipulación de bloques atómicos o moleculares para generar objetos en la escala de nanotamaños, esto es entre 0.1 y 100 nanómetros. La selección adecuada de los componentes y de la técnica de preparación permite controlar exquisitamente el tamaño, forma, propiedades superficiales y capacidad de respuesta de estas "nanomáquinas" ante condiciones ambientales o señales externas. En otras palabras, la nanotecnología permite diseñar nanomáquinas inteligentes de distintos grados de complejidad, de acuerdo con cada necesidad.1,2
Por otro lado, al presente, las modificaciones químicas o enzimáticas sobre fármacos han conseguido muy poco acerca de un punto clave: llegar en tiempo y forma al sitio donde se los requiere. Es insoslayable que para ejercer su acción los fármacos deben atravesar una serie de compartimientos y barreras tridimensionales que en los cultivos celulares no existen. Es por eso que en los últimos años ha aparecido como rama más nueva de la farmacología un sólido conjunto de estrategias conocido como sistemas de liberación controlada de fármacos (SLCF).
Básicamente, un SLCF puede ser cualquier macroestructura, microestructura o nanoestructura que permita la incorporación en su interior o en su superficie de una determinada cantidad de moléculas de fármaco. Los SLCF actualmente disponibles varían en grado de complejidad e idealmente, luego de su incorporación a un SLCF, es posible modular la llegada espacio-temporal del fármaco a un tejido, órgano, célula o compartimento intracelular determinado. Sin embargo, los parches dérmicos, implantes o bombas osmóticas macroscópicas, considerados SLC convencionales, sólo permiten regular la farmacocinética del fármaco incorporado. En cambio la nanotecnología ofrece la posibilidad de preparar SLCF más elaborados, tales como nanoestructuras capaces de circular en sangre, ingresar en determinados grupos celulares y responder a señales del entorno inmediato (pH, fuerza iónica, temperatura) o externas (radiofrecuencia, ultrasonido) liberando el fármaco transportado a un sitio particular.3 Así, los SLCF de manufactura nanotecnológica como liposomas, nanopartículas lipídicas sólidas y dendrímeros permiten controlar no solo la farmacocinética sino también la biodistribución, factores clave para acceder a blancos intracelulares en forma efectiva. Mediante este control es posible otorgar al fármaco incorporado las siguientes ventajas: a) aumento de selectividad, b) protección frente a la metabolización/eliminación innecesaria, c) acceso bloqueado a tejidos donde no es requerido, d) disminución de dosis sistémicas versus e) liberación masiva de fármaco en el lugar elegido; en otras palabras, es posible aumentar el índice terapéutico del fármaco original. Debe remarcarse además que todo fármaco incorporado a un SLC constituye una nueva entidad molecular que posibilita su propio patentamiento; esto significa expansión del mercado farmacéutico para drogas extremadamente tóxicas, potentes, inestables en medios biológicos, hidrofóbicas o de muy alto peso molecular (como proteínas o ácidos nucleicos) sintetizadas por ingeniería genética o química computacional.
En la actualidad, la veloz emergencia y reemergencia de enfermedades infecciosas, muchas de ellas endémicas o propias del creciente grupo de pacientes inmunodeprimidos por quimioterapia o radiación, trasplantes o sida, se enfrenta con el lentísimo o nulo avance en el desarrollo e investigación de nuevos agentes antiinfecciosos. Un aspecto compartido por muchos de estos fármacos es la escasa efectividad, que conlleva la administración de dosis elevadas o muy frecuentes, efectos tóxicos colaterales, necesidad de hospitalización aparejado al encarecimiento del tratamiento. El problema es más difícil de abordar si el agente infeccioso tiene localización intracelular y es un parásito que cumple parte de un ciclo complejo en el huésped humano. Los fármacos antiparasitarios son, por ejemplo, candidatos ideales para ser incorporados a SLC de corte nanotecnológico que provean todas las ventajas y posibilidades enunciadas anteriormente.
El abordaje del diseño de un SLCF contra la enfermedad de Chagas
La enfermedad de Chagas es endémica en varios países de América Latina; afecta entre 16 y 18 millones de personas, y existen más de 100 millones en riesgo de infección.4 La enfermedad es causada por el protozoario hemoflagelado Trypanosoma cruzi, que alcanza la circulación sanguínea del huésped humano luego de la picadura y deyección del insecto vector (el triatomino hematófago conocido como vinchuca en Argentina). A pesar de la importancia epidemiológica de esta enfermedad, actualmente el único agente terapéutico disponible es el 2-nitroimidazol benzonidazol (BNZ) (N-benzil-2-nitro-1-imidazol-acetamida). El BNZ es efectivo en fase aguda, en infección crónica reciente (niños menores de 12 años) y en infecciones congénitas, pero tiene muy poco o nada de actividad en la fase crónica.5 Asimismo, se informaron efectos tóxicos colaterales graves durante su uso clínico, como polineuritis, linfoadenopatía, dermatitis y depresión de médula ósea.6 Como consecuencia de las reacciones adversas, frecuentemente los tratamientos deben ser discontinuados.7,8 Existe evidencia experimental sobre la aparición de efectos mutagénicos y carcinogénicos, a pesar de la falta de información acerca de los tratamientos a largo plazo en humanos.9 Además, en el creciente número de casos de reactivación por inmunosupresión debido a sida o a trasplante de órganos, aún no hay consenso sobre la efectividad del uso de BNZ.10,11
El BNZ es un fármaco que carece de selectividad por tejido alguno, ya que luego de su absorción intestinal y una vez en la circulación sanguínea se une a proteínas plasmáticas y células sanguíneas y se distribuye uniformemente en una variedad de tejidos.12,13 Estudios de amplificación por PCR han mostrado que el uso de BNZ no conduce a cura parasitológica en tratamientos crónicos,14 así como faltan resultados convincentes acerca de la capacidad del BNZ para erradicar amastigotes intracelulares: in vivo, el BNZ elimina rápida y eficientemente los parásitos circulantes (tripomastigotes), pero su actividad es considerablemente menor contra la forma crónica de la enfermedad, en la que solo se hallan amastigotes,5 a pesar de que in vitro el BNZ es efectivo para eliminar los estadios intracelulares. Deben prescribirse elevadas dosis de BNZ administrado por vía oral para conseguir niveles terapéuticos en sangre, lo que conlleva a toxicidad sistémica y es probable que independientemente de su actividad antitripomastigotes, la ausencia de selectividad dificulte la llegada del BNZ al interior citoplasmático de tejidos infectados, en cantidades lo suficientemente elevadas como para eliminar amastigotes. Por lo tanto, un incremento de la selectividad por los tejidos infectados (especialmente necesaria para la eliminación de las formas intracelulares), mediado por un mecanismo que facilitara la liberación masiva de BNZ en el citoplasma y que además redujera las dosis totales administradas (menor toxicidad), sería ideal para mejorar los resultados de la terapia actual.
La primera generación de SLCF antichagásicos: el diseño de MLV-BNZ con selectividad por el hígado no afectó la parasitema de ratones con infección aguda
Con el objetivo de investigar si la selectividad del BNZ por el hígado podría incrementarse por medio de su incorporación a un SLCF liposomal, en un trabajo preliminar de nuestro laboratorio diseñamos y ensayamos in vitro el desempeño farmacológico del BNZ incorporado a vesículas multilamelares [multilamellar vesicles (MLV-BNZ)].15 En un segundo trabajo,16 determinamos la biodistribución de BNZ luego de la administración parenteral de un bolo de MLV-BNZ sobre ratas sanas, y a continuación evaluamos el impacto de tal estrategia sobre la parasitema de un modelo agudo murino de enfermedad de Chagas. A continuación comentaremos brevemente los resultados del segundo trabajo.
Racionalización de la inyección e.v. de formulaciones liposomales
Un punto extremadamente importante en el diseño de experimentos in vivo que empleen inyecciones e.v. es evitar posibles efectos tóxicos como consecuencia del ingreso de suspensiones de liposomas en la escala de tamaños microscópicos o nanoscópicos al torrente sanguíneo. Para ello, deben definirse cuidadosamente la cantidad de lípido liposomal/kg peso corporal y el volumen del bolo inyectado. Obviamente, ambas cantidades dependen de la concentración lipídica de la suspensión liposomal original y se calculan sobre la base de datos empíricos. Esto significa que la masa máxima de fármaco liposomal dependerá estrictamente de la relación fármaco/lípido y de la concentración lipídica de la suspensión liposomal; tal cantidad de fármaco a inyectarse no deberá ser superada, en razón de la potencial aparición de efectos tóxicos causada por la estructura vesicular que lo contiene. En primer lugar, la máxima cantidad de lípido liposomal/kg no deberá exceder los valores por encima de los cuales se pueda producir un bloqueo del sistema retículo endotelial. Por ejemplo, esto puede calcularse sobre la base de datos de Olson y col.,17 quienes para una única inyección e.v. de MLV (fosfatidilcolina/colesterol) reportaron una LD50 de 7.2 g/kg; debe tenerse en cuenta además que 0.5 ml y 0.2 ml son los máximos volúmenes recomendados para inyecciones e.v. en ratas y ratones, respectivamente.18 Por lo tanto, para la suspensión de 30 a 20 μmol/ml de lípidos totales de MLV-BNZ empleada en nuestros ensayos, un volumen de inyección de 0.4 ml resultó una dosis segura de 30 mg de lípidos/kg, lo que fijó una dosis máxima de 0.2 mg BNZ/kg a inyectar en ratas, en tanto que los ratones infectados se inyectaron con 0.1 ml a una dosis de 0.4 mg BNZ/kg. De nuevo, es importante remarcar que de acuerdo con nuestros cálculos, que tuvieron en cuenta la posibilidad de bloqueo del sistema retículo endotelial, el volumen y la frecuencia de inyecciones endovenosas en modelos animales (una frecuencia mayor a tres veces por semana causa importantes traumas tisulares locales en ratones), la máxima dosis permitida de BNZ liposomal fue 500 veces menor que la suministrada a animales en los procedimientos experimentales estándar (100 mg/kg en ratones) y unas 40 veces menor que la suministrada a humanos en regímenes terapéuticos por vía oral (humanos adultos 5 a 7.5 mg/kg).
El incremento de la acumulación de MLV-BNZ en el hígado no fue suficiente para disminuir la parasitemia de ratones infectados
Nuestro esquema experimenal consistió en inyectar en ratas un bolo único de MLV-BNZ por tres rutas parenterales: i.m., s.c. y e.v. Los niveles sanguíneos de BNZ se determinaron a lo largo de 9 horas p.i., así como la biodistribución de BNZ fue determinada a las 4 y 9 hs p.i.; sobre esa base podríamos seleccionar las rutas conducentes a una acumulación de BNZ en hígado superior a la obtenida al inyectar BNZ libre e.v. A continuación, determinaríamos su influencia sobre la infección producida por la cepa RA de T. cruzi en ratones.
En primer lugar, los resultados indicaron que la administración endovenosa de un bolo único tanto de BNZ libre o de MLV-BNZ por las rutas i.m. o s.c. no permitió incrementar la acumulación en hígado por encima de los niveles alcanzados luego de la administración e.v. del BNZ libre. El gran tamaño promedio (por encima de los 100 nm) de los liposomas inyectados por las rutas i.m. o s.c, impide la extravasación a la sangre de las partículas liposomales19 y es factible que únicamente el BNZ libre alcanzara la circulación. El pico de BNZ en sangre, primero resultante de la administración s.c. y una hora más tarde de la administración i.m. de MLV-BNZ, indicó la liberación de BNZ a partir de un depósito tisular de liposomas. Este efecto "burst" estuvo ausente luego de la administración i.m. o s.c. de BNZ libre. En cambio, si bien estudios previos de biodistribución de BNZ (luego de la administración oral o parenteral) indicaron la ausencia de captura selectiva por parte de tejido alguno en particular,13 luego de la administración e.v. de MLV-BNZ, se registró una acumulación tres veces mayor de BNZ en el hígado con respecto a la alcanzada luego de la administración e.v. de BNZ libre. Es sabido que la existencia de barreras anatómicas (fenestraciones endoteliales de 150 nm de diámetro) impide el acceso de todo material particulado (caso del MLV-BNZ, con tamaño promedio 2 μm) a los hepatocitos.20 Es factible, por tanto, que luego de la inyección e.v. de MLV-BNZ los liposomas fueran principalmente fagocitados por las células de Kupffer (CK) y que se hubiera obtenido un incremento de la liberación masiva a este tipo celular (80% a 90% de todos los macrófagos fijos del cuerpo).21 Sin embargo, nuestros resultados indicaron que para el régimen empleado en nuestro estudio y sobre el modelo de infección aguda producido por la cepa RA de T. cruzi, la relación entre selectividad incrementada por el hígado por administración e.v. de MLV-BNZ tres veces por semana y el subsiguiente efecto terapéutico, en ratones, no fue directa. A pesar de que las CK fueron uno de los principales tipos celulares colonizados, la infección, medida como parasitemia de ratones infectados, no descendió en respuesta al aumento de la acumulación de MLV-BNZ en el hígado.
La búsqueda de un fármaco alternativo al BNZ
Si bien el BNZ es un fármaco antiparasitario no muy bien tolerado ni efectivo, desde hace unos diez años se está explorando la actividad quimiorradiosensibilizadora y como marcadora de hipoxia de otros 2-nitroimidazoles, entre ellos el etanidazol (ETZ). Los 2-nitroimidazoles son metabolizados tanto por nitrorreductasas insensibles al oxígeno como por nitrorreductasas microsomales anaeróbicas y en el caso de BNZ los mecanismos responsables de su actividad antiparasitaria también lo son de su toxicidad sobre células de mamíferos. Por el contrario, el ETZ, en comparación con otros 2-nitroimidazoles, demostró ser menos tóxico in vivo.22 Asimismo, se sabe que moléculas con actividad biorreductiva basada en poseer grupos de transferencia electrónica, que experimentan un primer paso de reducción monoelectrónica intracelular (formación del radical nitroanión con reoxidación al 2-nitroimidazol original) o sucesivas reducciones secuenciales de a dos electrones tienen actividad anti-T. cruzi. El ETZ, dada su actividad marcadora de hipoxia y quimiorradiosensibilizadora, probablemente fuera metabolizado por nitrorreductasas anaeróbicas. A la luz de esta posibilidad, en un trabajo conjunto con investigadores del Grupo de Virología del Hospital de Niños Ricardo Gutiérrez, investigamos la actividad antiparasitaria del ETZ in vitro. El ETZ resultó poseer actividad letal tanto contra tripomastigotes aislados como contra amastigotes de T. cruzi (cepa RA) crecidos en células Vero o en macrófagos J774.23 Además, los ensayos de citotoxicidad mostraron que el efecto tripanocida específico del ETZ no afectaba la viabilidad de las células huésped. La actividad antiparasitaria comparada, medida como LD50 a las 24 y 48 horas de incubación con tripomastigotes fue de 174 μM y 18 μM para ETZ y de 6.6 y 2.8 μM para BNZ; la IC50 para amastigotes en cultivo de células Vero y macrófagos J774 fue de 40 y 15 μM para ETZ, respectivamente, en tanto que fue de 1.7 y 1 μM para BNZ. Por lo tanto, aun con menor actividad en comparación con el fármaco tradicional BNZ, hallamos una aplicación completamente diferente para el ETZ, que hasta ahora sólo fuera usado en pruebas clínicas de quimioterapia antitumoral humana.
La segunda generación de SLCF antichagásicos: de MLV a LUV sensibles al pH
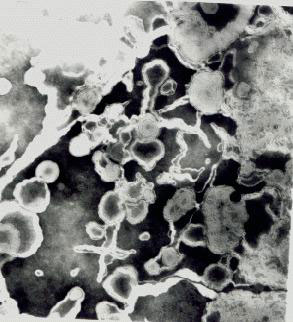
En el segundo trabajo vimos que a pesar de su mayor acumulación en el hígado los MLV-BNZ eran retenidos en el sistema endolisosomal, desde donde el BNZ debería permear el citoplasma para ejercer su acción. A pesar de la probada actividad tripanocida, de la naturaleza hidrofóbica y de la poca capacidad para formar puentes de hidrógeno del BNZ (factores que deberían favorecer la permeación de BNZ a través de la membrana lisosomal), al ser administrado como MLV-BNZ e.v. no se registró actividad antiparasitaria en los modelos experimentales in vivo, probablemente a consecuencia de la retención del BNZ en el interior endolisosomal, como ya manifestamos. En vista de ello, decidimos diseñar una nueva estrategia que impidiera la retención del fármaco en el sistema endolisosomal y que a la vez permitiera su llegada masiva al citoplasma. Por un lado, como sistema transportador de fármacos elegimos liposomas sensibles al pH, que son nanoestructuras capaces de experimentar una transición de fase desde lamelar a hexagonal HII en respuesta a la acidificación del medio; la fusión resultante, entre membranas liposomales y de lisosomas, podría permitir la apertura de un canal entre lisosomas y citoplasma. Por otra parte, en virtud de su mayor hidrofilia, menor toxicidad y actividad antiparasitaria, el ETZ resultó ser candidato ideal para ser incorporado como fármaco antiparasitario en tales liposomas, ya que no se particiona en bicapas y permanece disuelto en los medios acuosos. La relación ETZ/lípidos totales de vesículas unilamelares grandes (large unilamellar vesicles) conteniendo ETZ (LUV-ETZ) obtenidos fue 14 ± 3% p/p, una relación 20 veces mayor que la correspondiente a MLV-BNZ, de 0.7%. Las LUV-ETZ se observaron por microscopia electrónica (figura 1) y su tamaño, determinado por dispersión dinámica de luz, resultó ser de unos 500 nm. Luego se verificó el comportamiento sensible al pH de las LUV-ETZ por microscopia de fluorescencia, incubando LUV-ETZ que contenían una sonda fluorescente sensible al pH (HPTS) en su espacio acuoso interno a diversos pH. A diferencia de los MLV-BNZ (insensibles al pH), para las LUV-ETZ se observó la pérdida de la integridad de las membranas al descender desde la neutralidad hasta el pH 5.5; el desencadenamiento de cambio de fase en respuesta a un descenso del pH tuvo lugar en un rango del orden de décimos en escala de pH. Este hecho nos permitió pensar en la posibilidad de una liberación masiva de fármacos hidrofílicos que estuvieran disueltos en el interior de LUV sensibles al pH en el citoplasma celular.
Captura y seguimiento de la ruta intracelular
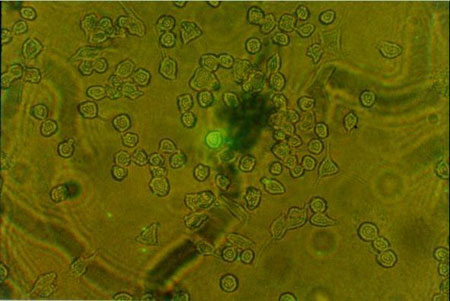
A continuación, también por microscopia de fluorescencia, se estudió in vitro la fagocitosis y la ruta intracelular de las LUV-ETZ. Se incubaron LUV-ETZ que contenían la HPTS en su compartimento acuoso, con macrófagos de la línea J774. Luego de la excitación a 440 nm, la emisión registrada como puntual y de baja intensidad indica que la HPTS se encuentra en un compartimento ácido (HPTS confinado al endosoma/lisosoma) mientras que una emisión homogéneamente distribuida y de alta intensidad indica que la HPTS se halla en un medio neutro (citosol). Los resultados indicaron que la HPTS fue liberada al citoplasma de los macrófagos luego de un tiempo mínimo de incubación liposomas-células de 15 minutos (figura 2), mientras que liposomas de composición insensibles al pH, si bien fueron fagocitados por los macrófagos del mismo modo que los liposomas sensibles al pH, se mantuvieron confinados al sistema endolisosomal sin evidencias de "escape" del contenido acuoso al citosol. Estos resultados confirmaron el comportamiento de la formulación sensible al pH, así como la capacidad de liberación de la droga hidrosoluble al citosol.
En la actualidad, ensayos preliminares in vivo indicaron que las LUV-ETZ administradas e.v. tres veces por semana a ratones infectados con la cepa RA de T.cruzi disminuyeron significativamente la parasitemia, mientras que dosis 200 veces mayores de ETZ libre no tuvieron efecto alguno. Estos resultados son muy alentadores ya que ésta parece ser la primera indicación de que el uso de un SLCF produce un aumento de la efectividad en comparación con el fármaco libre.
Conclusiones
Este es el momento de preguntarse acerca de la factibilidad de utilizar un SLCF nanotecnológico para tratar una población de bajos recursos económicos y bajo nivel cultural, como la aquejada por las llamadas infecciones huérfanas, como la enfermedad de Chagas y la leishmaniasis. Creemos que la respuesta a este interrogante es doble. Por un lado es claro que varios grupos de investigación en la región poseemos el conocimiento y la tecnología necesaria para producir liposomas de calidad farmacéutica que podrían conservarse como polvos liofilizados y reconstituirse en cualquier lugar en el momento de su utilización. Podría explorarse además el uso de otras vías alternativas que no requieran administración parenteral (oral, nasal). Pero por otro lado es evidente que los intereses privados y, por el momento los gubernamentales, no están dirigidos a solucionar los problemas sanitarios de poblaciones con bajos recursos. Una de las actividades estatales más esperadas es el estímulo y la difusión de los trabajos de investigación llevados a cabo en las universidades locales, para afianzar el conocimiento de este campo a nivel regional, ya que a diferencia de los fármacos convencionales, el desarrollo de SLCF requiere un know how que no se ha consolidado aún en la Argentina y que se monopoliza desde el exterior. El importantísimo problema de los altos costos de estos medicamentos, que los hace inaccesibles a la población de bajos recursos económicos, podría enfrentarse con el apoyo del Estado en forma de subvenciones a emprendimientos de producción industriales a nivel local; por lo mencionado anteriormente, en este tipo de emprendimiento biotecnológico el lazo industria-academia es imperativo.
Es importante comprender que el seguimiento del cumplimiento y la evolución del tratamiento de los pacientes con enfermedad de Chagas (en general niños menores de 12 años, distribuidos en áreas rurales muy extensas) es muy difícil para el médico, ya que el régimen terapéutico requiere tres tomas diarias del fármaco durante 30 a 60 días; tampoco es fácil evaluar la cura a largo plazo (varios años). En este contexto, la posibilidad que ofrecen los resultados obtenidos con los liposomas sensibles al pH merece profundizarse más. Si futuros estudios demuestran su efectividad con ausencia de efectos tóxicos, podría reemplazarse un esquema de tratamiento completo de 180 tomas (3 diarias durante 60 días) por 1 o 2 inyecciones de un SLCF. Un régimen de esta naturaleza no solo podría evitar que los pacientes rurales (áreas alejadas) abandonaran el tratamiento, sino que contribuiría al control de la propagación de la enfermedad.
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- West J, Halas NJ. Applications of nanotechnology to biotechnology. Current Opinion in Biotecnology 2000, 11, 215-217.
- Sahoo SK, Labhasetwar V. Nanotech approaches to drug delivery and imaging. Drug Discovery Today 2003, vol 8, n 24, 1112-1120.
- LaVan DA, McGuire T, Langer R. Small-scale systems for in vivo drug delivery. Nature Biotechnology 2003, vol 21, n 10, 1184-1191.
- World Health Organization 1997. Chagas disease. Thiteenth programme report UNDP/TDR, Geneve.
- Coura JR, De Castro SL. A critical review on Chagas disease chemotherapy. Mem. Inst. Oswaldo Cruz 2002, 97 (1), 3-24.
- Cançado JR. Long term evaluation of etiological treatment of Chagas' disease with benznidazole. Rev. Inst. Med. trop. Sao Paulo 2002, 44, 29-37.Docampo R, Moreno SN. Biochemical toxicology of antiparasitic compounds used in the chemotherapy and chemoprophylaxis of American Trypanosomiasis (Chagas' disease). Rev. Biochem. Toxicol. 1985, 7, 159-204.
- Castro JA, Díaz de Toranzo EG. Toxic effects of nifurtimox and benznidazole, two drugs used against American Trypanosomiasis (Chagas' disease). Biomed. Environ. Sci. 1988, 1, 19-33.
- Castro JA. Contributions of toxicology to the problem of Chagas' disease (American Trypanosomiasis). A year 2000 update. Biomed. Environ. Sci. 2000, 13, 271-279.
- Bocchi EA, Higuchi ML, Vieira J y col. Higher incidence of malignant neoplasms after heart transplantation for treatment of chronic Chagas' heart disease. Heart Lung Transplant. 1998, 17(4), 399-405.
- Andrade SG, Mesquita IM, Jambeiro JF y col. Treatment with benznidazole in association with immunosuppressive drugs in mice chronically infected with Trypanosoma cruzi: investigation into the possible development of neoplasias. Rev. Soc. Bras. Med. Trop. 2003, 36(4), 441-447
- Barclay CA, Cerisola JA, Lugones HO y col. Aspectos farmacológicos y resultados terapéuticos del benznidazol en el tratamiento de la infección chagásica. Pres. Méd. Argent. 1978, 65, 239-244
- De Toranzo EG, Masana M, Castro JA. Distribución del benznidazol administrado oralmente en los diferentes tejidos de ratas macho. Acta Bioquimica Clinica Latinoamericana 1986, XX (1) 61-64.
- Braga MS, Lauria-Pires L, Argañaraz ER y col. Persistent infections in chronic Chagas' disease patients treated with anti-Trypanosoma cruzi nitroderivatives. Rev. Inst. Med. Trop. S. Paulo 2000, 42 (3), 157-161.
- Morilla MJ, Benavídez P, López MO y col. Development and in vitro characterisation of a benznidazole liposomal formulation. Int. J. Pharm. 2002, 249 (1-2), 89-99
- Morilla MJ, Montanari JA, Prieto MJ y col. Intravenous liposomal benznidazole as trypanocidal agent: increasing drug delivery to liver is not enough. Int. J. Pharm. (en prensa)
- Olson F, Mayhew E, Marlow D y col. Characterization, toxicity and therapeutic efficacy of adriamycin encapsulated in liposomes. Eur. J. Cancer Clin. Oncol. 1982, 18, 167-176.
- Flecknell PA. Laboratory Animal Anesthesia, an Introduction for research workers and technicians, 1987, Academic press, Florida.
- Oussoren C, Zuidema J, Crommelin DJ y col. Lymphatic uptake and biodistribution of liposomes after subcutaneous injection. II Influence of liposomal size, lipid composition and lipid dose. Biochim. Biophys. Acta 1997, 1328, 261-272.
- Brouwer A, Wisse E, Knook DL. Sinusoidal endothelial cells and perinsinusoidal fat-storing cells. In: Arias IM, Boyer JL, Fausto N, Jakoby WB, Schachter DA, Shafritz DA (eds.), The Liver: Biology and Pathobiology, Second Edition, 1988. Raven Press, New York, pp 665-682.
- Kuiper J, Brouwer A, Knook DL y col. Kupffer and sinusoidal endothelial cells. In: Arias IM, Boyer JL, Fausto N, Jakoby WB, Schachter DA, Shafritz DA (eds.). The Liver: Biology and Pathobiology, Third Edition, 1994. Raven Press, New York, pp. 791-818.
- Hurtwitz SJ, Coleman CN, Riese N y col. Distribution of etanidazole into human brain tumors-Implications for treating high grade gliomas. Int J Radiat Oncol Biol Phys 1992, 22, 573-576.
- Petray PB, Morilla MJ, Corral RS y col. In vitro activity of etanidazole against the protozoan parasite Trypanosoma cruzi. Mem. Inst. Oswaldo Cruz (en prensa).
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:
