




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: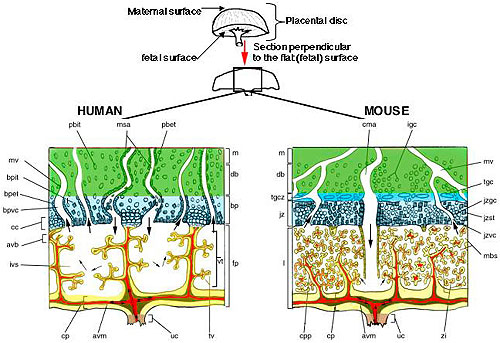
Figura 1. Diagrama que representa en forma simplificada las principales regiones y tipos celulares de la placenta definitiva del humano y el ratón. El área verde representa el lecho placentario en humanos y la decidua basal en el ratón (dp). La región celeste muestra la placa basal humana (bp) y la zona de unión murina (jz). La zona azul brillante en el ratón representa la zona de células gigantes trofoblásticas (tgcz). No está claro aún si existen células análogas a las células gigantes trofoblásticas en los seres humanos.1 Las áreas amarillas muestran el trofoblasto de la placenta fetal humana (fp) y el trofoblasto del laberinto murino (l). Los espacios blancos representan la sangre materna y los espacios rojos la sangre fetal. Las flechas dentro de estos espacios muestran la dirección de la circulación sanguínea. Para más información acerca de las diversas estructuras placentarias aquí presentadas, el lector debería consultar el reciente trabajo publicado por Georgiades y col.1 Avb, rama de vellosidades de anclaje; avm, vasculatura alantoidea y mesénquima; bp, placa basal; bpet, trofoblasto endovascular de la placa basal; bpit, trofoblasto intersticial de la placa basal; bpvc, canal venoso de la placa basal; cc, columna de células citotrofoblásticas; cma, arteria central materna; cp, placa coriónica; cpp, proyección de la placa coriónica; db, decidua basalis; fp, placenta fetal; igc, células trofoblásticas glucogénicas invasoras; ivs, espacio intervelloso; jz, zona de unión; jzgc, células trofoblásticas glucogénicas de la zona de unión; jzst, espongiotrofoblastos de la zona de unión; jzvc, canal venoso de la zona de unión; l, laberinto; m, miometrio; mbs, espacios sanguíneos maternos; msa, arterias espiraladas maternas; mv, venas maternas; pbit, citotrofoblasto extravelloso invasivo intersticial del lecho placentario; tgc, célula gigante trofoblástica; tgcz, zona de células gigantes trofoblásticas; tv, vellosidad terminal; uc, cordón umbilical; vt, árbol velloso; zi, zona íntima.Las interfaces materno-fetales de la placenta fetal humana y el laberinto del ratón
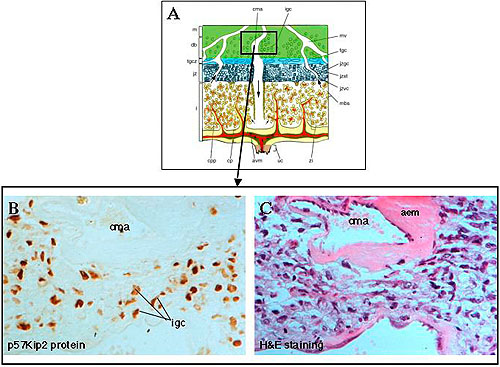
Figura 2. El cambio fisiológico de la arteria materna central en la decidua basalis durante la gestación avanzada (día 18.5 del desarrollo embrionario) se asocia con acumulación perivascular de células trofoblásticas glucogénicas invasoras. A: Diagrama de un corte a través de la placenta definitiva del ratón (mostrado también en la figura 1), que describe la región (incluida en el rectángulo) señalada en las secciones B y C. B y C: Secciones adyacentes de la decidua basal de la placenta definitiva del ratón en el día embriónico E18.5, en la región de la arteria materna central (cma). B muestra la localización perivascular de las células invasoras del trofoblasto glucogénico (igc), luego de efectuar inmunocitoquímica con un anticuerpo específico para la proteína p57Kip2, que marca estas células en dicha región.1 C muestra la misma zona ilustrada en B (sección adyacente), pero teñida con hematoxilina-eosina (H&E) para poner en evidencia los detalles morfológicos y para demostrar los cambios fisiológicos en la arteria materna central: el reemplazo de la pared muscular arterial con material eosinofílico acelular (aem).Patología placentaria de la preeclampsia humana y predicción de una placentopatía análoga murina