CITOQUINAS Y PATOGENESIS DEL EDEMA MACULAR DIABETICO
(especial para SIIC © Derechos reservados)
Coautor
Hidetoshi Yamashita*
Ophthalmologist (Professor and Chairman). Department of Opthalmology and Visual Science*
Recepción del artículo: 2 de febrero, 2004
Aprobación: 0 de , 0000
 Conclusión breve
En las personas diabéticas con isquemia retiniana se liberan sustancias al acuoso y al vítreo que provocan alteración en la barrera hematorretiniana, con aumento de la permeabilidad y edema macular.
Conclusión breve
En las personas diabéticas con isquemia retiniana se liberan sustancias al acuoso y al vítreo que provocan alteración en la barrera hematorretiniana, con aumento de la permeabilidad y edema macular.
 Resumen
El edema macular diabético (EMD) es la principal causa de pérdida de la visión en los pacientes diabéticos y se caracteriza por la acumulación de líquido extracelular en la retina. El principal mecanismo involucrado es la rotura de la barrera hematorretiniana (BHR), que es probable que se produzca por cambios en las proteínas de las uniones estrechas, incluidas las proteínas ocludina y de zónula de oclusión. La hiperglucemia y la isquemia retinal estimulan la síntesis y secreción de factor de crecimiento vascular endotelial (FCVE) y de interleuquina-6 (IL-6). Los niveles de FCVE e IL-6 están aumentados tanto en el humor acuoso como en el vítreo en pacientes con EMD en comparación con pacientes no diabéticos. Los factores de permeabilidad vascular, incluidos FCVE e IL-6, pueden actuar en forma directa en las uniones estrechas de las células endoteliales, disminuyendo el contenido de proteínas o aumentando la fosforilación. Estos cambios, aislados o en conjunto, pueden llevar a aumento de la permeabilidad paracelular. Las moléculas específicas que pueden circular a través de las uniones intercelulares dependen del factor de permeabilidad vascular involucrado, así como de su concentración, duración de acción e interacción con otros factores. La definición de los mecanismos moleculares del EMD será de gran importancia para la elaboración de tratamientos específicos.
Resumen
El edema macular diabético (EMD) es la principal causa de pérdida de la visión en los pacientes diabéticos y se caracteriza por la acumulación de líquido extracelular en la retina. El principal mecanismo involucrado es la rotura de la barrera hematorretiniana (BHR), que es probable que se produzca por cambios en las proteínas de las uniones estrechas, incluidas las proteínas ocludina y de zónula de oclusión. La hiperglucemia y la isquemia retinal estimulan la síntesis y secreción de factor de crecimiento vascular endotelial (FCVE) y de interleuquina-6 (IL-6). Los niveles de FCVE e IL-6 están aumentados tanto en el humor acuoso como en el vítreo en pacientes con EMD en comparación con pacientes no diabéticos. Los factores de permeabilidad vascular, incluidos FCVE e IL-6, pueden actuar en forma directa en las uniones estrechas de las células endoteliales, disminuyendo el contenido de proteínas o aumentando la fosforilación. Estos cambios, aislados o en conjunto, pueden llevar a aumento de la permeabilidad paracelular. Las moléculas específicas que pueden circular a través de las uniones intercelulares dependen del factor de permeabilidad vascular involucrado, así como de su concentración, duración de acción e interacción con otros factores. La definición de los mecanismos moleculares del EMD será de gran importancia para la elaboración de tratamientos específicos.
 Palabras clave
Edema macular diabético, barrera hematorretiniana, uniones estrechas, factor de crecimiento vascular endotelial, interleuquina-6
Clasificación en siicsalud
Palabras clave
Edema macular diabético, barrera hematorretiniana, uniones estrechas, factor de crecimiento vascular endotelial, interleuquina-6
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/66588
Especialidades
 Principal: Oftalmología,
Principal: Oftalmología,
 Relacionadas: Endocrinología y Metabolismo, Medicina Interna,
Relacionadas: Endocrinología y Metabolismo, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Hideharu Funatsu, MD. 8-1 Kawada-cho, Shinjuku-ku, Tokyo 162-8666 Japan
CYTOKINES AND PATHOGENESIS OF DIABETIC MACULAR EDEMA
 Abstract
Abstract
Diabetic macular edema (DME) is the leading cause of visual loss in diabetic patients and is characterized by accumulation of extracellular fluid in the retina. The most important mechanism involved is breakdown of the blood-retinal barrier (BRB), which is likely to be due to changes of tight junction proteins, including occludin and the zonula occludens proteins. Hyperglycemia and retinal ischemia stimulate the synthesis and secretion of vascular endothelial growth factor (VEGF) and interleukin-6 (IL-6). Both the aqueous humor and vitreous fluid levels of VEGF and IL-6 are significantly elevated in patients who have DME when compared with non-diabetic patients. Vascular permeability factors, including VEGF and IL-6, may act directly on endothelial cell tight junctions to decrease their protein content or increase phosphorylation. Either or both of these changes may lead to increased paracellular permeability. The specific molecules that are allowed to move through intercellular junctions may depend on the particular vascular permeability factor involved, as well as its concentration, duration of action, and interaction with other factors. Defining the molecular mechanisms of DME will be critical for the development of specific therapy.
 Key words
Key words
Diabetic macular edema, blood-retinal barrier, tight junction, vascular endothelial growth factor, interleukin-6
CITOQUINAS Y PATOGENESIS DEL EDEMA MACULAR DIABETICO
(especial para SIIC © Derechos reservados)
Artículo completo
IntroducciónEl edema macular diabético (EMD) es la causa más frecuente de deterioro de la agudeza visual en pacientes diabéticos.1 Se ha planteado la hipótesis de que el EMD se relaciona con la rotura de la barrera hematorretiniana (BHR) y posterior filtración de líquido intrarretinal a partir de capilares retinales anormales y microaneurismas, así como de la secreción de factores de permeabilidad vascular hacia el vítreo, desde la retina.2,3 En particular, el EMD se produce por filtración de agua, albúmina y lípidos, con acumulación de exudados lipídicos y líquido intrarretinal. La angiografía fluoresceínica (AF) demuestra la tinción de paredes vasculares y la filtración a partir de vasos retinales adyacentes a las áreas isquémicas de la retina, lo que sugiere que podría estar involucrado un agente difundible liberado por el tejido retiniano isquémico. Sin embargo, la patogénesis del EMD permanece incierta.Estudios recientes demostraron que el factor de crecimiento vascular endotelial (FCVE) causa cambios conformacionales en las uniones estrechas de las células vasculares endoteliales de la retina4 y tiene un papel fundamental en el aumento de la permeabilidad vascular en los ojos de los diabéticos.2 Muchos de los efectos del FCVE están mediados por otros factores y los eventos que inducen la producción de FCVE también pueden iniciar una cascada de factores, pero no está claro cómo ocurre. La interleuquina-6 (IL-6) es una citoquina multifuncional que en forma indirecta puede causar aumento en la permeabilidad vascular al inducir la expresión de FCVE5, o puede aumentar la permeabilidad vascular en forma directa6.Nosotros hemos informado con anterioridad que tanto los niveles de FCVE como de IL-6 en el humor acuoso se correlacionan con la gravedad de la retinopatía diabética, el grado de los trastornos del fondo de ojos, y la gravedad del EMD.7,8 Los niveles de FCVE en el vítreo y el acuoso pueden relacionarse entre sí, pero no son equivalentes. En la presente revisión se demuestra que la IL-6 está involucrada en la exacerbación del EMD junto con el FCVE, que se considera es el factor más potente en la promoción del aumento de la permeabilidad vascular.Componentes moleculares de la barrera hematorretinianaLa integridad de la BHR interna es un componente importante de la función visual normal y su disrupción es una característica del EMD. Hace tiempo se reconoció que la barrera funcional está a nivel de las uniones estrechas entre las células endoteliales adyacentes, ya que el endotelio vascular de la retina tiene muy pocas vesículas involucradas en el transporte de líquido. La comprensión de los factores celulares y moleculares que conforman la BHR es por lo tanto importante para la comprensión de la patogénesis del EMD. Estudios recientes demostraron que las uniones estrechas funcionales del endotelio vascular están constituidas por un ensamble único de proteínas.9 Dos familias de proteínas (las familias de la ocludina y de la claudina) atraviesan la membrana plasmática, mientras que otras proteínas involucradas se localizan en el citoplasma periférico (Figura 1).9 La ocludina y la claudina limitan el flujo de líquido entre las células endoteliales. Otras proteínas, incluidas las de la zónula de oclusión (ZO)-1, ZO-2, y ZO-3, se piensa que organizan las uniones estrechas a través de los dominios de interacción de múltiples proteínas. La ocludina se une a ZO-1, mientras que la ZO-3 se une a ZO-1 y a ocludina. Actualmente no está claro cómo interactúan las proteínas de las uniones estrechas o cómo influyen físicamente en el flujo paracelular de moléculas. Sin embargo, se demostró que estas proteínas cambian en respuesta a condiciones que alteran la permeabilidad vascular. Estudios recientes revelaron que el contenido de ocludina de las uniones estrechas entre las células endoteliales retinianas está reducido en la diabetes experimental, que además causa desorganización de las proteínas de las uniones estrechas en las arteriolas y capilares de la retina.10 Más aun, el FCVE y la IL-6 inducen cambios similares en la expresión de estas proteínas,11,12 así como incremento de la permeabilidad vascular. Por lo tanto, parece ser posible que el EMD se deba fundamentalmente al incremento de la permeabilidad vascular causado por las acciones de FCVE e IL-6 en las proteínas de las uniones estrechas del endotelio vascular.
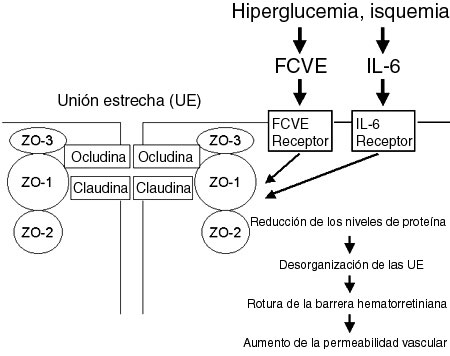
Figura 1. Diagrama de los cambios en las uniones estrechas en respuesta al factor de crecimiento vascular endotelial (FCVE) e interleuquina-6 (IL-6). ZO: zónula de oclusión, BHR: barrera hematorretiniana.
Niveles de factor de crecimiento vascular endotelial e interleuquina-6 en el acuoso y el vítreoLos niveles de IL-6 y FCVE en el acuoso no sólo se correlacionan con la gravedad de la retinopatía diabética o el grado de alteraciones en el fondo de ojos, como las hemorragias retinianas y los exudados duros, sino también con la gravedad del EMD.7,8 Además, los niveles de IL-6 en el acuoso se correlacionan en forma significativa con los niveles de FVCE,7,8 mientras que las concentraciones tanto de FCVE como de IL-6 son superiores en el humor acuoso que en el plasma.7,8 Los análisis de regresión logística demostraron que los niveles de FCVE, IL-6 y proteínas en el acuoso se asocian con las exacerbaciones del EMD luego de la cirugía de catarata.25 Más aun, los niveles de FCVE e IL-6 en el vítreo están elevados en forma significativa en pacientes con EMD, al compararlos con pacientes no diabéticos, no sólo en términos absolutos, sino también luego de ajustar al nivel de proteínas totales en el vítreo (Figuras 2A y 2B).13 Al igual que en el caso del humor acuoso, hay una correlación significativa entre los niveles vítreos de IL-6 y los de FCVE. También se informó que el FCVE es expresado por un número de células retinales14,15 y que la síntesis intraocular es la que contribuye en forma principal a los altos niveles vítreos de FCVE observados en pacientes con retinopatía diabética proliferativa.16,17 También se sabe bien que el FCVE causa un incremento marcado de la permeabilidad vascular18,19 y que el aumento de FCVE en el vítreo produce disminución de la ocludina, que puede ser responsable del aumento de la permeabilidad vascular retiniana en pacientes con EMD.4 Sin embargo, el mecanismo subyacente al aumento de la producción de FCVE es desconocido. Como se sabe que la producción de FCVE es regulada en forma positiva por la isquemia retiniana, productos finales de glucosilación, proteinquinasa Cβ y factor de crecimiento tipo insulina-1 (FCTI-1),14,20-22 parecería que los cambios en las otras citoquinas promoverían la expresión de FCVE.
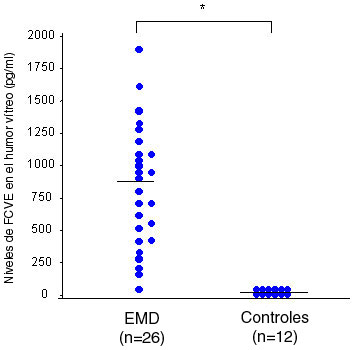
Figura 2A. Niveles de FCVE en el humor vítreo de pacientes controles no diabéticos y pacientes con EMD (p < 0.0001).
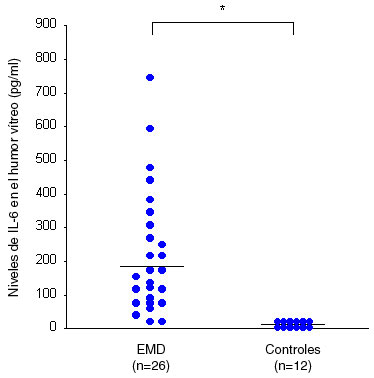
Figura 2B. Niveles de IL-6 en el humor vítreo en pacientes controles no diabéticos y pacientes con EMD (p<0.0001).
Interleuquina-6La hiperglucemia estimula la síntesis y la secreción de IL-6 por los monocitos humanos periféricos in vitro.23 La hipoxia además induce la expresión de IL-6, probablemente a través de la activación del sitio del factor nuclear IL-6.24 Además, se demostró que la IL-6 induce un aumento en la permeabilidad endotelial in vitro, secundario a la redisposición de filamentos de actina y a cambios morfológicos de las células endoteliales.6 Más aun, la capacidad del FCVE de incrementar la permeabilidad vascular sugiere que el aumento de la producción de FCVE inducido por IL-6 podría contribuir al EMD. Se sugirieron las siguientes posibilidades: 1) tanto el FCVE como la IL-6 pueden causar en forma directa un incremento en la permeabilidad vascular; 2) la IL-6 puede indirectamente incrementar la permeabilidad vascular a través de la regulación positiva del FCVE, y 3) el FCVE sólo puede causar aumento de la permeabilidad vascular, y los altos niveles vítreos de IL-6 se relacionarían con hiperglucemia, sin que influya en la permeabilidad vascular. Por lo tanto, es necesario realizar más investigaciones para aclarar la interacción ocular entre IL-6 y FCVE, así como el papel de la IL-6 en la patogénesis del EMD.Patogénesis del edema macular diabéticoLa rotura de la BHR ha sido reconocida hace mucho como importante en la presentación y progresión del EMD. La AF demuestra la tinción de las paredes vasculares y la filtración a partir de los vasos retinianos adyacentes a las áreas de isquemia de la renina (Figura 3), lo que sugiere que habría un agente difundible liberado por el tejido retiniano isquémico.
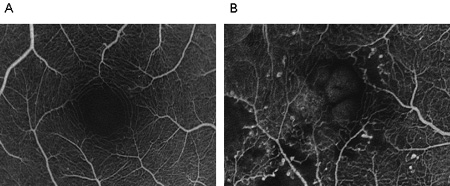
Figura 3.A: Angiografía fluoresceínica con oftalmoscopio de examinación láser. Control normal. B: Agrandamiento de la zona avascular foveal y de las regiones intercapilares en el EMD.
Tanto la hiperglucemia como la isquemia retiniana pueden inducir sobreexpresión de IL-6 y FCVE. Se ha sugerido que el agrandamiento de la zona foveal avascular y de las áreas intercapilares puede producir isquemia e hipoxia retiniana localizada con reducción de la función celular. Más aun, los niveles de FCVE e IL-6 en el vítreo pueden variar con respecto al patrón de filtración de fluoresceína en pacientes con EMD.13 Los niveles vítreos de FCVE e IL-6 son significativamente mayores en el EMD hiperfluorescente que en el EMD mínimamente fluorescente (Figuras 4A y 4B).
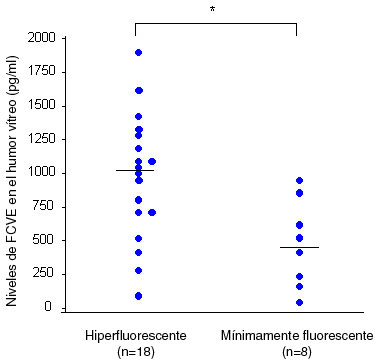
Figura 4A. Niveles de FCVE en el humor vítreo en pacientes con EMD hiperfluorescente y mínimamente fluorescente (p = 0.0008).
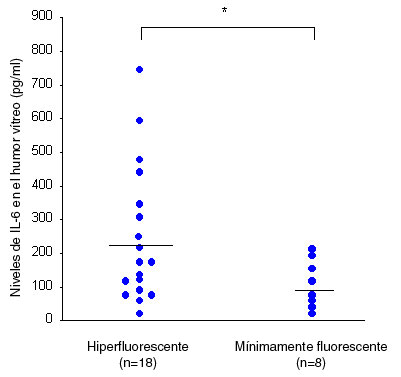
Figura 4B. Niveles de IL-6 en el humor vítreo en pacientes con EMD hiperfluorescente y mínimamente fluorescente (p = 0.0038).
En pacientes con EMD, la rotura de la BHR produce filtración de líquido intrarretiniano de los capilares retinianos anormales, y la detección de hiperfluorescencia en la AF refleja marcada filtración de fluoresceína asociada con la rotura de la BHR, mientras que un EMD mínimamente fluorescente representa una fase o estadio diferente de la enfermedad. Es posible que el EMD mínimamente fluorescente sea una fase más precoz de la enfermedad, o puede representar la respuesta al tratamiento. Al clasificar el EMD de acuerdo con el patrón de filtración de fluoresceína observado por AF hemos demostrado que los niveles de FCVE y de IL-6 en el vítreo eran mayores en pacientes con más permeabilidad vascular.Si se asume que factores de permeabilidad vascular, como el FCVE o la IL-6, actúan directamente en las uniones estrechas de las células endoteliales, disminuyendo el contenido de proteínas o aumentando su fosforilación, entonces cada uno o ambos efectos son capaces de aumentar la permeabilidad paracelular. Las moléculas específicas que pueden pasar a través de las uniones intercelulares dependen del factor de permeabilidad vascular involucrado, así como de su concentración, duración de acción, e interacción con otros factores.Conclusiones y perspectivasEl EMD es una de las principales causas de pérdida visual en pacientes diabéticos. El tratamiento actual es empírico y desafortunadamente suele ser inefectivo. Hay evidencia que sugiere que las anomalías de la IL-6 pueden tener una función en la patogénesis del EMD, junto con el FCVE, pero no se sabe con certeza cuál es el papel de la IL-6 en el proceso ni la manera en que interactúa con otros factores. La definición de los detalles de los mecanismos moleculares involucrados en diferentes procesos del EMD será de importancia para la elaboración de agentes terapéuticos útiles.AgradecimientosLos estudios mencionados en esta revisión fueron auspiciados por un Fondo de Investigación de Ciencias de la Salud (No. 10060101 para los Dres. Hori, Funatsu, y Yamashita) del Ministerio de Salud, Trabajo y Bienestar de Japón (Tokio, Japón). Deseamos agradecer a Katsunori Shimada (Departamento de Bioestadísticas, Instituto STATZ, Co., Ltd) por su asistencia en la realización de los análisis estadísticos.
 Bibliografía del artículo
Bibliografía del artículo
- Moss SE, Klein R, Klein BEK. The 14-year incidence of visual loss in a diabetic population. Ophthalmology 1998;105:998-1003.
- Antcliff RJ, Marshall J. The pathogenesis of edema in diabetic maculopathy. Semin Ophthalmol 1999;14:223-232.
- Kent D, Vinores SA, Campochiaro PA. Macular oedema. The role of soluble mediators. Br J Ophthalmol 2000;84:542-545.
- Antonetti DA, Barber AJ, Khin S, et al. Vascular permeability in experimental diabetes is associated with reduced endothelial occludin content. Diabetes 1998;47:1953-1959.
- Cohen T, Nahari D, Cerem LW, et al. Interleukin 6 induces the expression of vascular endothelial growth factor. J Biol Chem 1996;271:736-741.
- Maruo N, Morita I, Shirao M, Murota S. IL-6 increases endothelial permeability in vitro. Endocrinology 1992;131:710-714.
- Funatsu H, Yamashita H, Shimizu E, et al. Relationship between vascular endothelial growth factor and interleukin-6 in diabetic retinopathy. Retina 2001;21:469-477.
- Funatsu H, Yamashita H, Noma H, et al. Increased levels of vascular endothelial growth factor and interleukin-6 in the aqueous humor of diabetic macular edema. Am J Ophthalmol 2002;133:70-77.
- Anderson JM, van Itallie CM. Tight junctions and the molecular basis for regulation of paracellular permeability. Am J Physiol 1995;269:G467-G476.
- Barber AJ, Antonetti DA, Gardner TW. Altered expression of retinal occludin and glial fibrillary acidic protein in experimental diabetes. The Penn State Retina Research Group. Invest Ophthalmol Vis Sci 2000;41:3561-3568.
- Antonetti DA, Barber AJ, Hollinger LA, et al. Vascular endothelial growth factor induces rapid phosphorylation of tight junction proteins occludin and zonula occludin 1 . A potential mechanism for vascular permeability in diabetic retinopathy and tumors. J Biol Chem 1999;274:23463-23467.
- Desai TR, Leeper NJ, Hynes KL, et al. Interleukin-6 causes endothelial barrier dysfunction via the protein kinase C pathway. J Surg Res 2002;104:118-123.
- Funatsu H, Yamashita H, Ikeda T, et al. Vitreous levels of interleukin-6 and vascular endothelial growth factor are related to diabetic macular edema. Ophthalmology 2003;110:1690-1696.
- Aiello LP, Northrup JM, Keyt BA, et al. Hypoxia regulation of vascular endothelial growth factor in retinal cells. Arch Ophthalmol 1995;113:1538-1544.
- Lutty GA, McLeod S, Merges C, et al. Localization of vascular endothelial growth factor in human retina and choroid. Arch Ophthalmol 1996;114:971-977.
- Aiello LP, Avery RL, Arrigg PG, et al. Vascular endothelial growth factor in ocular fluid of patients with diabetic retinopathy and other retinal disorders. N Eng J Med 1994;331:1480-1487.
- Burgos R, Simo R, Audi L, et al. Vitreous levels of vascular endothelial growth factor are not influenced by its serum concentrations in diabetic retinopathy. Diabetologia 1997;40:1107-1109.
- Mathews MK, Merges C, McLeod DS, et al. Vascular endothelial growth factor and vascular permeability changes in human diabetic retinopathy. Invest Ophthalmol Vis Sci 1997;38:2729-2741.
- Qaum T, Xu Q, Joussen AM, et al. VEGF-initiated blood-retinal barrier breakdown in early diabetes. Invest Ophthalmol Vis Sci 2001;42:2408-2413.
- Murata T, Nagai R, Ishibashi T, et al. The relationship between accumulation of advanced glycation end products and expression of vascular endothelial growth factor in human diabetic retinas. Diabetologia 1997;40:764-769.
- Aiello LP, Bursell SE, Clermont A, et al. Vascular endothelial growth factor-induced retinal permeability is mediated by protein kinase C in vivo and suppressed by an orally effective B-isoform-selective inhibitor. Diabetes 1997;46:1473-1480.
- Punglia RS, Lu M, Hsu J, et al. Regulation of vascular endothelial growth factor expression by insulin-like growth factor. Diabetes 1997;46:1619-1626.
- Morohoshi M, Fujisawa K, Uchimura I, Numano F. Glucose-dependent interleukin 6 and tumor necrosis factor production by human peripheral blood monocytes in vitro. Diabetes 1996;45:954-959.
- Yang SF, Tritto I, Pinsky D, et al. Induction of inerleukin-6 (IL-6) by hypoxia in vascular cells. J Biol Chem 1995;270:11463-11471.
- Funatsu H, Yamashita T, Noma H, et al. Prediction of macular edema exacerbation after phacoemulsification in patients with nonproliferative diabetic retinopathy. J Cataract Refract Surg 2002;28:1355-1363.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:




