





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:Introducción
La fibrilación auricular (FA) es la arritmia más común en el mundo, con una incidencia de 0.5% a 1.0%. Su incidencia aumenta en forma proporcional a la edad, alcanzando aproximadamente el 10% de la población en general después de los 70 años de edad [1]. La FA está asociada con enfermedad de la válvula mitral (VM) hasta en 79% de los casos que son sometidos a cirugía mitral [2]. Diversas técnicas quirúrgicas han sido propuestas para la eliminación de la FA crónica en la enfermedad de la VM [3-5]. Haisaguerre y col. [6-7] han demostrado que los estímulos ectópicos que generan y mantienen la actividad eléctrica caótica de la FA están localizados, en su mayor parte, en el interior de las venas pulmonares (VP). La ablación de la FA mediante catéter percutáneo de radiofrecuencia en el interior de las VP ha sido utilizado por diversos autores [8-10]. La reducción auricular izquierda con aislamiento de las VP ha sido utilizada como tratamiento quirúrgico para la FA crónica concomitante con enfermedad de la VM [11-13].
El objetivo de este artículo es demostrar que el simple aislamiento quirúrgico de las VP durante el curso de una cirugía de la VM es suficiente para eliminar la FA crónica.
Material y métodos
De agosto de 1998 a enero de 2003 se estudiaron 59 pacientes sometidos a cirugía de VM y aislamiento quirúrgico de las VP para eliminar la FA crónica. Cuarenta y dos pacientes (71.2%) fueron femeninos y 17 (21.8%) masculinos, con edad media de 47.9 ± 13.8 años. La etiología de la enfermedad de la VM se expone en la tabla 1.
Tabla 1. Etiología valvular mitral.

*Implica los casos de etiología conjunta con la
enfermedad mitral al momento de la cirugía.
DLM, doble lesión mitral.
EMP, estenosis mitral pura.
IM, insuficiencia mitral.
La duración preoperatoria de la FA fue de 3.9 ± 2.9 años (rango, 1 a 11 años). Quince pacientes (25.4%) presentaban FA con una duración preoperatoria entre 1 a 3 años; 32 (54.2%) entre 3 a 6 años, y 8 (13.5%) mayor a 6 años. El tamaño preoperatorio de la AI por ecocardiografía fue de 7.56 ± 1.19 cm (rango, 6 a 11 cm). La medicación farmacológica antiarrítmica preoperatoria fue de 1.6 ± 0.8 medicamentos/paciente (rango, 1 a 3). Treinta pacientes (50.8%) estaban en clase funcional II de la NYHA, 28 (47.6%) en clase III, y uno (1.6%) en clase IV antes de la cirugía.
Técnica quirúrgica
Todos los casos se operaron mediante esternotomía media, canulación convencional en aorta ascendente y bicaval, derivación cardiopulmonar a 28 °C, y utilización de solución cardioplégica fría, retrógrada por el seno coronario, intermitente e hiperkalémica. Una vez que la aorta fue pinzada y la cardioplegía administrada, la cirugía mitral se realizó a través de una incisión frente a las VP derechas en la aurícula izquierda, paralela al surco interauricular (figura 1).

Figura 1. En esta ilustración se puede observar el abordaje convencional a través de la aurícula izquierda para realizar la cirugía mitral. Esta misma incisión es prolongada rodeando las cuatro venas pulmonares. OI, orejuela izquierda. S, separador quirúrgico. VCS, vena cava superior. VP, venas pulmonares.
Esta misma incisión se extendió hasta rodear totalmente las cuatro VP, desde el interior de la aurícula izquierda (figura 2).
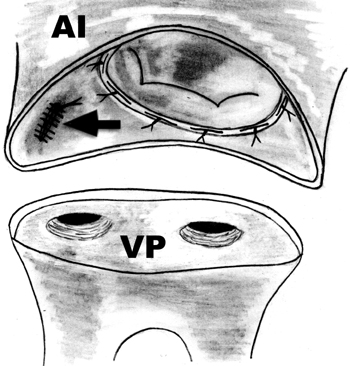
Figura 2. Las venas pulmonares son rodeadas completamente por la línea de corte quirúrgico. La flecha señala la sutura en la base de la orejuela izquierda, previamente extirpada. AI, aurícula izquierda. VP, venas pulmonares.
A continuación, se reconstituyó la aurícula izquierda por medio de una anastomosis utilizando sutura continua de polipropileno de 3/0. Además, se realizó en todos los casos la extirpación de la orejuela izquierda, como supresión de una posible fuente embolígena (figura 3).

Figura 3. Finalmente, la cámara que contiene las venas pulmonares es nuevamente reconstituida mediante sutura continua al resto de la aurícula izquierda. AI, aurícula izquierda. VP, venas pulmonares.
Seguimiento
Todos los pacientes fueron estudiados mediante electrocardiografía de 12 derivaciones y ecocardiografía transtorácica o tranesofágica, o ambas, en el período preopertatorio, en las primeras 24 horas después de la cirugía, al momento del alta hospitalaria, a los 3 meses, y posteriormente cada 6 meses después de la operación.
Análisis estadístico
Los datos se presentan como media ± desviación estándar, así como en números porcentuales.
Resultados
Hubo 2 casos (3.2%) de mortalidad operatoria. Ambos casos fueron debidos a bajo gasto cardíaco en el período posoperatorio inmediato. Los tiempos de clampeo aórtico y derivación cardiopulmonar fueron de 83 ± 26.7 minutos, y 114.6 ± 46.5 minutos, respectivamente. Hubo un caso (1.6%) de reexploración quirúrgica por sangrado posoperatorio, el cual no estuvo relacionado con la incisión realizada en esta técnica quirúrgica. Ocho casos (13.5%) presentaron bloqueo auriculoventricular completo transitorio en el período posoperatorio inmediato, desapareciendo dentro de los primeros catorce días después de la cirugía. Diez pacientes (17%) exhibieron recidiva de la FA en los primeros 7 días posteriores a la operación. Todos los pacientes fueron sometidos a un régimen terapéutico farmacológico a base de digoxina y amiodarona por 3 meses posteriores a la cirugía.
En un seguimiento de 11.2 meses (mediana =12 meses; rango, 58 a 3 meses), 50 pacientes (86%) mostraron un ritmo sinusal normal, y 9 (14%) se mantuvieron FA. El ecoDoppler de flujo transmitral demostró que 37 (74%) de los 50 pacientes que recuperaron el ritmo sinusal normal recobraron la función de transporte y contracción de la aurícula izquierda, exhibiendo una reaparición de la onda "a" en este estudio. A pesar de no haber efectuado reducción auricular izquierda en ninguno de los casos, el diámetro súpero-inferior posoperatorio de la AI medido por ecocardiografía fue de 4.91 cm ± 0.6 cm (rango, 3.8 cm a 7 cm), con un valor de p < 0.001. En todos los casos se utilizó anticoagulación oral por 6 semanas posoperatorias, siendo ésta suspendida en todos los casos en los cuales se obtuvo recuperación del ritmo sinusal normal, reaparición de la onda "a" de contracción auricular izquierda, y fueron susceptibles de reparación mitral o instalación de una prótesis biológica mitral (18/59, 30.5%).
Discusión
Varios procedimientos han sido descritos para el control de la FA crónica, desde aquellos dirigidos a controlar la respuesta ventricular con digitálicos [14], la ablación del haz de His con colocación de marcapaso ventricular definitivo [15], aislamiento de la aurícula izquierda [5], el procedimiento del corredor [4] y el procedimiento del laberinto de Cox [3]. El concepto introducido por Haissaguerre [6-8] de las VP como asiento principal de los estímulos eléctricos caóticos que generan y mantienen la FA es la parte fundamental de un nuevo enfoque para el tratamiento quirúrgico de la FA. La reducción auricular izquierda [11-12] es una técnica quirúrgica para eliminar la FA. Este procedimiento está basado tanto en el aislamiento de las VP [13], como en la reducción tisular de la masa crítica de la aurícula izquierda. Sin embargo, de acuerdo con los hallazgos de Haisaguerre, la parte más importante lo constituye el aislamiento de las VP. De hecho, existe una relación directa entre el aumento de tamaño de las VP superiores y la aparición de la FA, así como también de la existencia de anillos musculares derivados del miocardio de la aurícula izquierda que penetran en grado variable en el ostium y la porción más proximal de las VP superiores. Cambios estructurales en estas porciones del miocardio auricular que invaden las VP, quizá debido a distensión del mismo, pueden originar el ritmo caótico que desencadena la FA [16]. Esto ha motivado la ablación con catéter de radiofrecuencia directamente sobre los focos ectópicos en las VP involucradas como culpables, con una tasa de éxito de 69% en un seguimiento de 8 ± 4 meses [7-10, 17]. Este procedimiento tiene el inconveniente de la elevada frecuencia de recidiva debido a la aparición de nuevos focos arritmogénicos en las mismas VP.
Nosotros habíamos empezado a trabajar eliminando la FA que acompaña la enfermedad de la VM utilizando los conceptos de la reducción auricular izquierda [11,12]. De hecho, en nuestra primera serie de 23 pacientes con FA y enfermedad VM sometidos a reducción de la AI, no hubo ningún caso de recidiva de la FA [12]. Sin embargo, esta técnica quirúrgica es más laboriosa de ejecutar, lo cual prolonga de manera importante los tiempos de clampeo aórtico y de circulación extracorpórea. Aunque no tuvimos ningún caso de mortalidad directamente relacionado con esta técnica de reducción auricular izquierda, el riesgo de desgarro de la línea de sutura en la parte posterior de la AI, así como de daño a la arteria coronaria circunfleja, son potenciales detalles inherentes a este procedimiento quirúrgico. En nuestra experiencia, prácticamente hemos confinado el uso de la reducción auricular izquierda para aquellos casos portadores de AI gigante con importantes repercusiones hemodinámicas, así como sobre el árbol traqueobronquial del paciente [13].
No obstante, es necesario enfatizar que el cambio de enfoque substancial de nuestro grupo quirúrgico, relacionado con la manera de abordar la FA que acompaña a la enfermedad VM, es debido, fundamentalmente, a los conceptos emitidos por Haissaguerre [6]. La localización de la mayor parte de los estímulos que generan y mantienen la FA en el interior de las VP constituye la clave de este tipo de abordaje quirúrgico centralizado exclusivamente en las VP.
Otra alternativa es el uso intraoperatorio de varias fuentes de energía para aislar en una sola cámara las cuatro VP del resto de la aurícula izquierda [18]. Estas técnicas se basan en producir lesiones por quemadura que sustituyan a las barreras anatómicas creadas por el tradicional corte y sutura. Sin embargo, un aspecto muy importante es la transmuralidad y la uniformidad de la quemadura con radiofrecuencia, criolesión, microondas, láser ultrasonido. La persistencia de pequeños istmos residuales de tejido auricular, los cuales podrían permanecer sin ser lesionados por la energía utilizada, permiten la conducción de estímulos eléctricos desde las VP hacia la aurícula izquierda, con la consiguiente persistencia de la FA. Esto ha sido observado en istmos tisulares a partir de 0.8 mm de extensión [19]. Aunque la radiofrecuencia irrigada posee una penetración mayor que la convencional de hasta 9.9 ± 1.1 mm de profundidad en el área quemada [20], la discontinuidad de las líneas de quemadura puede ser un factor proarritmogénico.
El aislamiento de la cámara que contiene las cuatro VP del resto de la aurícula izquierda mediante corte y sutura parece constituir la técnica más segura y eficaz , desde el punto de vista de transmuralidad y uniformidad de la lesión. En esta serie de 59 pacientes aquí presentados, dicho aislamiento quirúrgico de las VP no aumentó en forma importante la morbilidad del procedimiento mitral subyacente. De hecho, no hubo problemas inherentes a la línea de sutura alrededor de las VP. El tiempo adicional empleado tanto en el clampeo aórtico como en la derivación cardiopulmonar no estuvieron directamente relacionados con la morbimortalidad de esta serie de pacientes.
La tasa de éxito de reversión a ritmo sinusal normal de 83% en los primeros 7 días, y de 86% al tercer mes posoperatorio, demuestran que el aislamiento quirúrgico de las VP puede ser empleado con seguridad para eliminar la FA crónica durante el curso de una operación de la VM.
Conclusiones
El aislamiento quirúrgico de la cámara que contiene las cuatro VP mediante la técnica de corte y sutura puede ser satisfactoriamente aplicada en los casos de cirugía mitral con FA concomitante. Así mismo, estos resultados fortalecen la idea acerca del manejo quirúrgico de la FA debe ser centralizado exclusivamente en las venas pulmonares como responsables de la génesis de esta arritmia.