ELINAFIDA, ESTADO ACTUAL DE UNA NAFTALIMIDA ACTIVA
(especial para SIIC © Derechos reservados)
Coautor
Miguel A. Villalona-Calero*
Medical Oncologist, Associate Professor of Medicine. Division of Hematology/Oncology. Arthur G. James Cancer Hospital and Richard J Solove Research Institute, The Ohio State University*
Recepción del artículo: 26 de febrero, 2003
Aprobación: 0 de , 0000
 Conclusión breve
La investigación futura deberá establecer el esquema de quimioterapia con elinafida que se asocie con la menor toxicidad sin afectar su eficacia.
Conclusión breve
La investigación futura deberá establecer el esquema de quimioterapia con elinafida que se asocie con la menor toxicidad sin afectar su eficacia.
 Resumen
La elinafida es una binaftalimida, formada por la unión de dos grupos naftalimida mediante un grupo de unión alquilamino. Induce citotoxicidad al intercalarse en el surco mayor de la hélice de ADN, con lo cual se altera la síntesis de ADN y su transcripción. Adicionalmente, la elinafida inhibe la actividad catalítica de la topoisomerasa II por un mecanismo único aún no identificado. En estudios preclínicos con xenoinjertos de tumores humanos, la elinafida inhibió el crecimiento en una variedad de modelos tumorales sólidos, inclusive cáncer de mama, melanoma, cáncer de pulmón y cáncer de colon. Se realizaron tres estudios clínicos en fase I para establecer la toxicidad de la elinafida en el hombre, así como para definir el mejor esquema de dosificación para un estudio en fase II. Los efectos adversos más frecuentemente observados con el fármaco son supresión medular y toxicidad neuromuscular que se manifiesta como debilidad proximal de las extremidades inferiores. Si bien los estudios de fase I mostraron efectos tóxicos, también se han observado respuestas parciales en tumores sólidos refractarios y con recidiva previa, tales como mesotelioma, cáncer pancréatico, cáncer de mama en varones refractario a antraciclina, melanoma y carcinoma seroso papilar del peritoneo, un tumor histológicamente similar al cáncer de ovario. Además, en pacientes con cáncer de pulmón no a células pequeñas se apreció estabilización tumoral prolongada. La actividad antineoplásica tan manifiesta observada con elinafida en tumores sólidos previamente tratados y refractarios avala investigaciones futuras para definir con precisión la toxicidad y eficacia, y para establecer los pasos en su desarrollo como un nuevo agente antitumoral.
Resumen
La elinafida es una binaftalimida, formada por la unión de dos grupos naftalimida mediante un grupo de unión alquilamino. Induce citotoxicidad al intercalarse en el surco mayor de la hélice de ADN, con lo cual se altera la síntesis de ADN y su transcripción. Adicionalmente, la elinafida inhibe la actividad catalítica de la topoisomerasa II por un mecanismo único aún no identificado. En estudios preclínicos con xenoinjertos de tumores humanos, la elinafida inhibió el crecimiento en una variedad de modelos tumorales sólidos, inclusive cáncer de mama, melanoma, cáncer de pulmón y cáncer de colon. Se realizaron tres estudios clínicos en fase I para establecer la toxicidad de la elinafida en el hombre, así como para definir el mejor esquema de dosificación para un estudio en fase II. Los efectos adversos más frecuentemente observados con el fármaco son supresión medular y toxicidad neuromuscular que se manifiesta como debilidad proximal de las extremidades inferiores. Si bien los estudios de fase I mostraron efectos tóxicos, también se han observado respuestas parciales en tumores sólidos refractarios y con recidiva previa, tales como mesotelioma, cáncer pancréatico, cáncer de mama en varones refractario a antraciclina, melanoma y carcinoma seroso papilar del peritoneo, un tumor histológicamente similar al cáncer de ovario. Además, en pacientes con cáncer de pulmón no a células pequeñas se apreció estabilización tumoral prolongada. La actividad antineoplásica tan manifiesta observada con elinafida en tumores sólidos previamente tratados y refractarios avala investigaciones futuras para definir con precisión la toxicidad y eficacia, y para establecer los pasos en su desarrollo como un nuevo agente antitumoral.
 Palabras clave
Miotoxicidad, resistencia a drogas, intercalación en el ADN
Clasificación en siicsalud
Palabras clave
Miotoxicidad, resistencia a drogas, intercalación en el ADN
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/20110
Especialidades
 Principal: Farmacología,
Principal: Farmacología,
 Relacionadas: Medicina Interna, Oncología,
Relacionadas: Medicina Interna, Oncología,
 Enviar correspondencia a:
Enviar correspondencia a:
Miguel A. Villalona-Calero, B 406, Starling Loving Hall, 320 West Tenth Ave., Columbus, Ohio 43210
Elinafide, current status of an active naphthalimide
 Abstract
Abstract
Elinafide is a bis-naphthalimide formed by joining two naphthalimide groups with an alkylamino linker. It induces cytotoxicity by bis-intercalating into the major groove of the DNA helix causing disruption of DNA synthesis and transcription. Additionally, elinafide inhibits topoisomerase II catalytic activity by a unique and yet unidentified mechanism. In preclinical studies using human tumor xenografts, elinafide inhibited tumor growth in a variety of solid tumor models including breast cancer, melanoma, lung cancer and colon cancer. Three clinical phase I studies have been performed to access the toxicity of elinafide in humans as well as to find the best dosing administration schedule to take to a phase II trial. The most common toxicities seen with the administration of elinafide included myelosuppression and a neuromuscular toxicity manifested by proximal lower extremity weakness. Despite the toxicities of elinafide on the phase I trials, several partial responses were seen in previously relapsed and refractory solid tumors including mesothelioma, pancreatic cancer, anthracycline refractory male breast cancer, melanoma, and papillary serous carcinoma of the peritoneum, a tumor histologically similar to ovarian cancer. Prolonged stabilization was also seen in patients with non-small cell lung cancer. The impressive anti-neoplastic activity seen with elinafide in previously treated refractory solid tumors suggests that further studies of determinants of toxicity and activity are warranted for elinafide. Information from these studies would increase or understanding of elinafide and provide new insights into its development as an anti-tumor agent.
 Key words
Key words
Miotoxicidad, resistencia a drogas, intercalación en el ADN
ELINAFIDA, ESTADO ACTUAL DE UNA NAFTALIMIDA ACTIVA
(especial para SIIC © Derechos reservados)
Artículo completo
Las naftalimidas son una nueva clase de agentes que se intercalan en el ADN e inhiben la topoisomerasa. Fueron desarrolladas para incorporar componentes estructurales esenciales de varias moléculas antitumorales bien definidas, como ácido aristolóquico, tilorona, CG-603 y cicloheximida, en una molécula única.1 La elinafida (LU 79553), N,N\'-bis[2-(1,8-naftalimido)etil]-1,3-diaminopropano bimetanosulfonato, es una binaftalimida formada por la unión de dos moléculas de naftalimida mediante un grupo alquilamino (figura 1).2,3

Figura 1. Estructura química de la LU 79553, la mitonafida y la amonafida. Fuente: Villalona-Calero MA, et al: "Phase I and Pharmacokinetic Study of LU79553, a DNA Intercalating Bisnaphthalimide, in Patients With Solid Malignancies", J Clin Oncol 19(3):857-869, 2001. Reimpreso con autorización de la American Society of Clinical Oncology.La elinafida tiene mayor afinidad de unión al ADN que las mononaftalimidas debido a que se intercala en el surco mayor de la hélice del ADN, con lo cual mejora la citotoxicidad in vitro e in vivo.4-8 Debido a que la elinafida no tiene sustituciones amina en los grupos naftalimida, no se metaboliza por N-acetilación. Por este motivo, las diferencias farmacogenéticas del fenotipo acetilador no se asocian con diferencias interindividulaes en el metabolismo tal como se observa con la amonafida, una mononaftalimida.6 Los estudios de investigación mostraron que la elinafida induce citotoxicidad por la doble intercalación en el surco mayor de la hélice del ADN, con lo cual se interrumpe la síntesis del ADN, la transcripción y la segregación cromosómica.5-7,9 Además, la elinafida inhibe la actividad catalítica de la topoisomerasa II mediante un mecanismo de acción único que aún no se ha identificado con precisión.6 En forma llamativa, la elinafida no estabiliza el complejo de ADN-topoisomerasa II tal como lo hacen fármacos como doxorrubicina, VP-16 y m-AMSA.6 La elinafida tiene mayor citotoxicidad en líneas celulares tumorales humanas y xenoinjertos que la mitonafida y la amonafida. La elinafida también fue eficaz en tumores con resistencia a múltiples drogas asociada con mayor expresión de glucoproteína P y por la alteración de la topoisomerasa II. Sin embargo, en estos casos se requieren concentraciones mayores de la droga para inducir la misma citotoxicidad que en tumores no resistentes.6 Estudios preclinicos
En estudios preclínicos, la elinafida demostró actividad antineoplásica sustancial en sistemas de cultivo de tejidos y xenoinjertos tumorales humanos; fue evaluada en líneas celulares humanas y murinas, y mostró ser potente agente citotóxico. Aproximadamente el 75% de todas las células tumorales evaluadas en ensayo de formación de colonias tumorales se inhibió con elinafida en una concentración de 1 µM, mientras que las células de cáncer de mama, pulmón, melanoma y ovario se inhibieron con concentraciones de 0.1 µM.10 Respecto de xenoinjertos tumorales humanos, la elinafida mostró efecto curativo en modelos de cáncer de mama precoz y avanzado (MX-1) y melanoma (LOX).6 LLamativamente, se obtuvieron regresiones parciales y ocasionalmente curación en el modelo de carcinoma pulmonar menos sensible (LX-1)6 Ocasionalmente, en modelos de carcinoma de colon (CX-1, DLD-1) se comprobaron regresiones parciales y en la mayoría de los tumores se constató un retardo en el crecimiento del tumor.6 La administración en forma diaria durante 5 días, dos veces por semana o semanalmente fue más eficaz que un único tratamiento.6 Los estudios de toxicidad en ratas, ratones y perros mostraron efectos en tejidos con rápida proliferación, como el hematopoyético, el linfoide y los órganos gastrointestinales. Las dosis letales o casi letales evidenciaron degeneración del músculo cardíaco y del músculo esquelético en estudios posmortem de roedores y perros. Otro efecto relacionado con la droga, cuando se utilizaron dosis más altas, fue la inflamación en el sitio de la inyección y cambios inflamatorios en nefronas e intersticio del riñón que no revirtieron por completo.6 Estudios clínicos
La marcada actividad antitumoral en estudios in vivo e in vitro, incluso en neoplasias resistentes a múltiples fármacos, y las ventajas metabólicas en comparación con amonafida, motivaron que la elinafida se estudiara en el hombre. Los ensayos de seguridad se realizaron simultáneamente con una variedad de esquemas diseñados para determinar la máxima dosis tolerada y la relación entre el esquema empleado, la toxicidad y metabolismo. En la tabla 1 se resume la toxicidad en relación con el aumento gradual de la dosis, tal como se registró en dichos estudios. La primera investigación evaluó elinafida administrada una vez cada 21 días en pacientes con tumores sólidos.11 Con dosis de inicio de 10 mg/m2, la primera manifestación de toxicidad fue inflamación en el sitio de la inyección. A causa de la flebitis química, se empleó un catéter venoso central en los enfermos que debían recibir 100 mg/m2 o más por infusión. En forma global, 50 pacientes con cáncer de pulmón, colorrectal, de páncreas y de mama recibieron 120 ciclos de quimioterapia, en promedio dos ciclos por enfermo. La dosis recomendada en este estudio se definió en 100 mg/m2/ciclo cuando la elinafida se administró cada tres semanas. La mielosupresión y un síndrome neuromuscular lentamente reversible fueron las toxicidades limitantes de dosis a 120 mg/m2/ciclo. Tres de seis pacientes tratados con dicha dosis presentaron neutropenia y trombocitopenia grado 3 o 4 y síntomas neuromusculares grado 3. El estudio fue luego realizado con un nuevo esquema de dosificación, en el cual la elinafida se repitió cada 6 semanas;11 como pareció tolerarse, se administraron dosis de hasta 160 mg/m2. Sin embargo, 8 de 9 enfermos tratados con este esquema tuvieron progresión de la enfermedad antes de que pudiera repetirse el segundo ciclo, lo cual limitó la posibilidad de evaluar la toxicidad acumulada. Cabe mencionar que un paciente que recibió 70 mg/m2 de elinafida cada tres semanas desarrolló descenso asintomático en la fracción de eyección del ventrículo izquierdo de 63% antes del tratamiento a 43% 15 días después del segundo ciclo de elinafida. Se registraron dos respuestas parciales, una en un enfermo con un mesotelioma y otra en un paciente con cáncer de páncreas.11La segunda investigación evaluó elinafida administrada semanalmente durante tres semanas consecutivas, cada cuatro semanas. En 27 individuos pudo determinarse la toxicidad12 El incremento consistió en 5 a 35 mg/m2 por semana sin toxicidad mayor. En dosis de 45 mg/m2 por semana se notó debilidad muscular proximal en extremidades inferiores en 3 de los 6 enfermos tratados. Esta toxicidad grado 2 fue reversible en todos los casos. Sin embargo, cuando la dosis se elevó a 60 mg/m2 por semana, 4 de 6 sujetos experimentaron debilidad muscular grave y uno de ellos falleció por parálisis bulbar y aspiración.12 Un enfermo desarrolló miocardiopatía dilatada y su fracción de eyección descendió de 65% a 35% con dosis de elinafida de 60 mg/m2.12 La evaluación posmortem reveló miocardiopatía que simuló cardiotoxicidad por antraciclina (M. Martín, comunicación personal). La creatinquinasa se elevó en el 50% de los enfermos del estudio; las biopsias musculares practicadas en cuatro de ellos mostraron compromiso miopático con fibras necróticas y depósitos granulares eosinofílicos. Además, se obsevó mielosupresión en relación con dosis de 60 mg/m2 por semana, con neutropenia grado 4 en 3 de 6 pacientes y un episodio de sepsis neutropénica y muerte. Un hombre con cáncer de mama refractario a antraciclina tuvo una respuesta parcial en una metástasis pleural y un enfermo con melanoma metastásico tuvo 50% o más de reducción en el tamaño y número de los nódulos pulmonares metastásicos aunque simultáneamente aparecieron lesiones en el sistema nervioso central.12 Finalmente, con un esquema diario durante 5 días cada tres semanas, 30 enfermos con tumores sólidos avanzados recibieron 105 cursos de elinafida en dosis que osciló de 2 a 24 mg/m2/día administrados en 30 minutos a 3 horas.13 El principal efecto adverso no hematológico de este esquema fue la miopatía proximal acumulada, que imposibilitó la repetición del tratamiento en dosis superiores a los 18 mg/m2 por día. Un hombre desarrolló miopatía proximal grave y disfunción eréctil además de neutropenia breve grado 4 luego del tercer curso de elinafida en dosis de 24 mg/m2/día. En otro enfermo se vio disfunción eréctil grave, miopatía proximal moderada y neutropenia breve grado 4 luego del tercer curso con el mismo nivel de dosis. La creatinquinasa sérica se elevó en estos individuos y la electromiografía demostró actividad espontánea y de inserción con potenciales miopáticos pequeños de unidades motoras con reclutamiento precoz. La biopsia muscular de ambos pacientes reveló depósitos de material granular fino azul verdoso e inclusiones citoplasmáticas pleomórficas (figura 2).
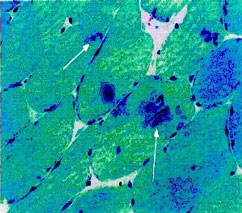
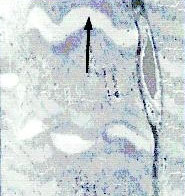
Figura 2. Cortes tisulares representativos de biopsia muscular en un paciente con miopatía clínica13. (Izquierda) Coloración tricrómica Gomori (x 440). (Derecha) Microscopia electrónica (x 2 900). Las flechas indican inclusiones citoplasmáticas. Fuente: Villalona-Calero MA, et al: "Phase I and Pharmacokinetic Study of LU79553, a DNA Intercalating Bisnaphthalimide, in Patients With Solid Malignancies", J Clin Oncol 19(3):857-869, 2001. Reimpreso con autorización de la American Society of Clinical Oncology. La evaluación muscular ultraestructural con microscopía electrónica mostró alteración miofibrilar grave y cuerpos citoplasmáticos semejantes a los que se observan en la miopatía miofibrilar. A diferencia de los otros dos estudios en los cuales uno de los enfermos presentó cierta toxicidad cardiológica, la función cardíaca no se alteró en forma sustancial en esta investigación. La fracción de eyección ventricular izquierda según el MUGA (multiple gated acquisition) estuvo dentro de los parámetros normales y no hubo diferencias entre los valores pretratamiento y postratamiento. En forma similar a las investigaciones previas, fue necesaria la infusión por un acceso venoso central por la flebitis química en el sitio de infusión. La enfermedad se mantuvo estable durante 7 a 10 meses en dos pacientes con cáncer pulmonar no a células pequeñas que habían tenido progresión durante la quimioterapia basada en platino.13 Además, se comprobó respuesta parcial en una mujer con carcinoma seroso papilar del peritoneo luego de recibier 6 cursos de elinafida en dosis de 14 mg/m2/día. Su enfermedad había progresado en forma rápida luego de quimioterapia conque incluyó carboplatino/ciclofosfamida y paclitaxel/cisplatino antes de recibir elinafida. En forma llamativa, la respuesta parcial en esta enferma persistió aún después de completar 20 cursos totales y en el momento de comenzar un nuevo regimen de quimioterapia 22 meses después del inicio de la elinafida. Aunque no se registró toxicidad que limitara la dosis durante el primer curso en ninguna de las dosis analizadas, debido a la toxicidad acumulada observada, los autores recomendaron dosis de 18 mg/m2/día.Farmacocinética
El estudio farmacocinético permitió la evaluación del comportamiento farmacológico de la elinafida en diferentes esquemas de administración. En forma global, el fármaco tiene una vida media prolongada (50 a 80 horas) y luego de la administración repetida se acumula moderadamente en plasma.11-13 La farmacocinética de la elinafida no fue dosis dependiente; la exposición sistémica aumentó en forma lineal con el aumento de la dosis en los tres estudios. La fracción de droga intacta excretada por orina fue baja, inferior al 5% de la dosis y no dependió de ella13 El modelo de tres compartimientos fue el que mejor describió la relación plasmática entre concentración y tiempo. El volumen de distribución en el estado de equilibrio determinado mediante este modelo fue amplio, aproximadamente 100 veces mayor que el volumen del compartimiento central, lo cual indicó rápida distribución en los tejidos periféricos seguida de dos fases más lentas de disponibilidad. Debido a que el estudio farmacocinético se realizó durante el primer ciclo, y en virtud de que la toxicidad apareció luego de dos o tres ciclos de terapia, es difícil determinar la relación entre la concentración plasmática y la toxicidad. Sin embargo, en el estudio de cinco administraciones diarias, los valores del área bajo la curva de concentración vs. tiempo (ABC) fueron superiores en pacientes que presentaron miopatía grado 2 o mayor o neutropenia grado 4 en comparación con los pacientes que no tuvieron estas manifestaciones.13 Discusión
La capacidad única de intercalarse en el ADN y el modo de interacción con la topoisomerasa II, en combinación con su potencia, amplio espectro y actividad frente a tumores refractarios hacen que elinafida sea un agente muy interesante desde el punto de vista antitumoral. Su exclusivo mecanismo de acción depende de dos grupos cromóforos ligados por una unión alquilamino. Los grupos cromóforos se intercalan en el surco mayor de la hélice de ADN, con lo cual se altera su síntesis y transcripción. En virtud de los resultados de los estudios preclínicos, las investigaciones revelaron un patrón único de toxicidad y de actividad en enfermedades malignas refractarias. Los hallazgos clínicos, de laboratorio y electrofisiológicos en los estudios clínicos realizados hasta la fecha indican que la elinafida induce un proceso miopático primario. Este fenómeno se confirmó mediante estudios ultraestructurales en biopsias de músculo de los pacientes afectados. Asimismo, en dos de tres investigaciones se comprobó el compromiso del músculo cardíaco. Los mecanismos por los cuales el fármaco es tóxico a nivel muscular periférico y cardíaco se desconocen. En sujetos que ingirieron grandes cantidades de clorhidrato de emetina por infección crónica por Entamoeba histolytica se describió una miopatía proximal similar. Lo mismo ocurrió en personas con trastornos de la alimentación y abuso de jarabe de ipecacuana, como inductor de emesis, cuyo principal componente es el clorhidrato de emetina.14,15 Las manifestaciones neuromusculares del clorhidrato de emetina son debilidad, dolor, dolor a la palpación y rigidez de los músculos esqueléticos especialmente en el cuello y en las extremidades proximales. La debilidad y malestar en los músculos proximales remiten luego de la interrupción del tratamiento con clorhidrato de emetina. Las aminotrasferasas séricas, la creatinquinasa y la aldolasa se elevan en forma moderada. La electromiografía revela aumento de la actividad de inserción, fibrilaciones y potenciales de unidades motoras miopáticas en la musculatura comprometida. La velocidad de conducción motriz y sensitiva no muestra alteraciones remarcables. En estos enfermos también puede sobrevenir dolor torácico, taquicardia, disnea, hipotensión y alteraciones electrocardiográficas. Es de notar que la miocardiopatía dilatada asociada con insuficiencia cardíaca congestiva, arritmia y muerte súbita también ha sido descripta en pacientes que abusan de jarabe de ipecacuana.14,15 Aunque el mecanismo de toxicidad de la emetina se desconoce, el miocardio de ratas tratadas con este agente y con el antitumoral cicloheximida, que comparte con elinafida el mismo anillo glutarimida, tiene menor incorporación de leucina en la actomiosina, necesaria para la contracción.16 En forma llamativa, el anillo de glutarimida de la elinafida parece ser responsable de su mayor eficacia en comparación con otras binaftalimidas. Consideraciones para el desarrollo futuro
La eficacia antitumoral de la elinafida, tal como quedó ejemplificada en un paciente con carcinoma papilar peritoneal resistente al platino y al taxano (una neoplasia histológicamente semejante al cáncer de ovario), justifica la adopción de diversas estrategias que puedan asociarse con menor toxicidad sin pérdida de la eficacia antitumoral. Tal como se muestra en la tabla 1, los datos clínicos sugieren que existe un umbral de dosis por encima del cual es probable que aparezcan toxicidad hematológica y toxicidad neuromuscular. Los resultados de estudios en fase I indican que la dosis única y la dosis total acumulada pueden ser determinantes clave de toxicidad. El modelo de tres compartimientos con amplio volumen de distribución según los datos farmacocinéticos sugiere distribución amplia y preferencial en el músculo esquelético y cardíaco, probablemente en relación con el elevado metabolismo de la droga en estos tejidos.

Un abordaje posible para eliminar la toxicidad podría ser aumentar el intervalo de administración y dejar tiempo suficiente para la depuración de la elinafida o sus metabolitos del músculo esquelético o cardíaco. Esta estrategia no se asoció con diferencias significativas en la intensidad de la dosis cuando el intervalo de administración de una única dosis se aumentó de 3 a 6 semanas (dosis limitante de toxicidad de 120 mg/m2 cada 3 semanas y 160 mg/m2 cada 6 semanas).11 Esto puede tener consecuencias en relación con la actividad antitumoral del fármaco. Además, en caso de que la toxicidad en músculo esquelético y cardíaco refleje lesión progresiva por acumulación de la droga en los tejidos a lo largo del tiempo, un mayor período entre las exposiciones no sería capaz de reducir la incidencia y gravedad de la toxicidad sin comprometer la dosis total administrada. Este fenómeno ha sido documentado en el caso de la cardiotoxicidad relacionada con doxorrubicina.17-19 La naturaleza acumulativa de la toxicidad por elinafida probablemente represente mayor nivel tisular del fármaco en comparación con la concentración en plasma. En el caso de que exista un umbral pico de concentración por encima del cual elinafida se distribuye preferentemente en tejido muscular, no alcanzar ese umbral sería una forma posible de reducir la incidencia y gravedad de la toxicidad sin afectar la intensidad de la dosis. Este abordaje sólo sería de valor en caso de que la exposición del tejido tumoral a la droga ocurra en concentraciones por debajo del umbral muscular. Si se tiene en cuenta que cuando un fármaco se administra en forma repetida a intervalos regulares, la concentración en plasma aumenta hasta que la eliminación y la administración se igualan, el uso de dosis más pequeñas a intervalos más cortos reduciría las oscilaciones en la concentración de la droga. La actividad antitumoral observada en un paciente que recibió 14 mg/m2 diarios durante 5 días hace pensar que la concentración pico alta no es necesaria en la eficacia antineoplásica.13 El concepto discutido previamente alienta la evaluación de esquemas de infusión continua, con los cuales se evitan las concentraciones pico altas. En resumen, la elinafida es eficaz contra neoplasias sólidas malignas refractarias. La dosis única y la acumulación de dosis son hechos importantes en la toxicidad. Se requiere más investigación para comprender mejor el mecanismo de acción de este agente así como su perfil de toxicidad. Los resultados de estas investigaciones aumentarán el conocimiento acerca de la droga y brindarán nuevas posibilidades de uso como un agente antitumoral.
 Bibliografía del artículo
Bibliografía del artículo
- Brana MF, Castellano JM, Roldan CM, Santos A, Vazquez D, Jimenez A. Synthesis and mode(s) of action of a new series of imide derivatives of 3-nitro-1,8 naphthalic acid. Cancer Chemother Pharmacol. 1980;4:61-66.
- Brana MF, Castellano JM, Moran M, Perez de Vega MJ, Perron D, Conlon D, Bousquet PF, Romerdahl CA, Robinson SP. Bis-naphthalimides 3: synthesis and antitumour activity of N,N\'-bis[2-(1,8-naphthalimido)-ethyl] alkanediamines. Anticancer Drug Des. 1996;11:297-309.
- Brana MF, Castellano JM, Perron D, Maher C, Conlon D, Bousquet PF, George J, Qian XD, Robinson SP. Chromophore-modified bis-naphthalimides: synthesis and antitumor activity of bis-dibenz[de,h]isoquinoline-1,3-diones. J Med Chem. 1997;40:449-454.
- Brana MF, Castellano JM, Moran M, Perez de Vega MJ, Romerdahl CR, Qian XD, Bousquet P, Emling F, Schlick E, Keilhauer G. Bis-naphthalimides: a new class of antitumor agents. Anticancer Drug Des. 1993;8:257-268.
- Brana M, Castellano J, Moran M, et al. Bisnaphthalimides, synthesis and biological activity of 5,6 acenaphthalimido alkyl-1,8-naphthalimidoalkyl-amines. Eur J Med Chem. 1995;30:235-239.
- Bousquet PF, Brana MF, Conlon D, Fitzgerald KM, Perron D, Cocchiaro C, Miller R, Moran M, George J, Qian X-D, Keilhaur G, Romerdahl CA. Preclinical evaluation of LU 79553: a novel bis-naphthalimide with potent antitumor activity. 1995;55:1176-1180.
- Bailley C, Brana M, Waring MJ. Sequence-selective intercalation of antitumour bis-naphthalimides into DNA. Evidence for an approach via the major groove. Eur J Biochem. 1996;240:195-208.
- Romerdahl C, Brana M. Bisnaphthalimides, synthesis and pre-clinical evaluation, in Teicher B (ed). Cancer Therapeutic: Experimental and Clinical Agents. Totowa, NJ, Humana Press Inc, 1997.
- Gallego J, Reid BR. Solution structure and dynamics of a complex between DNA and the antitumor bisnaphthalimide LU-79553: intercalated ring flipping on the millisecond time scale. Biochemistry. 1999;38:15104-15115.
- Villalona-Calero M, Degen D, Bousquet P, Von Hoff D. LU 79553: evaluation by human tumor clonogenic assay of a novel naphthalimide. Proc Am Assoc Cancer Res. 1996;37:398.
- Hanauske A-R, Awada A, Thödtmann R, Höppener F, Wanders J, von Broen I-M, Piccart MJ. A phase I study of LU 79553 administered every 21 days in patients (pts) with solid tumors: and EORTC/ECSG study. Proc Am Soc Clin Oncol. 1998;17:234a.
- Martín M, Casado A, Benavides A, Alonso JL, Garcia-Carbonero I, Sastre J, Moreno E, Díaz-Rubio E. Phase I study of elinafide in solid tumors. Ann Oncol. 1998;9(suppl2):63.
- Villalona-Calero MA, Eder JP, Toppmeyer DL, Allen LF, Fram R, Velagapudi R, Myers M, Amato A, Kagen-Hallet K, Razvillas B, Kufe DW, Von Hoff DD, Rowinsky EK. Phase I and pharmacokinetic study of LU79553, a DNA intercalating bisnaphthalimide, in patients with solid malignancies. J Clin Oncol. 2001;19:857-869.
- Palmer EP, Guay AT. Reversible myopathy secondary to abuse of ipecac in patients with major eating disorders. N Eng J Med. 1985;313:1457-1459
- Adler AG, Walinsky P, Krall RA, Cho SY. Death resulting from ipecac syrup poisoning. J Am Med Assoc. 1980;243:1927-1928.
- Beller BM. Observations on the mechanism of emetine poisoning of myocardial tissue. Circ Res. 1968;22:501-505.
- Von Hoff DD, Laynard MW, Basa P, Davis HL Jr, Von Hoff AL, Rozencweig M, Muggia FM. Risk factors for doxorubicin-induced congestive heart failure. Ann Intern Med. 1979;91:710-717
- Stewart DJ, Grewaal D, Green RM, Mikhael N, Goel R, Montpetit VA, Redmond MD. Concentrations of doxorubicin and its metabolites in human autopsy heart and other tissues. Anticancer Res. 1993;13:1945-1952.
- Legha SS, Benjamin RS, Mackay B, Ewer M, Wallace S, Valdivieso M, Rasmussen SL, Blumenschein GR, Freireich EJ. Reduction of doxorubicin cardiotoxicity by prolonged continuous intravenous infusion. Ann Intern Med. 1982;96:133-139.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:


