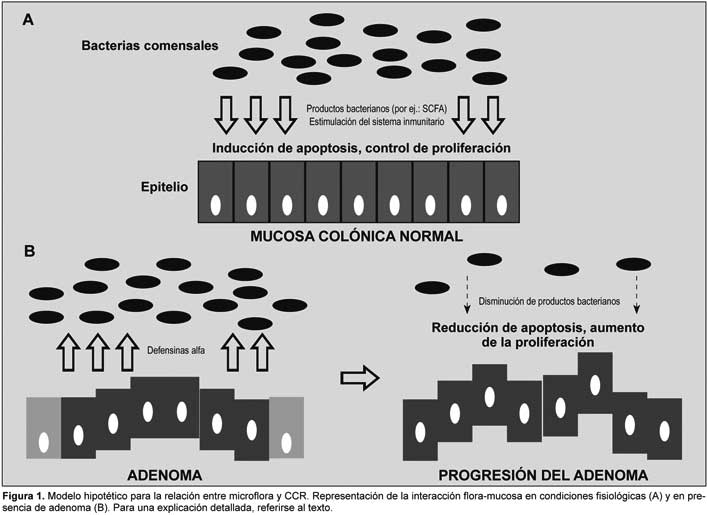
Bibliografía del artículo
Bibliografía del artículo
1. Guarner F, Malagelada JR. Gut flora in health and disease. Lancet 361:512-9, 2003.
2. Neish AS. Microbes in gastrointestinal health and disease. Gastroenterology 136:65-80, 2009.
3. Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota in health and disease. Physiol Rev 90:859-904, 2010.
4. Jemal A, Siegel R, Ward E, Murray T, Xu J, Smigal C, Thun MJ. Cancer statistics, 2006. CA Cancer J Clin 56:106-30, 2006.
5. Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell 61:759-67, 1990.
6. Moore WE, Moore LH. Intestinal floras of populations that have a high risk of colon cancer. Appl Environ Microbiol 61:3202-7, 1995.
7. Arthur JC, Jobin C. The struggle within: microbial influences on colorectal cancer. Inflamm Bowel Dis 17:396-409, 2011.
8. Zhu Y, Michelle Luo T, Jobin C, Young HA. Gut microbiota and probiotics in colon tumorigenesis. Cancer Lett 309:119-27, 2011.
9. Pagnini C, Corleto VD, Hoang SB, Saeed R, Cominelli F, Delle Fave G. Commensal bacteria and "oncologic surveillance": suggestions from an experimental model. J Clin Gastroenterol 42(Suppl 3):S193-6, 2008.
10. Comalada M, Bailon E, de Haro O, Lara-Villoslada F, Xaus J, Zarzuelo A, Galvez J. The effects of short-chain fatty acids on colon epithelial proliferation and survival depend on the cellular phenotype. J Cancer Res Clin Oncol 132:487-97, 2006.
11. Roller M, Pietro Femia A, Caderni G, Rechkemmer G, Watzl B. Intestinal immunity of rats with colon cancer is modulated by oligofructose-enriched inulin combined with Lactobacillus rhamnosus and Bifidobacterium lactis. Br J Nutr 92:931-8, 2004.
12. Pagnini C, Saeed R, Bamias G, Arseneau KO, Pizarro TT, Cominelli F. Probiotics promote gut health through stimulation of epithelial innate immunity. Proc Natl Acad Sci U S A 107:454-9, 2010.
13. Melle C, Ernst G, Schimmel B, Bleul A, Thieme H, Kaufmann R, Mothes H, Settmacher U, Claussen U, Halbhuber KJ, Von Eggeling F. Discovery and identification of alpha-defensins as low abundant, tumor-derived serum markers in colorectal cancer. Gastroenterology 129:66-73, 2005.
14. Albrethsen J, Bogebo R, Gammeltoft S, Olsen J, Winther B, Raskov H. Upregulated expression of human neutrophil peptides 1, 2 and 3 (HNP 1-3) in colon cancer serum and tumours: a biomarker study. BMC Cancer 5:8, 2005.
15. Nam MJ, Kee MK, Kuick R, Hanash SM. Identification of defensin alpha6 as a potential biomarker in colon adenocarcinoma. J Biol Chem 280:8260-5, 2005.
16. Pagnini C, Corleto VD, Mangoni ML, Pilozzi E, Torre MS, Marchese R, Carnuccio A, Giulio ED, Delle Fave G. Alteration of local microflora and alpha-defensins hyper-production in colonic adenoma mucosa. J Clin Gastroenterol 45:602-10, 2011.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: