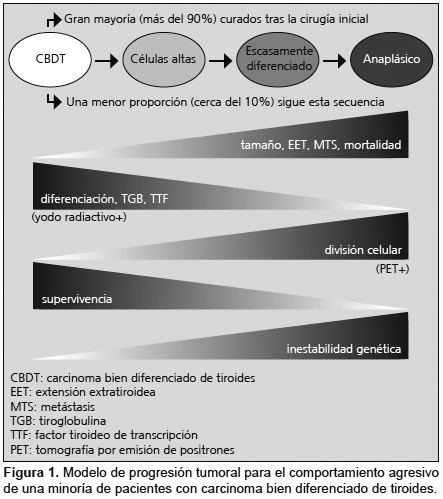
Bibliografía del artículo
Bibliografía del artículo
1. Davies L, Welch HG. Epidemiology of head and neck cancer in the United States. Otolaryngol Head Neck Surg 135(3):451-7, 2006.
2. Chen AY, Jemal A, Ward AM. Increasing incidence of differentiated thyroid cancer in the United States, 1988-2005. Cancer 115(16):3801-7, 2009.
3. Enewold L, et al. Rising thyroid cancer incidence in the United States by demographic and tumor characteristics, 1980-2005. Cancer Epidemiol Biomarkers Prev 18(3):784-91, 2009.
4. Mitchell I, et al. Trends in thyroid cancer demographics and surgical therapy in the United States. Surgery 142(6):823-8, 2007.
5. Davies L, Welch HG. Increasing incidence of thyroid cancer in the United States, 1973-2002. JAMA 295(18):2164-7, 2006.
6. Shah JP, et al. Prognostic factors in differentiated carcinoma of the thyroid gland. Am J Surg 164(6):658-61, 1992.
7. Hughes CJ, et al. Impact of lymph node metastasis in differentiated carcinoma of the thyroid: a matched-pair analysis. Head Neck 18(2):127-32, 1996.
8. Sywak M, Pasieka JL, Ogilvie T. A review of thyroid cancer with intermediate differentiation. J Surg Oncol 86(1):44-54, 2004.
9. Rosai J. Poorly differentiated thyroid carcinoma: introduction to the issue, its landmarks, and clinical impact. Endocr Pathol 15(4):293-6, 2004.
10. Rosai J, Saxen EA, Woolner L. Undifferentiated and poorly differentiated carcinoma. Semin Diagn Pathol 2(2):123-36, 1985.
11. Hutter RV, et al. Spindle and giant cell metaplasia in papillary carcinoma of the thyroid. Am J Surg 110(4):660-8, 1965.
12. Nixon IJ, et al. Disease-Related Death in Patients Who Were Considered Free of Macroscopic Disease After Initial Treatment of Well-Differentiated Thyroid Carcinoma. Thyroid; 2011.
13. Watkinson JC. The British Thyroid Association guidelines for the management of thyroid cancer in adults. Nucl Med Commun 25(9):897-900, 2004.
14. Cooper DS, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 19(11):1167-214, 2009.
15. Hay ID, et al. Predicting outcome in papillary thyroid carcinoma: development of a reliable prognostic scoring system in a cohort of 1779 patients surgically treated at one institution during 1940 through 1989. Surgery 114(6):1050-7, 1993.
16. Hundahl SA, et al. A National Cancer Data Base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995. Cancer 83(12):2638-48, 1998.
17. Hay ID, et al. Papillary thyroid carcinoma managed at the Mayo Clinic during six decades (1940-1999): temporal trends in initial therapy and long-term outcome in 2444 consecutively treated patients. World J Surg 26(8):879-85, 2002.
18. Cady B, Hayes M. Our AMES is true: how an old concept still hits the mark: or, risk group assignment points the arrow to rational therapy selection in differentiated thyroid cancer. Am J Surg 174(5):462-8, 1997.
19. McConahey WM, et al. Papillary thyroid cancer treated at the Mayo Clinic, 1946 through 1970: initial manifestations, pathologic findings, therapy, and outcome. Mayo Clin Proc 61(12):978-96, 1986.
20. Shaha AR, Shah JP, Loree TR. Risk group stratification and prognostic factors in papillary carcinoma of thyroid. Ann Surg Oncol 3(6):534-8, 1996.
21. Shaha AR, Shah JP, Loree TR. Low-risk differentiated thyroid cancer: the need for selective treatment. Ann Surg Oncol 4(4):328-33, 1997.
22. Shah JP, et al. Lobectomy versus total thyroidectomy for differentiated carcinoma of the thyroid: a matched-pair analysis. Am J Surg 166(4):331-5, 1993.
23. Andersen PE, et al. Differentiated carcinoma of the thyroid with extrathyroidal extension. Am J Surg 170(5):467-70, 1995.
24. McCaffrey TV, Bergstralh EJ, Hay ID. Locally invasive papillary thyroid carcinoma: 1940-1990. Head Neck 16(2):165-72, 1994.
25. Koo BS, et al. Predictive factors for ipsilateral or contralateral central lymph node metastasis in unilateral papillary thyroid carcinoma. Ann Surg 249(5):840-4, 2009.
26. Vergez S, et al. Lymph node management in clinically node-negative patients with papillary thyroid carcinoma.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: