Bibliografía del artículo
Bibliografía del artículo
1. Masuo K, Kawaguchi H, Mikami H, Ogihara T, Tuck ML. Serum uric acid and plasma norepinephrine concentrations predict subsequent weight gain and blood pressure elevation. Hypertension 42:474-480, 2003.
2. Masuo k, Mikami H, Ogihara T, Tuck ML. Weight gain-induced blood pressure elevation. Hypertension 35:1135-1140, 2000.
3. Masuo K, Mikami H, Ogihara T, Tuck ML. Weight reduction and pharmacological treatment in obese hypertensives. Am J Hypertens 15:530-538, 2001.
4. Masuo K, Mikami H, Itoh M, Ogihara T, Tuck ML. Sympathetic activity and body mass index contribute to blood pressure levels. Hypertens Res 23:303-310, 2000.
5. Mancia G, Grassi G, Parati G, Daffonchio A. Evaluating sympathetic activity in human hypertension. J Hypertens 11:S13-S19, 1993.
6. Grassi G. Role of the sympathetic nervous system in human hypertension. J Hypertens 16(12 Pt2):1979-1987, 1998.
7. Rumantir MS, Vaz M, Jennings GL, et al. Neural mechanisms in human obesity-related hypertension. J Hypertens 17:1125-1135, 1999.
8. Tuck ML. The sympathetic nervous system in essential hypertension. Am Heart J 112:877-886, 1986.
9. Masuo K, Ogihara T, Kumahara Y, Yamatodani A, Wada H. Plasma norepinephrine and dietary sodium intake in normal subjects and patients with essential hypertension. Hypertension 5:767-771, 1983.
10. Grassi G, Seravalle G, Cattaneo BM, et al. Sympathetic activation in obese normotensive subjects. Hypertension 25(Pt 1):560-563, 1995.
11. Ward KD, Sparrow D, Landsberg L, Young JB, Vokonas PS, Weiss ST. Influence of insulin, sympathetic nervous system activity, and obesity on blood pressure: the Normative Aging Study. J Hypertens 14:301-308, 1996.
12. Anderson B, Elam M, Wallin BG, Bjorntorp P, Anderson OK. Effect of energy-restricted diet on sympathetic muscle nerve activity in obese women. Hypertension 18:783-789, 1991.
13. Straznicky NE, Lambert EA, Lambert GW, Masuo K, Esler MD, Nestle PJ. Effects of dietary weight loss on sympathetic activity and cardiac risk factors associated with the metabolic syndrome. J Clin Endocrinol Met 90:5998-6005, 2005.
14. Masuo K. Obesity-related hypertension: Role of sympathetic nervous system, insulin, and leptin. Curr Hypertens Rep 4:112-118, 2002.
15. Esler M, Straznicky N, Eikelis N, Masuo K, Lambert G, Lambert E. Mechanisms of sympathetic activation in obesity-related hypertension. Hypertension 48:787-796, 2006.
16. Corry DB, Tuck ML. Obesity, hypertension, and sympathetic nervous system activity. Curr Hypertens Rep 1:119-126, 1999.
17. Landsberg L. Diet, obesity and hypertension. A hypothesis involving insulin, the sympathetic nervous system, and adaptive thermogenesis. Q J Med 236:1081-1090, 1986.
18. Landsberg L. Insulin-mediated sympathetic stimulation: role in the pathogenesis of obesity-related hypertension (or, how insulin affects blood pressure, and why). J Hypertens 15:523-528, 2001.
19. Anderson EA, Hoffman RP, Balon TW, Sinkey CA, Mark AL. Hyperinsulinemia produces both sympathetic neural activation and vasodilation in normal humans. J Clin Invest 87:2246-2252, 1991.
20. Masuo K, Mikami H, Ogihara T, Tuck ML. Sympathetic nerve hyperactivity precedes hyperinsulinemia and blood pressure elevation in a young, nonobese Japanese population. Am J Hypertens 10:77-83, 1997.
21. Masuo K, Mikami H, Ogihara T, Tuck ML. Differences in mechanisms between weight loss-sensitive and -resistant blood pressure reduction in obese subjects. Hypertens Res 24:371-376, 2001.
22. Masuo K, Katsuya T, Kawaguchi H, et al. Rebound weight gain as associated with high plasma norepinephrine levels that are mediated through polymorphisms in the beta2-adrenoceptor. Am J Hypertens 18:1508-1516, 2005.
23. Masuo K, Mikami H, Ogihara T, Tuck ML. Familial hypertension, insulin, sympathetic activity, and blood pressure elevation. Hypertension 32:96-100, 1998.
24. Masuo K, Mikami H, Ogihara T, Tuck ML. Familial obesity, sympathetic activation and blood pressure level. Blood Press 10:199-204, 2001.
25. Cui JM, Hopper JL, Harrap SB. Genes and family environment explain corrections between blood pressure and body mass index. Hypertension 40:7-12, 2002.
26. Masuo K, Katsuya T, Fu Y, Rakugi H, Ogihara T, Tuck ML. 2- and 3-adrenergic receptor polymorphisms are related to the onset of weight gain and blood pressure elevation over 5 years. Circulation 111:3429-3434, 2005.
27. Pereira AC, Floriano MS, Mota CF, et al. 2 adrenoceptor functional gene variants, obesity, and blood pressure level interactions in the general population. Hypertension 42[part 2]:685-692, 2003.
28. Meirhaeghe A, Helbecque N, Cottel D, Amouyel P. Impact of polymorphisms of the human beta2-adrenoceptor gene on obesity in a French population. Int J Obes Relat Metab Disord 24:382-387, 2000.
29. Herrmann SM, Nicaud V, Tiret L, et al. Polymorphisms of the beta2-adrenoceptor (ADRB2) gene and essential hypertension: the ECTIM and PEGASE studies. J Hypertens 20:229-235, 2002.
30. Leineweber K, Buscher R, Bruck H, Brodde OE. Beta-adrenoceptor polymorphisms. Naunyn Schmiedebergs Arch Pharmacol 369:1-22, 2004.
31. Large V, Hellstrom L, Reynisdottir S, et al. Human beta2-adrenoceptor gene polymorphisms are highly frequent in obesity and altered adipocytes beta2-adrenoceptor function. J Clin Invest 100:3005-3013, 1997.
32. Granze G, Fortin J, Labugger R, et al. 2-adrenergic receptor variants affect resting blood pressure and agonist-induced vasodilation in young adult Caucasians. Hypertension 33:1425-1430, 1999.
33. Hoit BD, Suresh DP, Craft L, Walsh RA, Liggett SB. Beta2-adrenergic receptor polymorphisms at amino acid 16 differentially influence agonist-stimulated blood pressure and peripheral blood flow in normal individuals. Am Heart J 139:539-542, 2000.
34. Leineweber K. Beta-adrenergic receptor polymorphism in human cardiovascular disease. Ann Med 36(Suppl.1):64-69, 2004.
35. Ellsworth DL, Coady SA, Chen W, et al. Influence of the beta2-adrenergic receptor Arg16Gly polymorphism on longitudinal change in obesity from childhood through young adulthood in a biracial cohort: the Bogalusa Heart Study. Int J Obes Relat Metab Disord 26:928-937, 2002.
36. Kim SH, Kim DJ, Seo IA, et al. Significance of beta2-adrenergic receptor gene polymorphism in obesity and type 2 diabetes mellitus in Korean subjects. Metabolism 51:833-837, 2002.
37. Van Rossum CT, Hoebee B, Seidell JC, et al. Genetic factors as predictor of weight gain in young adult Dutch men and women. Int J Obes Relat Metab Disord 26:517-528, 2002.
38. Garenc C, Perusse L, Chagnon YC, et al. Heritage Family Study. Obes Res 11:612-618, 2003.
39. Ellsworth DL, Coady SA, Chen W, Srinivasan SR, Boerwinkle E, Berenson GS. Interactive effects between polymorphisms in the bata-adrenergic receptors and longitudinal changes in obesity. Obes Res 13:519-526, 2005.
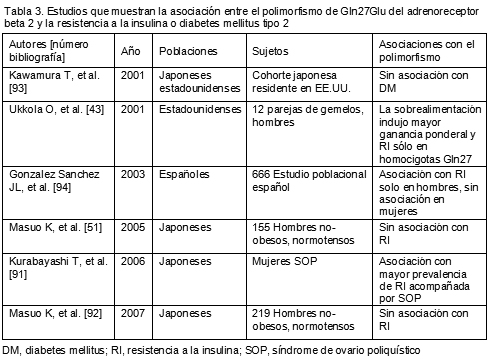
40. Ukkola O, Tremblay A, Bouchard C. Beta2-adrenergic receptor variants are associated with subcutaneous fat accumulation in response to long-term overfeeding. Int J Obes Relat Metab Disord 25:1604-1608, 2001.
41. Gjesing AP, Andersen G, Burgdorf KS, et al. Studies of the associations between functional beta (2) -adrenergic receptor variants and obesity, hypertension and type 2 diabetes in 7808 white subjects. Diabetologia 50:563-568, 2007.
42. Kurokawa N, Nakai K, Kameo S, Liu ZM, Satoh H. Association of BMI with the 3-adrenergic receptor gene polymorphism in Japanese. Meta-analysis. Obesity Res 9:741-745, 2001.
43. Ukkola O, Rankinen T, Weisnagel SJ, et al. Interactions among the alpha2-, beta2-, and beta3-adrenergic receptor genes and obesity-related phenotypes in the Quebec Family Study. Metabolism 49:1063-1070, 2000.
44. Kato N, Sugiyama T, Morita H, et al. Association analysis of 2-adrenergic receptor polymorphisms with essential hypertension in Japanese. Hypertension 37:286-292, 2001.
45. Bengtsson K, Orho-Melander M, Melander O, et al. 2-adrenergic receptor gene variation and hypertension in subjects with type 2 diabetes. Hypertension 37:1303-1308, 2001.
46. Hellstrom L, Large V, Reynisdotter H, Wahrenberg H, Arner P. The different effects of a Gln27Glu ß2-adrenoceptor gene polymorphism on obesity in males and in females. J Intern Med 245:253-259, 1999.
47. Clement K, Vasse C, Manning BS, et al. Genetic variation in the 3-adrenergic receptor and an increased capacity to gain weight in patients with morbid obesity. N Engl J Med 333:352-354, 1995.
48. Fujisawa T, Ikegami H, Yamato E, et al. Association of Trp64Arg mutation of the 3-adrenergic receptor with NIDDM and body weight gain. Diabetologia 39:349-352, 1996.
49. Ochoa MC, Marti A, Azcona C, et al. Grupo de Estudio Navarro de Obesidad Infantil (GENOI). Gene-gene interaction between PPRA gamma 2 and ADR beta 3 increases obesity risk in children and adolescents. Int J Obes Relat Metab Disord 28(Suppl.3):S37-S41, 2004.
50. Kawaguchi H, Masuo K, Katsuya T, et al. 2- and 3-adrenoceptor polymorphisms relate to subsequent weight gain and blood pressure elevation in obese normotensive individuals. Hypertens Res 29:951-959, 2006.
51. Masuo K, Katsuya T, Fu Y, Rakugi H, Ogihara T, Tuck ML. Beta2-adrenoceptor polymprphisms relate to insulin resistance and sympathetic overactivity as early markers of metabolic disease in nonobese, normotensive individuals. Am J Hypertens 18:1009-1014, 2005.
52. Anderson EA, Sinkey CA, Lawton WJ, Mark AL. Elevated sympathetic nerve activity in borderline hypertensive humans. Evidence from direct intraneural recording. Hypertension 14:177-183, 1989.
53. Gentile CL, Orr JS, Davy BM, Davy KP. Modest weight gain is associated with sympathetic neural activation in nonobese humans. Am J Physiol Regul Interg Comp Phisiol 292:R1834-1838, 2007.
54. Barnes MJ, Lapanowski K, Conley A, Rafols JA, Jen KL, Dunbar JC. High fat feeding is associated with increased blood pressure, sympathetic nerve activity and hypothalamic mu opioid receptors. Brain Res Bull 61:511-519, 2003.
55. Goldstein DS. Plasma catecholamines and essential hypertension. An analytical review. Hypertension 5:86-99, 1983.
56. Young JB, Macdonald IA. Sympathoadrenal activity in human obesity: heterogeneity of findings since 1980. Int J Obes Relat Metab Disord 12:952-967, 1992.
57. Carstensen E, Ramaiya K, Denver E, Mohamed-Ali V, Yudkin JS. The contribution of the sympatho-adrenomedullary system to the etiology of essential hypertension: A study using plasma and platelet catecholamine concentrations. J Clin Endocrinol Metab 80:455-460, 1995.
58. Masuo K, Ogihara T, Kumahara Y, Yamatodani A, Wada H. Increased plasma norepinephrine in young patients with essential hypertension under three sodium intakes. Hypertension 6:315-321, 1984.
59. Esler M, Lambert G, Kaye D, Rumantir M, Hastings J, Seals DR. Influence of ageing on the sympathetic nervous system and adrenal medulla at rest and during stress. Biogerontology 3:45-49, 2002.
60. Lambert E, Straznicky N, Eikelis N, et al. Gender differences in sympathetic nervous activity: influence of body mass and blood pressure. J Hypertens 25:1411-1419, 2007.
61. Anderson EA, Sinkey CA, Mark AL. Mental stress increases sympathetic merve activity during sustained baroreceptor stimulation in humans. Hypertension 17[Suppl.III]:III-43-III-49, 1991.
62. Perini C, Muller FB, Rauchfleisch U, Battegay R, Buhler FR. Effects of psychological and physical covariates on plasma catecholamines in borderline hypertensives and offspring of hypertensive patients. Clin Exp Hypertens A 112:137-150, 1990.
63. Kanayama N, Khatun S, Belayet H, She L, Terao T. Chronic local cold stress to the soles induces hypertension in rats. Am J Hypertens 12:1124-1129, 1999.
64. Alvarez GE, Beske SD, Ballard TP, Davy KP. Sympathetic neural activation in visceral obesity. Circulation 106:2533-2536, 2002.
65. Alvarez GE, Ballard TP, Beske SD, Davy KP. Subcutaneous obesity is not associated with sympathetic neural activation. Am J Physiol Heart Circ Physiol 287:H414-H418, 2004.
66. Hellstrom L, Reynisdottir S. Influence of heredity for obesity on adipocytes lipolysis in lean and obese subjects. Int Obes Relat Metab Disord 24:340-344, 2000.
67. Ferrannini E, Buzzigoli G, Bonadonna R, et al. Insulin resistance in essential hypertension. N Engl J Med 317:350-357, 1987.
68. Meehan WP, Buchanan TA, Hseuh W. Chronic insulin administration elevates blood pressure in rats. Hypertension 23:1012-1017, 1994.
69. Natali A, Bonadonna R, Santoro D, et al. Insulin resistance and vasodilation in essential hypertension. Studies with adenosine. J Clin Invest 94:1570-1576, 1994.
70. Tack CJ, Heeremans M, Thien T, Lutterman JA, Smits P. Regional hyperinsulinemia induces vasodilation but does not modulate adrenergic responsiveness in humans. J Cardiovas Pharmacol 28:245-251, 1996.
71. Masuo K, Mikami H, Ogihara T, Tuck ML. Prevalence of hyperinsulinemia in young, nonobese Japanese men. J Hypertens 15:157-165, 1997.
72. Masuo K, Katsuya T, Ogihara T, Tuck ML. Acute hyperinsulinemia reduces plasma leptin levels in insulin-sensitive Japanese men. Am J Hypertens 18:235-245, 2005.
73. Straznicky NE, Lambert GW, Masuo K, et al. Blunted sympathetic neural response to oral glucose in insulin resistant metabolic syndrome subjects. J Clin Endocrinol Metab 2008 (in press).
74. Ferrannini E, Haffner SM, Mitchell BD, Stern MD. Hyperinsulinemia: the key feature of a cardiovascular and metabolic syndrome. Diabetologia 34:416-422, 1991.
75. Ferrannini E. Physiologic and metabolic consequences of obesity. Metabolism 44:15-17, 1995.
76. Manicardi V, Camellini L, Bellodi G, Coscelli C, Ferrannini E. Evidence for and association of high blood pressure and hyperinsulinemia in obese men. J Clin Endocrinol Metab 62:1302-1304, 1996.
77. Montani JP, Antic V, Yang Z, Zulloo A. Pathways from obesity to hypertension: from the perspective of a vicious triangle. Int J obes Relat Metab Disord 26(Suppl.2):S28-S38, 2002.
78. Tuck ML, Sowers JR, Dornfeld L, Whitfield L, Maxwell M. Reductions in plasma catecholamines and blood pressure during weight loss in obese subjects. Acta Endocrinol (Copenh) 102:252-257, 1983.
79. Grassi G, Seravalle G, Colombo M, et al. Body weight reduction, sympathetic nerve traffic, and arterial baroreflex in obese normotensive humans. Circulation 97:2037-2042, 1998.
80. Landsberg L, Young JB. Fasting, feeding and regulation of the sympathetic nervous system. N Engl J Med 298:1295-1301, 1978.
81. O'Dea K, Esler M, Leonard D, Stockigt JR, Nestle P. Noradrenaline turnover during under- and over-eating in normal weight subjects. Metabolism 31:896-899, 1982.
82. Valentini M, Julius S, Palatini P, et al. Attenuation of haemodynamic, metabolic and energy expenditure responses to isoproterenol in patients with hypertension. J Hypertens 22:1999-2006, 2004.
83. Masuo K, Mikami H, Ogihara T, Tuck ML. Differences in insulin and sympathetic responses to glucose ingestion due to family history of hypertension. Am J Hypertens 9:739-745, 1996.
84. Blaak EE, Van Blaak MA, Kempen KP, Saris WH. Role of alpha- and beta-adrenoceptors in the sympathetically mediated thermogenesis. Am J Physiol 264:E11-E17, 1993.
85. Hagstrom-Toft E, Enoksson S, Moberg E, Bolinder J, Arner P. B-adrenergic regulation of lipolysis and blood flow in human skeletal muscle in vivo. Am J Physiol 275:E909-E916, 1998.
86. Enoksson S, Talbot M, Rife F, Tamborlane WV, Sherwin RS, Caprio S. Impaired in vivo stimulation of lipolysis in adipose tissue by selective 2-adrenergic agonist in obese adolescent girls. Diabetes 49:2149-2153, 2000.
87. Monroe MB, Seals DR, Shapiro LF, Bell C, Johnson D, Parker-Jones P. Direct evidence for tonic sympathetic support for resting metabolic rate in healthy adult humans. Am J Physiol 280:E740-E744, 2001.
88. Masuo K, Staznicky NE, Lambert GW, Esler MD. Obesity and obesity-related hypertension: Role of sympathetic nervous system and ß-adrenoceptor polymorphisms. Book "Sympathetic nervous system research developments" edited by Kaneko M. Nova Science Publishers, Inc., pp. 67-92, 2007.
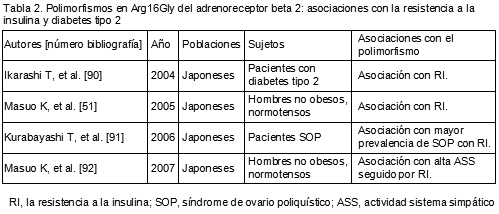
89. Masuo K, Katsuya T, Kawaguchi H, et al. 2-adrenoceptor polymorphisms relate to obesity through blunted leptin-mediated sympathetic activation. Am J Hypertens 19:1084-1091, 2006.
90. Ikarashi T, Hanyu O, Maruyama S, et al. Genotype Gly/Gly of the Arg16Gly polymorphism of the beta2-adrenergic receptor is associated with elevated fasting serum insulin concentrations, but not with acute insulin response to glucose, in type 2 diabetic patients. Diabetes Res Clin Pract 63:11-18, 2004.
91. Kurabayashi T, Yahata T, Quan J, Tanaka K. Association of polymorphisms in the beta2 and beta3 adrenoceptor gene with polycystic ovary syndrome. J Reprod Med 51:389-393, 2006.
92. Masuo K, Katsuya T, Sugimoto K, et al. High plasma norepinephrine levels associated with beta2-adrenoceptor polymorphisms predict future renal damage in nonobese normotensive individuals. Hypertens Res 30:503-511, 2007.
93. Kawamura T, Egusa G, Fujikawa R, Okubo M. Gln27Glu variant of the beta2-adrenergic receptor gene is not associated with obesity and diabetes in Japanese-Americans. Metabolism 50:443-446, 2001.
94. Gonzalez-Sanchez JL, Proenza AM, Martinez-Larrad MT, et al. The glutamine 27 glutamic acid polymorphism of the 2-adrenoceptor gene is associated with abdominal obesity and greater risk of impaired glucose tolerance in men but not in women: a population-based study in Spain. Clin Endocrinol 59:476-481, 2003.
95. Green SA, Turki J, Innis M, Liggett SB. Amino-terminal polymorphisms of human 2-adrenergic receptor impart distinct agonist-promoted regulatory properties. Biochemistry 33:9414-9419, 1994.
96. Dishy V, Sofowora GG, Xie HC, et al. The effect of common polymorphisms of the beta2-adrenergic receptor on agonist-mediated vascular desensitization. N Engl J Med 345:1030-1035, 2001.
97. Stob NR, Bell C, van Baak MA, Seals DR. Thermic effect of food and beta-adrenergic thermogenic responsiveness in habitually exercise and sedentary healthy adult humans. J Appl Physiol 103:616-622, 2007.
98. Bell C, Stob NR, Seals DR. Thermogenic responsiveness to nonspecific beta-adrenergic stimulation is not related to genetic variation in codon 16 of the beta2-adrenergic receptor. Am J Physiol Endocrinol Metab 290:E703-E707, 2006.
99. Walston J, Silver K, Bogardus C, et al. Time of onset of insulin-dependent diabetes mellitus and genetic variation in the ß3-adrenergic-receptor gene. N Engl J Med 333:345-347, 1995.
100. Widen E, Lehto M, Kanninen T, Walston J, Shuldiner AR, Groop LC. Association of a polymorphism in the 3-adrenergic-receptor gene with features of the insulin resistance syndrome in Finns. N Engl J Med 333:348-351, 1995.
101. Silver K, Walston J, Wang Y, Dowse G, Zimmet P, Shuldiner AR. Molecular scanning for mutations in the beta3-adrenergic receptor gene in Nauruans with obesity and noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab 81:4155-4158, 1996.
102. Fujisawa T, Ikegami H, Yamato E, et al. Trp64Arg mutation of beta3-adrenergic receptor in essential hypertension: insulin resistance and the adrenergic system. Am J Hypertens 10:101-105, 1997.
103. Sakane N, Yoshida T, Umekawa T, Kondo M, Sakai Y, Takahashi T. Beta3-adrenergic-receptor polymorphism: a genetic marker for visceral fat obesity and the insulin resistant syndrome. Diabetologia 40:200-204, 1997.
104. Rissanen J, Koupusjarvi J, Pihlajamaki J, et al. The Trp64Arg polymorphism of the beta3-adrenergic receptor gene. Lack of association with NIDDM and features of insulin resistance syndrome. Diabetes Care 20:1319-1323, 1997.
105. McFarlane-Anderson N, Bennett F, Wilks R, et al. The Trp64Arg mutation of the beta3-adrenergic receptor is associated with hyperglycemia and current body mass index in Jamaican women. Metabolism 47:617-621, 1998.
106. Garcia-Rubi E, Starling RD, Tchernof A, et al. Trp64Arg variant of the beta3-adrenoceptor polymorphism and insulin resistance in obese postmenopausal women. J Clin Endocrinol Metab 83:4002-4005, 1998.
107. Janssen JA, Koper JW, Stolk RP, et al. Lack of associations between serum leptin, a polymorphism in the gene for the beta3-adrenergic receptor and glucose tolerance in the Dutch population. Clin Endocriniol 49:229-234, 1998.
108. Ongphiphadhanakul B, Rajatanavin R, Chanprasertyothin S, et al. Relationship of beta3-adrenergic receptor gene mutation to total body fat but not percent body fat and insulin levels in Thais. Metabolism 48:564-567, 1999.
109. Pulkkinen A, Kareinen A, Saarinen L, Heikkinen S, Lehto S, Laakso M. The codon 64 polymorphism of the beta3-adrenergic receptor gene is not associated with coronary heart disease or insulin resistance in nondiabetic subjects and non-insulin-dependent diabetic patients. Metabolism 48:853-856, 1999.
110. Christiansen C, Poulsen P, Beck-Nielsen H. The Trp64Arg mutation of the adrenergic beta-3 receptor gene impairs insulin secretion: a twin study. Diabet Med 16:835-840, 1999.
111. Stangl K, Cascorbi I, Laule M, et al. The beta3-adrenergic receptor Trp64Arg is not associated with coronary artery disease. Metabolism 50:184-188, 2001.
112. Strazzulo P, Iacone R, Siani A, et al. Relationship of the Trp64Arg polymorphism of the beta3-adrenoceptor gene to central adiposity and high blood pressure: interaction with age. Cross-sectional ansd longitudinal findings of the Olivetti Prospective Heart Study. J Hypertens 19:399-406, 2001.
113. Ishii T, Hirose H, Kawai T, et al. Effects of intestinal fatty acid-binding protein gene Ala54Thr polymorphism and beta3-adrenergic receptor gene Trp64Arg polymorphism on insulin resistance and fasting plasma glucose in young to older Japanese men. Metabolism 50:1301-1307, 2001.
114. Porto PI, Garcia SI, Dieuzeide G, Gonzalez C, Landa MS, Pirola CJ. Clinical features of the metabolic syndrome in adolescents: minor role of the Trp64Arg beta3-adrenergic receptor gene variant. Pediatr Res 55:836-841, 2004.
115. Tsai PJ, Ho SC, Tsai LP, et al. Lack of relationship between beta3-adrenergic receptor gene polymorphism and gestational diabetes mellitus in a Taiwanese population. Metabolism 53:1136-1139, 2004.
116. Hojlund K, Christiansen C, Bjorrnsbo KS, et al. Energy expenditure, body composition and insulin response to glucose in male twins discordant for the Trp64Arg polymorphism of the beta3-adrenergic receptor gene. Diabetes Obes Metab 8:322-330, 2006.
117. Tamaki S, Nakamura Y, Tabara Y, et al. Relationship between metabolic syndrome and Trp64Arg polymorphism of the beta-adrenergic receptor gene in a general sample: the Shigaraki study. Hypertens Res 29:891-896, 2006.
118. Morcillo S, Cardona F, Rojo-Martinez G, et al. Effect of the combination of the variants-75G/A APOA1 and Trp64Arg ADRB3 on the risk of type 2 diabetes (DM2). Clin Endocrinol 68:102-107, 2008.
119. Gjesing AP, Andersen G, Borch-Johnsen K, Jorgensen T, Hansen T, Pedersen O. Association of the beta3-adrenergic receptor Trp64Arg polymorphism with common metabolic traits: Studies of 7065 middle-aged white people. Mol Genet Metab. Epub a head of print, 2008.
120. Dunajska K, Lwow F, Milewicz A, et al. Beta3-adrenergic receptor polymorphism and metabolic syndrome in postmenopausal women. Gynecol Endocrinol 24:133-138, 2008.




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: