ROSUVASTATINA, UN NUEVO INHIBIDOR DE LA HMG-COA REDUCTASA PARA EL TRATAMIENTO DE LA HIPERCOLESTEROLEMIA
(especial para SIIC © Derechos reservados)
Coautor
Angela Cheng-Lai, Pharm.D.*
Clinical Pharmacy Manager. Montefiore Medical Center. Department of Pharmacy*
Recepción del artículo: 13 de junio, 2005
Aprobación: 23 de junio, 2005
 Conclusión breve
La rosuvastatina es el último inhibidor de la HMG-CoA reductasa (estatinas) introducido en el mercado. En esta revisión se repasan las principales características farmacológicas de esta droga, en comparación con las demás estatinas y los principales estudios de eficacia clínica que se realizaron hasta el momento.
Conclusión breve
La rosuvastatina es el último inhibidor de la HMG-CoA reductasa (estatinas) introducido en el mercado. En esta revisión se repasan las principales características farmacológicas de esta droga, en comparación con las demás estatinas y los principales estudios de eficacia clínica que se realizaron hasta el momento.
 Resumen
Los inhibidores de la 3-hidroxil-3-metilglutaril coenzima A (HMG-CoA) reductasa (estatinas) se transformaron en los fármacos de primera elección para muchos pacientes con dislipidemias) en virtud de su excelente tolerabilidad y eficacia sobre los parámetros lipídicos. La rosuvastatina es la estatina más reciente y posee varias características favorables, como baja liposolubilidad, poca tendencia a las interacciones farmacológicas con el citocromo P450 y una potencia hipolipemiante superior, comparada con otras estatinas. La rosuvastatina fue estudiada en dosis de 1 a 80 mg. En los ensayos clínicos comparados, la rosuvastatina en dosis de 10 a 40 mg/día mostró disminuir el colesterol asociado a lipoproteínas de baja densidad (LDLc) en un grado significativamente superior al obtenido por atorvastatina, pravastatina y simvastatina, cuando son administradas en dosis equivalentes. Además, la rosuvastatina ejerce acciones benéficas sobre otros parámetros lipídicos como el colesterol asociado a lipoproteínas de alta densidad (HDLc) y los triglicéridos. Este fármaco puede causar toxicidad muscular, renal y hepática, aunque no se vio que éstas y otras reacciones adversas se presenten con mayor frecuencia con la rosuvastatina en comparación a las otras estatinas, cuando se la utiliza a las dosis aprobadas. Se desconocen los efectos de la rosuvastatina sobre la morbilidad y la mortalidad, los que en la actualidad están siendo analizados. En este artículo se repasan las propiedades farmacológicas y farmacocinéticas de esta nueva estatina.
Resumen
Los inhibidores de la 3-hidroxil-3-metilglutaril coenzima A (HMG-CoA) reductasa (estatinas) se transformaron en los fármacos de primera elección para muchos pacientes con dislipidemias) en virtud de su excelente tolerabilidad y eficacia sobre los parámetros lipídicos. La rosuvastatina es la estatina más reciente y posee varias características favorables, como baja liposolubilidad, poca tendencia a las interacciones farmacológicas con el citocromo P450 y una potencia hipolipemiante superior, comparada con otras estatinas. La rosuvastatina fue estudiada en dosis de 1 a 80 mg. En los ensayos clínicos comparados, la rosuvastatina en dosis de 10 a 40 mg/día mostró disminuir el colesterol asociado a lipoproteínas de baja densidad (LDLc) en un grado significativamente superior al obtenido por atorvastatina, pravastatina y simvastatina, cuando son administradas en dosis equivalentes. Además, la rosuvastatina ejerce acciones benéficas sobre otros parámetros lipídicos como el colesterol asociado a lipoproteínas de alta densidad (HDLc) y los triglicéridos. Este fármaco puede causar toxicidad muscular, renal y hepática, aunque no se vio que éstas y otras reacciones adversas se presenten con mayor frecuencia con la rosuvastatina en comparación a las otras estatinas, cuando se la utiliza a las dosis aprobadas. Se desconocen los efectos de la rosuvastatina sobre la morbilidad y la mortalidad, los que en la actualidad están siendo analizados. En este artículo se repasan las propiedades farmacológicas y farmacocinéticas de esta nueva estatina.
 Palabras clave
Rosuvastatina, estatina, drogas hipolipemiantes, inhibidores de la HMG CoA reductasa
Clasificación en siicsalud
Palabras clave
Rosuvastatina, estatina, drogas hipolipemiantes, inhibidores de la HMG CoA reductasa
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/74627
Especialidades
 Principal: Cardiología, Farmacología,
Principal: Cardiología, Farmacología,
 Relacionadas: Atención Primaria, Bioquímica, Endocrinología y Metabolismo, Medicina Farmacéutica, Medicina Interna, Nutrición,
Relacionadas: Atención Primaria, Bioquímica, Endocrinología y Metabolismo, Medicina Farmacéutica, Medicina Interna, Nutrición,
 Enviar correspondencia a:
Enviar correspondencia a:
James J. Nawarskas, Pharm.D. University of New Mexico. College of Pharmacy. 2502 Marble NE. Albuquerque, NM 87113. EE.UU.
ROSUVASTATIN-A NEW HMG-COA REDUCTASE INHIBITOR FOR THE TREATMENT OF HYPERCHOLESTEROLEMIA
 Abstract
Abstract
Because of their excellent tolerability and positive impact on lipid parameters, 3-hydroxy-3-methylglutaryl conenzyme A (HMG-CoA) reductase inhibitors (statins) have become the drugs of first choice for many patients with dyslipidemia. Rosuvastatin is the newest statin, which possesses a number of favorable characteristics, including low lipophilicity, high hepatocyte selectivity, minimal metabolism, a low propensity for cytochrome P450 drug interactions, and superior lipid-lowering potency compared to other statins. Rosuvastatin has been studied at doses ranging from 1 to 80 mg. In comparative clinical trials, rosuvastatin at dosages of 10 to 40 mg/day has been shown to reduce low-density lipoprotein (LDL) cholesterol to a significantly greater extent than atorvastatin, pravastatin, and simvastatin when given on an equal milligram basis. In addition, rosuvastatin has beneficial effects on other lipid parameters such as high-density lipoprotein (HDL) cholesterol and triglycerides. Rosuvastatin may cause myotoxicity, nephrotoxicity, and hepatotoxicity, but these and other adverse reactions have not been shown to occur at higher rates with rosuvastatin compared to other statins when used at approved dosages. The effects of rosuvastatin on morbidity and mortality are unknown and currently under investigation. The pharmacologic and pharmacokinetic properties of this new statin are review in this article.
 Key words
Key words
Rosuvastatin, statin, lipid-lowering drugs, HMG CoA reductase inhibitors
ROSUVASTATINA, UN NUEVO INHIBIDOR DE LA HMG-COA REDUCTASA PARA EL TRATAMIENTO DE LA HIPERCOLESTEROLEMIA
(especial para SIIC © Derechos reservados)
Artículo completo
La hiperlipidemia, especialmente la elevación de las concentraciones del colesterol asociado a lipoproteínas de baja densidad (LDLc), es reconocida como uno de los factores de riesgo principales de la enfermedad coronaria. Afortunadamente, la colesterolemia se puede modificar con una dieta adecuada, cambios en los hábitos de vida y tratamiento farmacológico. Los estudios de prevención primaria y secundaria demostraron que la disminución adecuada de los niveles de LDLc constituye una estrategia terapéutica efectiva para reducir la morbilidad y mortalidad coronarias.1-9 Por estos motivos, el Third National Cholesterol Education Program Adult Treatment Panel (NCEP-ATP III) sigue reconociendo que la reducción de los niveles de LDLc es el objetivo principal del tratamiento hipolipemiante.10-11 Las metas principales de dicho tratamiento y los valores umbrales para su iniciación se establecen en función de los valores de LDLc.10,11
Un porcentaje importante de pacientes adecuados no reciben drogas hipolipemiantes, a pesar de la existencia de pautas terapéuticas bien establecidas y de una variedad de estos fármacos.12-14 Por otra parte, muchos de los pacientes que sí son tratados farmacológicamente no logran sus objetivos terapéuticos.12-14 De acuerdo con los resultados de un análisis, existe un preocupante 82% de adultos con enfermedad coronaria medicados que no alcanzan el objetivo de un valor de LDLc inferior a 100 mg/dl.15 Además, al establecer el NCEP III el concepto de equivalentes de riesgo de enfermedad coronaria (enfermedad vascular aterosclerótica no coronaria, diabetes, factores de riesgo múltiples) y proponer que el objetivo de LDLc sea inferior a 70 mg/dl, una cantidad mayor de individuos estará expuesta a no alcanzar dicho objetivo terapéutico.10,11 En este contexto, es necesario implementar un tratamiento más agresivo de las dislipidemias, de manera tal que se puedan alcanzar los objetivos establecidos por las pautas del NCEP. También se hace ineludible la creación de fármacos hipolipemiantes más efectivos y con menos efectos colaterales que permitan promover la utilización del tratamiento farmacológico y optimizar sus resultados en aquellos pacientes que no pueden alcanzar los objetivos LDLc solamente con cambios en su estilo de vida.
Los inhibidores de la 3-hidroxi-3-metilglutaril coenzima A (HMG-CoA) reductasa (estatinas) son los fármacos de primera elección para muchos pacientes con dislipidemias en virtud de su excelente tolerabilidad y sus acciones sobre el LDLc y el colesterol no HDL. En los Estados Unidos están disponibles seis inhibidores de la HMG-CoA reductasa: atorvastatina, fluvastatina, lovastatina, pravastatina, rosuvastatina y simvastatina (la cerivastatina fue retirada del mercado en agosto de 2001 debido al aumento de los casos de miotoxicidad). La rosuvastatina fue el último en ser aprobado por la Food and Drug Administration de los Estados Unidos, en agosto de 2003. En este artículo se pasará revista a las propiedades farmacodinámicas y farmacocinéticas de esta nueva estatina.
Farmacología
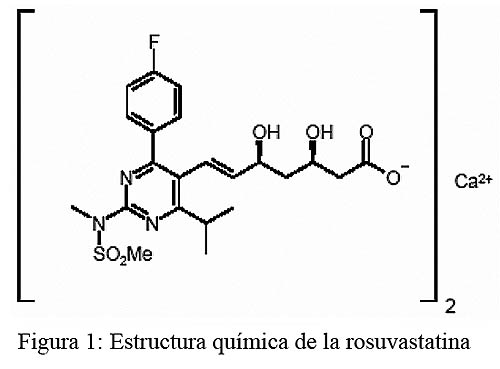
La rosuvastatina es un ácido hidroxilado completamente sintético, activo por vía oral y con un único enantiómero (3R, 5S).16 Su estructura química pertenece a una serie nueva de metanosulfonamidas pirimidínicas y 3,5-dihidroxi-6-heptenoatos N-metanosulfonil pirrol sustituidos (véase figura 1).17 Además de sus características de farmacoforo, el agregado de un grupo sulfonamida metano polar estable como región hidrofílica le confiere a la molécula baja liposolubilidad.18 La rosuvastatina tiene cualidades lipofílicas similares a las de la pravastatina pero inferiores a las de las otras estatinas disponibles (tabla 1). Si bien otros fármacos de este grupo no presentan –relativamente– selectividad hacia una variedad de tipos celulares, la rosuvastatina y la pravastatina sí la tienen para los hepatocitos.19 En virtud de su hidrosolubilidad relativa, la rosuvastatina accede limitadamente a las células no hepáticas como resultado de la difusión pasiva disminuida y la captación aumentada de las células hepáticas a través del transporte selectivo de aniones orgánicos.20

Como las demás estatinas, la rosuvastatina disminuye la biosíntesis del colesterol a través de la inhibición competitiva de la HMG-CoA reductasa –la enzima responsable de la conversión de la HMG-CoA en mevalonato–, un precursor de los esteroles, incluido el colesterol. La disminución de la concentración intracelular del colesterol produce la regulación positiva de los receptores para LDL en el hígado, con lo cual aumenta la depuración de esta lipoproteína del plasma. Los inhibidores de la HMG-CoA reductasa también pueden afectar la síntesis del LDL al disminuir la producción hepática de lipoproteínas de muy baja densidad (VLDL) y promover el catabolismo de VLDL remanente.21 Además, las estatinas pueden interferir con la formación de las lipoproteínas al disminuir la síntesis del colesterol. Estudios recientes mostraron que, más allá de sus propiedades hipolipemiantes, los inhibidores de la HMG-CoA reductasa ejercen acciones protectoras vasculares.22 En un estudio llevado a cabo en ratas, se observó que la rosuvastatina tenía efectos antiinflamatorios sobre el endotelio microvascular a través de la inhibición de la expresión de las moléculas de adhesión celular endoteliales y el aumento de la liberación del óxido nítrico.22 Los mecanismos de los efectos distintos de los hipolipemiantes que este grupo de fármacos presentan podrían atribuirse a la disminución de la síntesis o disponibilidad del ácido mevalónico dentro de las células endoteliales.22
La capacidad para inhibir la HMG-CoA reductasa depende de la afinidad del compuesto por el sustrato y por la duración temporal de esta unión.18 Se vio que las estatinas se unen estrecha e irreversiblemente a un sitio de unión específico de la HMG-CoA reductasa.18 El agregado de un grupo metano sulfonamida a la molécula de la rosuvastatina no sólo aumenta su hidrosolubilidad, sino también incrementa su capacidad para interactuar con la enzima (esto es, promoviendo las uniones iónicas).17,18 La afinidad de la rosuvastatina por la enzima está reflejada por la concentración necesaria para inhibir el 50% de la síntesis del colesterol (CI50).18 En los hepatocitos de la rata, se observó que este fármaco presenta una potencia inhibitoria significativamente superior a las otras cinco estatinas.23 La rosuvastatina posee una CI50 de 0.16 nM, la más baja, comparada con 1.16, 2.74, 3.54, 3.78 y 6.93 nM de la atorvastatina, simvastatina, cerivastatina, fluvastatina y pravastatina, respectivamente.23
Farmacocinética
La rosuvastatina se absorbe con una rapidez moderada y su biodisponibilidad por vía oral es de aproximadamente el 20%.18,24 La concentración plasmática máxima (Cmáx) y el área bajo la curva concentración-tiempo (AUC0-24) exhiben una relación relativamente lineal cuando la droga se administra entre 5 y 80 mg en dosis única o tras siete dosis diarias.25 En este último caso no se observa una acumulación significativa durante el estado estacionario.25 La droga alcanza una Cmáx de 6.1 ng/ml en aproximadamente 5 horas luego de una dosis única de 20 mg por vía oral.26 Con la administración prolongada de 20 mg diarios, la Cmáx del estado estacionario de 9.7 ng/ml se obtiene a las 3 horas.25 Las comidas disminuyen la tasa de absorción en un 20%, pero la absorción neta no se modifica.18 Al contrario de lo observado con muchas otras estatinas, los efectos farmacodinámicos y farmacocinéticos de la rosuvastatina no parecen estar afectados por el momento del día en que el fármaco se administra.27
El fármaco se une reversiblemente a las proteínas plasmáticas en un 88%. En el estado estacionario, este agente tiene un volumen de distribución principal de 134 litros.18 La rosuvastatina no se metaboliza principalmente en el hígado. El 90% de una dosis oral única se excreta por la vía biliar y se recupera en las heces (92% como el compuesto madre).26,28 El 10% de una dosis oral se recupera en la orina (50% como metabolitos).26,28 La droga se biotransforma muy lentamente por los hepatocitos (5% a 50% a lo largo de 3 días). Se identificó un metabolito principal N-desmetilado, el cual es siete veces menos potente que el compuesto madre, rosuvastatina, respecto de la inhibición de la HMG-Coa reductasa.18,29 La formación de este metabolito está inhibida por el sulfafenazol y en menor medida por el omeprazol, lo que indica que CYP2C9 y CYP2C19 son las enzimas metabólicas principales.29 Debido a que la rosuvastatina se metaboliza muy lentamente y en un grado menor por las isoenzimas del CYP, es muy poco probable que tengan lugar interacciones medicamentosas metabólicas clínicamente significativas.18,29
Esta estatina posee una vida media de eliminación (t1/2) prolongada, de aproximadamente 20 horas, lo cual se correlaciona con la inhibición duradera de la HMG-CoA reductasa.23,24 En comparación con otras estatinas, la rosuvasatina presenta en las ratas una inhibición prolongada de la síntesis del colesterol. A las 7 horas posteriores a una dosis por vía oral, esta droga mostró una inhibición del 62%, comparada al 7% de la atorvastatina, 31% de la cerivastatina y 13% de la simvastatina.30 En los humanos, ni la edad ni el sexo modifican significativamente la farmacocinética de la rosuvastatina.31 De la misma manera, los parámetros farmacocinéticos (AUC0-24 y Cmáx) tampoco están afectados por los trastornos hepáticos leves a moderados.32 Las concentraciones plasmáticas del fármaco aumentan levemente en los pacientes con enfermedad hepática crónica por alcoholismo. En individuos del grupo A de la clasificación de Child-Pugh se observaron aumentos de la Cmáx y el AUC de 60% y 5%, respectivamente, y del 100% y 21% en sujetos del grupo B, en comparación con los pacientes cuya función hepática estaba dentro de los parámetros normales.33
Aunque parece que los efectos hipolipemiantes de la rosuvastatina disminuyen en aquellos pacientes con alteraciones hepáticas más graves, en los que presentan trastornos leves a moderados siguen observándose reducciones clínicamente significativas de la concentración del LDLc.32 La farmacocinética de la rosuvastatina no está afectada por las alteraciones renales leves a moderadas (depuración de creatinina > 30 ml/min/1.73 m2), pero en las graves (Clcr < 30 ml/min/1.73 m2) pueden aumentar hasta tres veces las concentraciones plasmáticas del fármaco.33 Las propiedades farmacocinéticas de las estatinas disponibles en la actualidad se presentan en la tabla 1.
Eficacia clínica
Se llevaron a cabo varios ensayos clínicos con rosuvastatina en pacientes con hipercolesterolemia primaria, hipertrigliceridemia y otras dislipidemias, en los cuales la droga fue estudiada en dosis de 1 a 80 mg diarios. La reducción porcentual de la concentración del LDLc sérico ha sido frecuentemente el criterio de valoración principal en estos estudios y los secundarios incluyeron la disminución de los valores de colesterol total, apolipoproteína B (Apo B) y triglicéridos desde el inicio. Muchos de estos ensayos también evaluaron los efectos sobre el HDLc, apolipoproteína A-I (Apo A-I), las proporciones entre las distintas fracciones lipídicas y los porcentajes de pacientes que alcanzaron los objetivos del NCEP. La mayor parte de los estudios realizados con rosuvastatina son de corta duración. Los ensayos más prolongados publicados hasta la fecha evaluaron a los pacientes a lo largo de 1 año. A continuación se presenta un resumen de algunos de estos estudios.
Hipercolesterolemia
Se estudiaron los efectos de la rosuvastatina en pacientes con hipercolesterolemia moderada (LDLc en ayunas > 160 y < 240 mg/dl, triglicéridos < 300 mg/dl) en un ensayo aleatorizado, controlado con placebo y con dosis aumentadas, mediante el empleo de un diseño de fase doble.34 En la primera fase, se eligieron 142 pacientes que fueron incluidos en período de prealeatorización (run-in) de 6 semanas, durante las cuales siguieron una dieta, para luego proseguir con otras 6 semanas de tratamiento en las que recibieron placebo o rosuvastatina (1, 2.5, 5, 10, 20 o 40 mg una vez al día) a doble ciego, o atorvastatina (10 u 80 mg una vez al día) con diseño abierto. En la segunda fase se escogieron 64 pacientes que fueron aleatorizados a un período de 6 semanas en las que recibieron –a doble ciego– placebo o rosuvastatina (40 o 80 mg) una vez por día (proporción 1:1:2). Los resultados de ambas fases se combinaron para analizar los efectos sobre los lípidos. No se realizó la comparación estadística de los pacientes que fueron medicados con atorvastatina con los que recibieron placebo o rosuvastatina. Sin embargo, con la atorvastatina se observaron reducciones del LDLc del 44% (10 mg) y 59% (80 mg) luego de 6 semanas de tratamiento. Con la rosuvastatina se observaron descensos del LDLc dependientes de las dosis en comparación con el placebo (p < 0.001), los cuales oscilaron entre el 34% (1 mg) al 65% (80 mg).34 Cada vez que se duplicó la dosis de rosuvastatina se observó una reducción adicional del 4.5% en la concentración del LDLc.34 Aproximadamente el 90% de esta disminución tuvo lugar durante las dos primeras semanas de tratamiento.34 Además, con esta droga también se observaron sistemáticamente aumentos en el HDLc (9% a 14% desde el inicio) y descensos en los niveles de triglicéridos (-10% a -35% desde el inicio), cambios que se consideraron estadísticamente significativos en comparación con placebo a las mismas dosis (10 y 80 mg para los aumentos en el HDLc; 5, 40 y 80 mg para la reducción de los triglicéridos) aunque no dependientes de la dosis. Los eventos adversos fueron similares entre los grupos que recibieron placebo y los medicados. No se observaron aumentos significativos de la alanina amino transferasa o de la creatina quinasa.
En un estudio aleatorizado, a doble ciego, de grupos paralelos, de 12 semanas de duración (más un período de 6 semanas de prealeatorización de 6 semanas), Paoletti y col. compararon la rosuvastatina en dosis de 5 y 10 mg/día con pravastatina 20 mg/día y simvastatina 20 mg/día en 502 pacientes con hipercolesterolemia (LDLc en ayunas > 160 y < 250 mg/dl, triglicéridos > 400 mg/dl).35 La rosuvastatina a 5 y 10 mg disminuyó el LDLc entre el 42% y el 49%, respectivamente, comparado con el 28% para pravastatina (p < 0.001 versus ambas dosis de rosuvastatina) y el 37% de simvastatina (p < 0.01 vs. rosuvastatina 5 mg y p < 0.001 vs. 10 mg). Además, ambas dosis de rosuvastatina fueron significativamente más efectivas que la pravastatina (p < 0.001 vs. ambas dosis) o que la simvastatina (p < 0.01 vs. 5 mg; p < 0.001 vs. 10 mg) para reducir la concentración plasmática del colesterol total. Los pacientes tratados con rosuvastatina también presentaron menores concentraciones de Apo B sérica, comparados con los que recibieron pravastatina (p < 0.001 para ambas dosis) o simvastatina (p < 0.005 para 5 mg; p < 0.001 para 10 mg). El HDLc aumentó 6% a 7% en los individuos tratados con rosuvastatina y 4% en los grupos medicados con pravastatina y simvastatina (diferencias no significativas). El descenso de los niveles de triglicéridos osciló entre 12% y 18% y no difirió significativamente entre los grupos tratados. En resumen, el 71% (5 mg) y 87% (10 mg) de los pacientes que recibieron rosuvastatina alcanzaron los objetivos del NCEP ATP II comparados con los pacientes tratados con pravastatina (53%) y simvastatina (64%). Entre los pacientes del grupo de riesgo elevado (ateroesclerosis o diabetes), el 42% (rosuvastatina 5 mg), 67% (rosuvastatina 10 mg), 7% (pravastatina 20 mg) y 19% (simvastatina 20 mg) también cumplimentaron dichos objetivos. Cuando estos resultados fueron analizados nuevamente a través de las recomendaciones del NCEP ATP III, el 64% (rosuvastatina 5 mg), 84% (rosuvastatina 10 mg), 48% (pravastatina 20 mg) y 64% (simvastatina 20 mg) de los pacientes alcanzaron las metas en los cuatro grupos de tratamiento.
Davidson y col. llevaron a acabo un estudio aleatorizado, a doble ciego y controlado con placebo para comparar los efectos de la rosuvastatina con los de la atorvastatina en pacientes con hipercolesterolemia tipo IIa o IIb (LDLc en ayunas > 160 y < 250 mg/dl; triglicéridos < 400 mg/dl).36 Luego de un período de preinclusión y dieta de 6 semanas, 516 pacientes fueron aleatorizados a 12 semanas de una toma diaria de placebo, rosuvastatina 5 mg, rosuvastatina 10 mg o atorvastatina 10 mg. Comparada con la atorvastatina, la rosuvastatina 5 y 10 mg se asoció con reducciones mayores de los niveles del LDLc del inicio (-35% versus -40% y -43%, p < 0.01 y 0.001, respectivamente). Además, con estas dos dosis (5 y 10 mg) la rosuvastatina fue significativamente más efectiva que la atorvastatina 10 mg para aumentar las concentraciones del HDLc (13% y 12% versus 8%, p < 0.01 y 0.05, respectivamente). En los pacientes medicados con rosuvastatina también hubo descensos significativos de los niveles del colesterol total y Apo B y aumentos de la Apo A-I, en comparación con la atorvastatina. En los grupos que recibieron 5 y 10 mg de rosuvastatina las disminuciones de los triglicéridos fueron de 17% y 19%, respectivamente, comparados con el 19% de los que recibieron 10 mg de atorvastatina (diferencias no significativas). En resumen, el 84% de los pacientes medicados con rosuvastatina (5 y 10 mg) y el 73% de los que recibieron atorvastatina (10 mg) alcanzaron las metas del NCEP ATP II (un porcentaje similar de pacientes logró dichos objetivos cuando se los volvió a analizar a través de las pautas del NCEP ATP III). Estas metas se alcanzaron en las primeras dos semanas de tratamiento para la casi totalidad de los pacientes. Aquellos individuos pertenecientes a los grupos de riesgo elevado (aterosclerosis o diabetes) que lograron los objetivos del NCEP ATP II fueron el 42% de los medicados con rosuvastatina 5 mg, 47% con rosuvastatina 10 mg y 19% con atorvastatina 10 mg. Todos los tratamientos fueron bien tolerados.
Se publicaron dos estudios de largo plazo (1 año) que compararon rosuvastatina con otras estatinas (con atorvastatina, uno, y con pravastatina y simvastatina, otro) en pacientes con hipercolesterolemia (LDLc en ayunas > 160 y < 250 mg/dl; triglicéridos < 400 mg/dl).37,38 En un estudio de grupos paralelos de 52 semanas de duración, aleatorizado y a doble ciego, se escogieron 412 pacientes que fueron aleatorizados para recibir rosuvastatina 5 mg (n = 138), rosuvastatina 10 mg (n = 134) o atorvastatina 10 mg (n = 140) durante 12 semanas, seguido de un período de 40 semanas de escalamiento de dosis según la respuesta del LDLc.37 Comparado con la atorvastatina, el tratamiento con la rosuvastatina se asoció con disminuciones significativamente mayores del LDLc en las semanas 12 y 52. En la semana 12, las reducciones del LDLc fueron del 46%, 50% y 39% para los medicados con rosuvastatina 5 mg, rosuvastatina 10 mg y atorvastatina 10 mg, respectivamente (p < 0.001 para ambas dosis de rosuvastatina en comparación con atorvastatina). En dicha semana, las reducciones de los niveles de LDLc desde el inicio fueron del 47% y 53% en los grupos que recibieron, respectivamente, rosuvastatina 5 y 10 mg, comparados con el 44% de los medicados con atorvastatina 10 mg (p < 0.05 versus atorvastatina para ambas dosis de rosuvastatina). Para los pacientes que comenzaron el estudio con rosuvastatina 5 mg, rosuvastatina 10 mg y atorvastatina 10 mg, las dosis diarias promedio que recibieron en la semana 52 fueron de 9.3, 13.4 y 20.8, respectivamente. Las metas del NCEP ATP II fueron obtenidas a las 12 semanas por 86%, 89% y 73% de los pacientes tratados con rosuvastatina 5 y 10 mg y atorvastatina 10 mg. Estas cifras resultaron similares cuando se aplicaron las pautas del NCEP ATP III. En la semana 52, los objetivos del NCEP ATP II fueron alcanzados por el 88%, 98% y 87% de los pacientes medicados, respectivamente, con rosuvastatina 5 mg, rosuvastatina 10 mg y atorvastatina 10 mg. Los pacientes de riesgo elevado (enfermedad coronaria, enfermedad vascular periférica o diabetes [objetivo LDLc < 100 mg/dl]) que alcanzaron las metas del NCEP ATP II a las 52 semanas, fueron el 65%, 97% y 61% de los medicados con rosuvastatina 5 mg, rosuvastatina 10 mg y atorvastatina 10 mg, respectivamente.
En otro estudio de grupos paralelos, aleatorizado, con doble enmascaramiento, se compararon los efectos hipolipemiantes de la rosuvastatina con los de pravastatina y simvastatina.38 Luego de un período de preinclusión de 6 semanas en el que los pacientes estuvieron sometidos a una dieta, se escogieron 477 y fueron aleatorizados para recibir durante 12 semanas rosuvastatina 5 mg, rosuvastatina 10 mg, pravastatina 20 mg o simvastatina 20 mg, seguido de un período de 40 semanas. A las 12 semanas, 39%, 47%, 27% y 35% de los pacientes tratados, respectivamente, con rosuvastatina 5 mg, rosuvastastina 10 mg, pravastatina y simvastatina, redujeron los niveles del LDLc (p < 0.05 para ambas dosis de rosuvastatina comparadas con pravastatina y simvastatina). En la semana 52, los descensos del LDLc desde el inicio fueron del 42% y 48% de los que recibieron rosuvastatina 5 y 10 mg, comparado al 32% del grupo medicado con pravastatina y el 38% del grupo simvastatina (p < 0.05 para la rosuvastatina comparada con la pravastatina y simvastatina, excepto para la rosuvastatina 5 mg versus la simvastatina, cuyas diferencias no fueron estadísticamente significativas). Los pacientes que comenzaron con las dosis arriba mencionadas alcanzaron, hacia la semana 52, dosis diarias promedio de 9.5, 13.8, 32.6 y 36.3 mg de la estatina correspondiente. Para la semana 52, el 88% de los pacientes que habían recibido cualquiera de las dos dosis de rosuvastatina alcanzó las metas del NCEP ATP II en comparación con el 60% de los que recibieron pravastatina y el 73% de los medicados con simvastatina. Dichos objetivos también fueron obtenidos por aquellos pacientes pertenecientes a la categoría de riesgo elevado (objetivo LDLc < 100 mg/dl), es decir el 84% de los que recibieron rosuvastatina 5 mg, 71% (rosuvastatina 10 mg), 6% (pravastatina) y 30% (simvastatina) a las 52 semanas de tratamiento.
Schneck y col. llevaron a cabo otro estudio de grupos paralelos, aleatorizado y a doble ciego en el que compararon varias dosis de rosuvastatina y atorvastatina en 374 pacientes con una concentración de LDLc entre 160 y 249 mg/dl y niveles de triglicéridos en ayunas menores a 400 mg/dl.39 Hubo 9 grupos de tratamiento (rosuvastatina 5, 10, 20, 40, 80 mg y atorvastatina 10, 20, 40 y 80 mg) con 38-45 individuos por grupo. Luego de un período de 6 semanas de tratamiento se hicieron evidentes para ambos grupos los descensos del LDLc relacionados con las dosis, los cuales oscilaron entre 42 y 62 mg/dl con rosuvastatina y 38 a 54 mg/dl con atorvastatina. Cuando se compararon ambos grupos con la misma dosis, la rosuvastatina mostró sistemáticamente un descenso adicional absoluto del LDLc del 8% comparada con la atorvastatina en dosis de 10 a 80 mg/día (p < 0.001 a lo largo de todo el intervalo de dosis). Además, la rosuvastatina aumentó más los niveles del HDLc que la atorvastatina para cualquier dosis, aunque fue sólo estadísticamente significativa para las de 40 mg (12% versus 4% de aumento) y 80 mg (10% versus 2% de aumento). Los descensos de los niveles de los triglicéridos fueron similares entre los grupos, aunque los 80 mg de atorvastatina (reducción del 34.5%) superaron a los 80 mg de rosuvastatina (reducción del 19.7%; p < 0.05). Con la rosuvastatina, las concentraciones de la apolipoproteína B se redujeron significativamente más en el intervalo de 10 a 80 mg. Los efectos adversos fueron comparables entre los grupos, sin reacciones adversas serias atribuibles a los medicamentos en estudio.
Un estudio abierto y aleatorizado analizó los efectos de la rosuvastatina asociada a la niacina de liberación prolongada en 279 pacientes con dislipidemia combinada (LDL de inicio = 145-146 mg/dl).40 Hubo cuatro grupos de tratamiento: rosuvastatina 10 mg hasta 40 mg/día (n = 46), niacina de liberación prolongada 500 mg hasta 2 g/día (n = 72), rosuvastatina 10 mg hasta 40 mg + niacina de liberación prolongada 500 mg hasta 1 g/día (n = 72) y rosuvastatina 10 mg (dosis fija) + niacina de liberación prolongada 500 mg hasta 2 g/día (n = 80). Luego de 24 semanas de tratamiento, el promedio de los cuadrados mínimos del descenso del LDLc fue de 48%, 0.1%, 42% y 36% y la reducción de los triglicéridos de 33%, 21%, 39% y 34% en los grupos medicados solamente con rosuvastatina o niacina, rosuvastatina 40 mg + niacina y rosuvastatina 10 mg + niacina (estadísticamente no significativas excepto p < 0.01 para la disminución del LDLc con la rosuvastatina sola versus niacina sola y versus 10 mg de rosuvastatina + niacina). Para los mismos grupos, el HDLc aumentó el 11%, 12%, 17% y 24% (la única diferencia estadísticamente significativa [p < 0.001] fue el aumento del 11% versus 25%). No hubo reacciones adversas serias debidas a los tratamientos en estudio. Cinco pacientes presentaron mialgias (3 en el grupo de rosuvastatina sola) y el eritema constituyó la reacción adversa más frecuente de los pacientes medicados con niacina.
El Statin Theapies for Elevated Lipid Levels compare Across dosis to Rosuvastatin (STELLAR) fue un estudio aleatorizado, de grupos paralelos y abierto, diseñado para comparar la eficacia hipocolesterolémica de la rosuvastatina 10-40 mg/día con las de la atorvastatina, pravastatina y simvastatina a través de los intervalos de dosis aprobados por la Food and Drug Administration (FDA) para estas drogas.41 El estudio de 6 semanas de duración fue completado por 2 288 pacientes con niveles de LDLc de entre 160 y 249 mg/dl y de triglicéridos inferiores a 400 mg/dl. Hacia el final del ensayo, los 10 mg diarios de rosuvastatina, atorvastatina, pravastatina y simvastatina disminuyeron el LDLc en 46%, 37%, 28% y 20%, respectivamente. Las dosis de 20 y 40 mg produjeron, a su vez, descensos del 52%, 43%, 35%, 24% y 55%, 48%, 39% y 30%. El valor de p fue inferior a 0.001 para la rosuvastatina comparada con las demás estatinas a cada dosis individual. También se analizaron las dosis de 80 mg diarios de atorvastatina y simvastatina, las que produjeron reducciones del LDLc del 41% y 46%, respectivamente (sólo fue estadísticamente significativa la diferencia de rosuvastatina 40 mg versus simvastatina, no para la atorvastatina). Con dosis de 10 mg diarios, el HDLc aumentó 8% (rosuvastatina), 6% (atorvastatina), 5% (simvastatina) y 3% (pravastatina), incrementos que resultaron del 19%, 5%, 6%, 4% y 10%, 4%, 5%, y 6% para los 20 y 40 mg diarios de cada droga respectiva. En casi todos los casos, la rosuvastaina fue estadísticamente superior a todas las demás estatinas respecto del aumento del HDLc a cada dosis individual. Asimismo, la dosis de 10 mg diarios produjo reducciones de los triglicéridos de 20% (rosuvastatina), 20% (atorvastatina), 12% (simvastatina) y 8% (pravastatina; p < 0.002 versus rosuvastatina). Con los 20 y 40 mg/día, estos descensos fueron del 24%, 23%, 18%, 8% y 26%, 27%, 25% y 13%, respectivamente. En relación con la disminución de los triglicéridos, la rosuvastatina fue superior a la pravastatina para cada dosis individual, a la simvastatina con dosis de 4 mg y a la pravastatina a cualquier dosis. Los objetivos del NCEP ATP III fueron alcanzados por el 82%-89%, 69%-85%, 39%-82% y 31%-55% de los pacientes que, respectivamente, recibieron rosuvastatina, atorvastatina, simvastatina y pravastatina. En resumen, la rosuvastatina fue superior a la simvastatina y la pravastatina y comparable a la atorvastatina, respecto del cumplimiento de las metas del NCEP ATP III. Cada tratamiento fue relativamente bien tolerado y con efectos adversos que ocurrieron a tasas similares entre dichos tratamientos.
Hipertrigliceridemia
Hunninghake y col. compararon rosuvastatina (5 a 80 mg diarios) con placebo en 156 pacientes con hipertrigliceridemia (triglicéridos en ayunas > 300 < 800 mg/dl).42,43 Tras un período de preinclusión de 6 semanas de duración, en el cual los pacientes recibieron una dieta, los individuos (10% con diabetes mellitus) fueron aleatorizados para recibir placebo o rosuvastatina 5, 10, 20, 40 u 80 mg durante 6 semanas. Comparada con el placebo, la rosuvastatina se asoció con descensos significativos de los triglicéridos plasmáticos totales a todas las dosis (18% y 40%, respectivamente, p < 0.01 para la rosuvastatina 5 mg; p < 0.001 para las dosis de 10 a 80 mg). Además, este fármaco mejoró el perfil aterogénico respecto del LDLc (reducción del 28% al 45%), HDLc (aumento del 4% al 18%), colesterol total, VLDLc, Apo B y las relaciones lipídicas. Con la excepción de lo observado con el HDLc con la dosis de 5 mg, los cambios producidos en el HDLc y LDLc fueron estadísticamente significativos para todas las dosis de la rosuvastatina en comparación con placebo.
Hipercolesterolemia heterocigota familiar
En 622 pacientes con hipercolesterolemia heterocigota familiar (LDLc en ayunas > 220 y < 500 mg/dl; triglicéridos < 400 mg/dl) se compararon los efectos de la rosuvastatina con los de la atorvastatina en un estudio a doble ciego, de grupos paralelos, con escalamiento de dosis y aleatorización ponderada.44 Tras un período de preinclusión de 6 semanas de dieta, los pacientes seleccionados fueron aleatorizados para recibir 20 mg de atorvastatina (n = 187) o rosuvastatina (n = 435). El escalonamiento de las dosis a 40 y 80 mg diarios tuvo lugar con intervalos de 6 semanas para ambas drogas, con una duración total del tratamiento de 18 semanas. La rosuvastatina, en comparación con la atorvastatina, se asoció a las 18 semanas con descensos significativamente mayores de los niveles del LDLc (-58 vs. 42%), colesterol total (-46 vs. -42%), Apo B (-50 vs. -44%) y con incrementos del HDLc (+12 vs. +3%) y apo A-I (+6 vs. -2%)(p < 0.001 para todas). El descenso del nivel de triglicéridos fue similar entre los grupos (28% con rosuvastatina y 32% con atorvastatina). Con la rosuvastatina, más pacientes alcanzaron las metas para el LDLc del NCEP ATP III que con la atorvastatina (61 vs. 46%). Entre los pacientes con enfermedad arterial coronaria (meta LDLc < 100 mg/dl), 17%, 24% y 5% de los pacientes medicados con rosuvastatina 40 y 80 mg y atorvastatina 80 mg, obtuvieron, respectivamente, dichos objetivos. Los niveles de la proteína C-reactiva de alta sensibilidad se redujeron 33%-34% con 80 mg de rosuvastatina y atorvastatina.
Síndrome metabólico
En el ensayo clínico Comparative Study with Rosuvastatin in Subjects with Metabolic Syndrome (COMETS) se comparó la rosuvastatina con la atorvastatina en 397 pacientes con síndrome metabólico y elevación de los valores de LDLc.45 En este estudio de 12 semanas de duración, aleatorizado, de grupos paralelos, con doble enmascaramiento y doble simulación, los pacientes fueron asignados a recibir 10 mg diarios de rosuvastatina, atorvastatina o placebo durante 6 semanas seguido por un período adicional de igual duración con 20 mg/día de rosuvastatina (para aquellos pacientes aleatorizados inicialmente con esta droga o placebo) o atorvastatina 20 mg/día (para los inicialmente asignados a este fármaco). Luego de 6 semanas, el LDLc se redujo 43% con la rosuvastatina, comparado al 37% obtenido con la atorvastatina (p < 0.001). Asimismo, con estas dos drogas se observaron incrementos de los niveles del HDLc de 9% y 5%, respectivamente (p < 0.01). La proporción de pacientes que alcanzaron los objetivos del NCEP ATP III para el LDLc al final de las 12 semanas fue del 91% para los medicados con rosuvastatina y del 79% para los que recibieron atorvastatina (p < 0.001). Los eventos adversos fueron similares entre los dos grupos.
Seguridad
Generalmente se acepta que las estatinas son fármacos razonablemente seguros. El efecto adverso más preocupante relacionado con este tipo de drogas es la rabdomiólisis. La cerivastatina fue retirada del mercado estadounidense en agosto de 2001 debido a su asociación con una incidencia relativamente elevada de rabdomiólisis. Si bien la cerivastatina fue considerablemente menos utilizada que otras estatinas, entre 1997 y 2000 hubo 387 casos de rabdomiólisis asociados con este agente, lo cual representa el 50% de todos los casos informados en el mismo período.18 En comparación, la pravastatina contribuyó con un 9% y la atorvastatina con el 11% de los casos totales relativos a esta patología en dicho período.18 Es posible que la liposolubilidad relativamente elevada y la biodisponibilidad (lo que refleja mayor exposición extrahepática) de la cerivastatina hayan contribuido al riesgo incrementado de toxicidad muscular.18 En virtud de que la rosuvastatina es comparativamente hidrosoluble y tiene baja biodisponibilidad podría tener una menor tendencia a provocar rabdomiólisis,18 aunque este efecto adverso puede presentarse. Para analizar estas especulaciones se necesitan estudios futuros que analicen la seguridad muscular de las estatinas con niveles diferentes de liposolubilidad y biodisponibilidad.
La toxicidad muscular y la rabdomiólisis pueden presentarse tanto con la rosuvastatina como con otras estatinas. En los ensayos clínicos realizados con rosuvastatina46 se observó que la elevación de los niveles de creatina quinasa 10 veces por encima de su límite superior normal ocurría en el < 0.2% de los pacientes que recibieron 5-40 mg diarios de este fármaco, 10-80 mg/día de simvastatina y 10-40 mg/día de pravastatina. La incidencia relativa de la rabdomiólisis observada con la rosuvastatina, comparada a la de otras estatinas, es un tema que ha originado mucho debate. Los estudios previos a la aprobación del fármaco demostraron un riesgo aumentado de esta patología (y de proteinuria) cuando la rosuvastatina se había utilizado en dosis de 80 mg, lo que motivó la interrupción del estudio de este refuerzo de dosis.47 Por otra parte, una organización de defensa al consumidor estadounidense (Public Citizen) alertó a la opinión pública respecto de los muchos casos de rabdomiólisis asociados al uso de rosuvastatina y ha ido tan lejos como para etiquetar esta droga como una de las “peores pastillas” que existen actualmente.48,49 Sin embargo, hasta el momento, no se demostró categóricamente que la rabdomiólisis se presente con mayor frecuencia con la rosuvastatina en comparación con las otras estatinas.47,50 Los pocos casos observados con este fármaco en los estudios previos a su aprobación no estuvieron precedidos por la elevación de los niveles de creatina quinasa (CK), lo que indicó que la determinación rutinaria de esta enzima no es útil para identificar aquellos pacientes expuestos al riesgo de rabdomiólisis.47 No obstante, existen ciertas condiciones que requieren una evaluación individual en relación con el riesgo de presentar miopatías o rabdomiólisis, como alteraciones renales, edad avanzada, hipotiroidismo y utilización de otros fármacos (véase el apartado Interacciones medicamentosas).33 En estos casos deben evaluarse cuidadosamente los riesgos y beneficios de la utilización de rosuvastatina.
La hematuria y la proteinuria también se asociaron al uso de la rosuvastatina, especialmente con la dosis de 80 mg. Los estudios clínicos mostraron que con dosis de 5-20 mg/día, la incidencia de proteinuria es inferior al 1%, la cual fue comparable al placebo, 10-80 mg/día de atorvastatina, 10, 40 y 80 mg/día de simvastatina y 10-40 mg/día de pravastatina.46 La incidencia observada con la dosis de 40 mg/día fue de 1.2%, similar a la simvastatina 20 mg/día (1.1%). Para comparar, el 6.1% de los pacientes que recibieron 80 mg diarios de rosuvastatina en los estudios previos a la aprobación mostraron proteinuria > 2+ y hematuria > 1+.47 La proteinuria parece deberse a la disminución de la reabsorción de las proteínas filtradas normalmente en oposición a la pérdida proteica glomerular. En muchos casos es de carácter transitorio, reversible y no se la asoció con alteraciones renales en el largo plazo. Además, ninguna dosis de rosuvastatina mostró disminuir la tasa de filtración glomerular en tratamientos prolongados (> 96 semanas).
La rosuvastatina –como cualquier estatina– también puede aumentar las transaminasas hepáticas. En los ensayos clínicos, la incidencia de las elevaciones clínicamente significativas de la alanino aminotransferasa fue < 0.5% cuando el fármaco se administró en dosis de 5-40 mg/día, comparable a lo mostrado por simvastatina, atorvastatina y pravastatina para todas las dosis aprobadas.46 Las elevaciones de las tranasminasas hepáticas fueron transitorias y resolvieron sin la suspensión del tratamiento a dosis iguales o menores a las utilizadas.46
Con respecto a otros efectos adversos, la rosuvastatina fue generalmente bien tolerada. En los ensayos clínicos comparativos, este fármaco mostró un perfil de eventos adversos similares a los de atorvastatina, pravastatina y simvastatina.46 En relación con lo mostrado por los análisis de seguridad agrupados, la incidencia de efectos adversos fue similar a la de otras estatinas en 12 400 pacientes tratados con rosuvastatina en diferentes ensayos clínicos.46 Los eventos adversos más frecuentemente comunicados (incidencia > 5%) en los ensayos controlados de fases II y III fueron faringitis (12.2%), dolor (6.7%), cefaleas (6.6%), síndromes similares a la gripe (5.3%) y mialgias (5.1%).18,53
Interacciones medicamentosas
Debido a que la rosuvastatina está sujeta a un metabolismo lento y a que interactúa limitadamente con las isoenzimas del citocromo P450 (CYP), las interacciones farmacológicas metabólicas clínicamente significativas son poco probables.18,29 La eritromicina, el fluconazol y el ketoconazol no tienen efectos clínicos relevantes sobre la farmacocinética de una dosis única de 80 mg de rosuvastatina,53,55 así como esta última no mostró efectos sobre los parámetros cinéticos de la digoxina.56 Se vio que el itraconazol aumenta levemente las concentraciones plasmáticas de la rosuvastatina pero es poco probable que esto tenga significación clínica.57
Voluntarios sanos que recibieron 600 mg de gemfibrozil 2 veces por día presentaron un aumento de 1.9 veces el área bajo la curva concentración plasmática-tiempo luego de la administración de 80 mg de rosuvastatina, lo que motivó que el fabricante recomendara dosis no mayores de 10 mg/día si este fármaco se asocia con gemfibrozil.3,59 Por el contrario, no se observaron interacciones farmacocinéticas significativas cuando se asociaron 10 mg de rosuvastatina con fenofibrato (67 mg 3 veces por día) durante 7 días.59
La glucoproteína-P es una proteína asociada a las membranas celulares y transporta cierta cantidad de sustratos farmacológicos a través de la pared intestinal.18 La inhibición de esta proteína puede alterar la farmacocinética y la farmacodinámica de drogas que son sustratos de este transportador y puede constituir otra fuente de interacciones medicamentosas.18 Si bien la atorvastatina, la lovastatina y la simvastatina son inhibidores potentes de la glucoproteína-P, no se sabe aún si la rosuvastatina es un inhibidor o un sustrato del transportador.18 Sin embargo, en pacientes medicados con ciclosporina sometidos a trasplante cardíaco que recibieron 10 mg de rosuvastatina se observó que la concentración plasmática de ésta última aumentó 11 veces y que el área bajo la curva se multiplicó por 7. Se postula que el causante sería la inhibición de la captación hepática de la estatina debido a la competición por los sitios de unión de la glucoproteína-P.33,60 En virtud de esta interacción, el fabricante recomienda administrar no más de 5 mg de rosuvastatina a los individuos que están medicados con ciclosporina.
La rosuvastatina mostró aumentar significativamente la Razón Normalizada Internacional (RNI > 4, con 2-3 al inicio) en pacientes con tratamiento anticoagulante estabilizado con cumarina. Por este motivo se recomienda controlar estrictamente la RNI cuando se inicia la terapia con rosuvastatina y ajustar las dosis tantas veces como sea necesario hasta lograr estabilizar este parámetro; en este momento, el control de la RNI podría realizarse con la frecuencia previa al inicio del tratamiento con la estatina.33
Los antiácidos que contienen hidróxido de aluminio y magnesio pueden disminuir las concentraciones plasmáticas de la rosuvastatina aproximadamente en un 50% si se los administra dentro de las 2 horas de recibida la estatina.33 Si bien no se conoce la importancia clínica de esta interacción, quizá sea prudente suministrar estas dos drogas por separado con un intervalo de por los menos 2 horas.60 Por último, las concentraciones plasmáticas del etinilestradiol y norgestrel (ambos como anticonceptivos orales) se incrementan, respectivamente, 26% y 34% cuando se asocian a la rosuvastatina.33 Nuevamente, se desconoce por el momento la relevancia clínica de esta interacción.
Conclusiones
La rosuvastatina mostró tener una variedad de ventajas por sobre las demás estatinas. Si bien estas últimas (excepto la pravastina) casi no muestran selectividad por los distintos tipos celulares, la rosuvastatina sí la tiene por los hepatocitos. Este agente es relativamente hidrosoluble y presenta una penetración escasa en los tejidos extrahepáticos. Al contrario de muchas otras estatinas, la rosuvastatina no se metaboliza significativamente en el hígado a través del sistema del citocromo P-450, lo que minimiza la probabilidad de muchas interacciones medicamentosas. Debido a su vida media prolongada, este fármaco puede ser administrado una vez en el día. Asimismo, puede suministrarse en cualquier momento del día, sin precauciones con respecto al horario de las comidas. Este esquema de dosificación es muy conveniente y probablemente contribuya a aumentar la adhesión del paciente al tratamiento.
Con respecto a la disminución del LDLc, la rosuvastatina en dosis de 5-40 mg diarios es más potente que cualquier otra estatina disponible en el mercado. En dosis equivalentes, este fármaco mostró ser más eficaz que la atorvastatina, la simvastatina y la pravastatina para reducir el LDLc, así como permitió que un número mayor de pacientes alcancen las metas fijadas para el LDLc en comparación con aquellos tratados con otras estatinas. Más allá de estos efectos benéficos, la droga es eficaz sobre otros parámetros lipídicos como el HDLc y los triglicéridos. La rosuvastatina demostró ser tan segura como la atorvastatina, la pravastatina y la simvastatina y, si bien existen algunas dudas relacionadas con la miotoxicidad y la nefrotoxicidad, hasta el momento no se demostró que, con dosis de 5-40 mg diarios, estas reacciones adversas se produzcan a una frecuencia mayor que la observada con las otras estatinas.
Los efectos de este fármaco sobre la morbilidad y la mortalidad de los pacientes con enfermedad coronaria se mostrarán cuando se publiquen ensayos clínicos de larga duración como el Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin (JUPITER) llevado a cabo en individuos con valores normales del LDLc y elevados de la proteína C-reactiva.
Los autores manifiestan que “este manuscrito es una revisión de un trabajo previamente publicado en Journal Heart Disease.”
 Bibliografía del artículo
Bibliografía del artículo
- Lipid Research Clinics Program. The lipid research clinics coronary primary prevention trial results. I. Reduction in incidence of coronary heart disease. JAMA 1984; 251:351-64.
- Frick MH, Elo O, Haapa K, et al. Helsinki heart study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med 1987; 317:1237-45.
- The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels (the long-term intervention with pravastatin in ischaemic disease [LIPID] study group). N Engl J Med 1998; 339:1349-57.
- Sacks FM, Pfeffer MA, Moye LA, et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med 1996; 335:1001-9.
- Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian simvastatin survival study (4S). Lancet 1994; 344:1383-9.
- Shepherd J, Cobbe SM, Ford I, et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N Engl J Med 1995; 333:1301-7.
- Downs JR, Clearfield M, Weis S, et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas coronary atherosclerosis prevention study. JAMA 1998; 279:1615-22.
- Schwartz GC, Olsson AG, Ezkowitz MD, et al. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: The MIRACL study. JAMA 2001; 285:1711-8.
- Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals: a randomized placebo-controlled trial. Lancet 2002; 360:7-22.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (adult treatment panel III). JAMA 2001; 285:2486-97.
- Grundy SM, Cleeman JI, Merz CNB, Brewer Jr. HB, Clark LT, Hunninghake DB, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III Guidelines. Circulation 2004; 110:227-239.
- Fonarow, GC, French WJ, Parsons LS, Sun H, Malmgren JA, for the National Registry of Myocardial Infarction 3 Participants. Use of Lipid-Lowering Medications at Discharge in Patients With Acute Myocardial Infarction. Circulation 2001; 103:38-44.
- Majumdar SR, Gurwitz JH, Soumerai SB. Undertreatment of hyperlipidemia in the secondary prevention of coronary artery disease. J Gen Intern Med 1999; 14:711-7.
- Hoerger TJ, Bala MV, Bray JW, Wilcosky TC, LaRosa J. Treatment Patterns and Distribution of Low-Density Lipoprotein Cholesterol Levels in Treatment-Eligible United States Adults. Am J Cardiol 1998; 82:61-65.
- Pearson TA, Laurora I, Chu H, Kafonek S. The Lipid Treatment Assessment Project (L-TAP). Arch Intern Med 2000; 160:459-467.
- Igel M, Sudhop T, von Bergmann K. Pharmacology of 3-Hydroxy-3-Methylglutaryl-Coenzyme A Reductase Inhibitors (Statins), Including Rosuvastatin and Pitavastatin. J Clin Pharmacol 2002; 42:835-845.
- Watanabe M, Koike H, Ishiba T, Okada T, Seo S, Hirai K. Synthesis and biological activity of methanesulfonamide pyrimidine- and N-methanesulfonyl pyrrole-substituted 3,5-dihydroxy-6 heptenoates, a novel series of HMG-CoA reductase inhibitors. Bioorg Med Chem 1997; 5:437-444.
- White CM. A review of the pharmacologic and pharmacokinetic aspects of rosuvastatin. J Clin Pharmacol 2002; 42:963-970.
- Buckett L, Ballard P, Davidson R, Dunkley C, Martin L, Stafford J, et al. Selectivity of ZD4522 for inhibition of cholesterol synthesis in hepatic versus nonhepatic cells (abstract MoP29:W6). XIIth International Symposium on Atherosclerosis. Stockholm, June 25-29, 2000. Atherosclerosis 2000; 151(special issue):41.
- Chapman MJ, McTaggart F. Optimizing the pharmacology of statins: characteristics of rosuvastatin. Atherosclerosis 2002; Suppl. 2:33-37.
- Farnier M, Davignon J. Current and future treatment of hyperlipidemia: the role of statins. Am J Cardiol 1998; 82:3J-10J.
- Stalker TJ, Lefer AM, Scalia R. A new HMG-CoA reductase inhibitor, rosuvastatin, exerts anti-inflammatory effects on the microvascular endothelium: the role of mevalonic acid. Br J Pharmacol 2001; 133:406-12.
- McTaggart F, Buckett L, Davidson R, Holdgate G, McCormick A, Schneck D, et al. Preclinical and clinical pharmacology of Rosuvastatin, a new 3-hydroxy-3methylglutaryl coenzyme A reductase inhibitor. Am J Cardiol 2001; 87(suppl.):28B-32B.
- Chong PH, Yim BT. Rosuvastatin for the treatment of patients with hypercholesterolemia. Ann Pharmacother 2002; 36:93-101.
- Warwick MJ, Dane AL, Raza A, Schneck DW. Single- and multiple-dose pharmacokinetics and safety of the new HMG-CoA reductase inhibitor ZD4522 (abstract MoP19:W6). XIIth International Symposium on Atherosclerosis. Stockholm, June 25-29, 2000. Atherosclerosis 2000; 151 (special issue):39.
- Martin PD, Warwick MJ, Dane AL, Hill SJ, Giles PB, Phillips PJ, Lenz E. Metabolism, excretion, and pharmacokinetics of rosuvastatin in healthy adult male volunteers. Clin Ther 2003; 25:2822-35.
- Martin PD, Mitchell PD, Schneck DW. Pharmacodynamic effects and pharmacokinetics of a new HMG-CoA reductase inhibitor, rosuvastatin, after morning or evening administration in healthy volunteers. Br J Clin Pharmacol 2002; 54:472-7.
- Roach AE, Tsikouris JP, Haase KK. Rosuvastatin: A new HMG-CoA reductase inhibitor for hypercholesterolemia. Formulary 37; 2002:179-185.
- McCormick AD, McKillop D, Butters CJ, Miles GS, Baba T, Touchi A, Yamaguchi Y. ZD4522 An HMG-CoA reductase inhibitor free of metabolically mediated drug interactions: Metabolic studies in human in vitro systems [abstract]. J Clin Pharmacol 2000; 40:1055. Abstract 46.
- Smith G, Davidson R, Bloor S, et al. Pharmacological properties of ZD4522-a new HMG CoA reductase inhibitor [abstract]. Atherosclerosis 2000; 151:39. Abstract MoP20:W6.
- Martin PD, Dane AL, Nwose OM, Schneck DW, Warwick MJ. No effect of age or gender on the pharmacokinetics of rosuvastatin: a new HMG-CoA reductase inhibitor. J Clin Pharmacol 2002; 42:1116-21.
- Simonson SG, Martin PD, Mitchell P, Schneck DW, Lasseter KC, Warwick MJ. Pharmacokinetics and pharmacodynamics of rosuvastatin in subjects with hepatic impairment. Eur J Clin Pharmacol. 2003; 58:669-75.
- Crestor prescribing information. AstraZeneca Pharmaceuticals LP. Wilmington, DE, U.S.A., August 2003.
- Olsson AG, Pears J, McKellar J, Mizan J, Raza A. Effect of rosuvastatin on low-lensity lipoprotein cholesterol in patients with hypercholesterolemia. Am J Cardiol 2001; 88:504-508.
- Paoletti R, Fahmy M, Mahla G, Mizan J, Southworth H. Rosuvastatin demonstrates greater reduction of low-density lipoprotein cholesterol compared with pravastatin and simvastatin in hypercholesterolemic patients: a randomized, double-blind study. J Cardiovasc Risk 2001; 8:383-390.
- Davidson M, Ma P, Stein EA, Gotto AM, Raza A, Chitra R, et al. Comparison of Effects on Low-Density Lipoprotein Cholesterol and High-Density Lipoprotein Cholesterol With Rosuvastatin Versus Atorvastatin in Patients With Type IIa or IIb Hypercholesterolemia. Am J Cardiol 2002; 89:268-275.
- Olsson AG, Istad H, Luurila O, Ose L, Stender S, Tuomilehto J, et al. Effects of rosuvastatin and atorvastatin compared over 52 weeks of treatment in patients with hypercholesterolemia. Am Heart J 2002; 144:1044-51.
- Brown WV, Bays HE, Hassman DR, McKenney J, Chitra R, Hutchinson H, et al. Efficacy and safety of rosuvastatin compared with pravastatin and simvastatin in patients with hypercholesterolemia: a randomized, double-blind, 52-week trial. Am Heart J 2002; 144:1036-43.
- Schneck DW, Knopp RH, Ballantyne CM, McPherson R, Chitra RR, Simonson SG. Comparative effects of rosuvastatin and atorvastatin across their dose ranges in patients with hypercholesterolemia and without active arterial disease. Am J Cardiol 2003; 91:33-41.
- Capuzzi DM, Morgan JM, Weiss RJ, Chitra RR, Hutchinson HG, Cressman MD. Beneficial effects of rosuvastatin alone and in combination with extended-release niacin in patients with a combined hyperlipidemia and low high-density lipoprotein cholesterol levels. Am J Cardiol 2003; 91:1304-10.
- Jones PH, Davidson MH, Stein EA, Bays HE, McKenney JM, Miller E, Cain VA, et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR Trial). Am J Cardiol 2003; 92:152-60.
- Hunninghake DB, Chitra RR, Simonson SG, Schneck DW. Treatment of Hypertriglyceridemic Patients with Rosuvastatin. Diabetes 2001; 50 Suppl.2:A143.
- Hunninghake DB, Stein EA, Bays HE, Rader DJ, Chitra RR, Simonson SG, Schneck DW. Rosuvastatin improves the atherogenic and atheroprotective lipid profiles in patients with hypertriglyceridemia. Coron Artery Dis. 2004; 15:115-23.
- Stein EA, Strutt K, Southworth H, Diggle PJ, Miller E, for the HeFH Study Group. Comparison of rosuvastatin versus atorvastatin in patients with heterozygous familial hypercholesterolemia. Am J Cardiol 2003; 92:1287-93.
- Nainggolan L. COMETS: Rosuvastatin better than atorvastatin in metabolic syndrome (news release). Available at: http://www.theheart.org/viewArticle.doprimaryKey=157625. Accessed December 15, 2004.
- Shepherd J, Hunninghake DB, Stein EA, Kastelein JJP, Harris S, Pears J, Hutchinson HG. Safety of rosuvastatin. Am J Cardiol 2004; 94:882-888.
- United States Food and Drug Administration Center for Drug Evaluation and Research. Approval package for: application number 21-366. Medical review part 1. Available at: http://www.fda.gov/cder/foi/nda/2003/21-366_Crestor_Medr_P1.pdf. Accessed December 15, 2004.
- Anonymous. Public Citizen warns against new statin drug Crestor. Available at: http://www.publiccitizen.org/pressroom/release.cfmID=1543. Accessed December 15, 2004.
- Wolfe S. Dangers of rosuvastatin identified before and after FDA approval [correspondence] 2004; 363:2189-2190.
- Anonymous. Spontaneous adverse event reporting information. Available at: http://www.rosuvastatininformation.com/gUserFiles/adverse_event_03Dec.pdf. Accessed December 15, 2004.
- Vidt DG, Cressman MD, Harris S, Pears JS, Hutchinson HG. Rosuvastatin-induced arrest in progression of renal disease. Cardiology 2004; 102:52-60.
- Shepherd J, Hunninghake D, Harris S, Hutchinson H, Pears J: A review of the safety profile of rosuvastatin in an international phase II/III clinical trial program. Paper presented at the XIV International Symposium on Drugs Affecting Lipid Metabolism, New York, September, 2001.
- Cooper KJ, Martin PD, Dane AL, Warwick MJ, Raza A, Schneck DW. The effect of erythromycin on the pharmacokinetics of rosuvastatin. Eur J Clin Pharmacol 2003; 59:51-56.
- Cooper KJ, Martin PD, Dane AL, Warwick MJ, Schneck DW, Cantarini MV. The effect of fluconazole on the pharmacokinetics of rosuvastatin. Eur J Clin Pharmacol 2002; 58:527-531.
- Cooper KJ, Martin PD, Dane AL, Warwick MJ, Raza A, Schneck DW. Lack of effect of ketoconazole on the pharmacokinetics of rosuvastatin in healthy subjects. Br J Clin Pharmacol 2003; 55:94-99.
- Martin PD, Kemp J, Dane AL, Warwick MJ, Schneck DW. No effect of rosuvastatin on the pharmacokinetics of digoxin in healthy volunteers. J Clin Pharmacol 2002; 42:1352-1357.
- Cooper KJ, Martin PD, Dane AL, Warwick MJ, Schneck DW, Cantarini MV. Effect of itraconazole on the pharmacokinetics of rosuvastatin. Clin Pharmacol Ther 2003; 73:322-329.
- Schneck DW, Birmingham BK, Zalikowski JA, et al. The effect of gemfibrozil on the pharmacokinetics of rosuvastatin. Clin Pharmacol Ther 2004; 75:455-463.
- Martin PD, Dane AL, Schneck DW, Warwick MJ. An open-label, randomized, three-way crossover trial of the effects of coadministration of rosuvastatin and fenofibrate on the pharmacokinetic properties of rosuvastatin and fenofibric acid in healthy male volunteers. Clin Ther 2003; 25:459-471.
- Cheng JWM. Rosuvastatin in the management of hyperlipidemia. Clin Ther 2004; 26:1368-1387.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:
