ANÁLISE DO PAREAMENTO 3’-TERMINAL DURANTE A REAÇÃO DE POLIMERIZAÇÃO EM CADEIA
(especial para SIIC © Derechos reservados)
Coautores
Ângela Maria Spagnol Perrone* Eldamária de Vargas Wolfgramm** Maria do Carmo Pimentel Batitucci*** Flávia de Paula*** Iúri Drumond Louro****
Bióloga, Universidade Federal do Espírito Santo*
Graduanda em Ciências Biológicas, Universidade Federal do Espírito Santo**
Bióloga, PhD, Universidade Federal do Espírito Santo***
Médico, PhD, Universidade Federal do Espírito Santo****
Recepción del artículo: 8 de junio, 2005
Aprobación: 8 de julio, 2005
 Conclusión breve
Nossos estudos tem o objetivo de avaliar como ocorre o pareamento 3' terminal entre o primer de PCR e a seqüência molde, e determinar o efeito da interação entre diversas condições de amplificação com a eficiência e especificidade da reação.
Conclusión breve
Nossos estudos tem o objetivo de avaliar como ocorre o pareamento 3' terminal entre o primer de PCR e a seqüência molde, e determinar o efeito da interação entre diversas condições de amplificação com a eficiência e especificidade da reação.
 Resumen
A técnica de PCR ARMS (amplification refractory mutation system), descrita primeiramente por Newton et al, 1989 permite o diagnostico de qualquer mutação conhecida no DNA genômico de forma simples, rápida, confiável e de baixo custo. O ARMS é uma adaptação da PCR, onde dois primers senso são desenhados com tamanhos diferentes e extremidades 3’ complementares ao alelo normal ou mutado (alelo específicos) e um primer anti-senso complementar a ambos alelos, amplificando assim seqüências de tamanhos distintos. A técnica é baseada no princípio de que a Taq DNA polimerase não apresenta atividade 3’-5’ exonuclease, de modo que o mal pareamento entre a extremidade 3’ do primer e o DNA molde (template) resulta na impossibilidade de amplificação. Nossos estudos tem o objetivo de avaliar como ocorre o pareamento 3' terminal entre o primer de PCR e a seqüência molde, e determinar o efeito da interação entre diversas condições de amplificação com a eficiência e especificidade da reação. A doença utilizada como modelo foi a Fibrose Cística, onde algumas mutações de ponto são responsáveis pela maioria dos casos, nos possibilitando assim desenhar primers para as mutações conhecidas e testar suas condições de amplificação em indivíduos normais e afetados.
Resumen
A técnica de PCR ARMS (amplification refractory mutation system), descrita primeiramente por Newton et al, 1989 permite o diagnostico de qualquer mutação conhecida no DNA genômico de forma simples, rápida, confiável e de baixo custo. O ARMS é uma adaptação da PCR, onde dois primers senso são desenhados com tamanhos diferentes e extremidades 3’ complementares ao alelo normal ou mutado (alelo específicos) e um primer anti-senso complementar a ambos alelos, amplificando assim seqüências de tamanhos distintos. A técnica é baseada no princípio de que a Taq DNA polimerase não apresenta atividade 3’-5’ exonuclease, de modo que o mal pareamento entre a extremidade 3’ do primer e o DNA molde (template) resulta na impossibilidade de amplificação. Nossos estudos tem o objetivo de avaliar como ocorre o pareamento 3' terminal entre o primer de PCR e a seqüência molde, e determinar o efeito da interação entre diversas condições de amplificação com a eficiência e especificidade da reação. A doença utilizada como modelo foi a Fibrose Cística, onde algumas mutações de ponto são responsáveis pela maioria dos casos, nos possibilitando assim desenhar primers para as mutações conhecidas e testar suas condições de amplificação em indivíduos normais e afetados.
 Palabras clave
Multiplex ARMS, primers, pareamento, amplificação, mutações
Clasificación en siicsalud
Palabras clave
Multiplex ARMS, primers, pareamento, amplificação, mutações
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/74485
Especialidades
 Principal: Bioquímica,
Principal: Bioquímica,
 Relacionadas: Diagnóstico por Laboratorio, Genética Humana,
Relacionadas: Diagnóstico por Laboratorio, Genética Humana,
 Enviar correspondencia a:
Enviar correspondencia a:
Iúri Drumond Louro. Departamento de Ciências Biológicas, Centro de Ciências Humanas e Naturais, Universidade Federal do Espírito Santo. Av. Marechal Campos 1468, Campus de Maruípe, CEP 29040-090, Vitória, ES, Brasil. Drumond Louro I
ANALYSIS OF THE 3’-END COMPLEMENTARITY DURING THE POLIMERASE CHAIN REACTION (PCR)
 Abstract
Abstract
PCR ARMS (amplification refractory mutation system) was first described by Newton et al, 1989. Soon after the method became established it was possible to make fast analyses of any known mutation in genomic DNA. The system is simple, quicker and less expensive. Two allele-specific oligonucleotide primers, one specific for the normal allele and one specific for the mutation form, together with another primer complementary to both alleles were used in the polymerase chain reaction. Because Taq DNA polymerase lacks a 3’ exonuclease activity, it is unable to repair a single-base mismatch between the primer and the template at the 3’ end of the DNA primer. We are interested to discover how the annealing between the primer and the template in the 3’ end occurs, and to know more about the effects of the interaction between the conditions of amplification and specificity/efficiency of reaction. We used cystic fibrosis as a model to test the experiments.
 Key words
Key words
Multiplex ARMS, primers, aneealing, amplification, mutation
ANÁLISE DO PAREAMENTO 3’-TERMINAL DURANTE A REAÇÃO DE POLIMERIZAÇÃO EM CADEIA
(especial para SIIC © Derechos reservados)
Artículo completo
Introdução
A determinação da seqüência de nucleotídeos de uma região específica do DNA nos permite diferenciar indivíduos portadores de alterações na seqüência normal (polimorfismos e mutações). O estudo dessas variações é feito através de várias metodologias, entre elas a PCR (polimerase chain reaction),1 que conta com a vantagem de possuir baixo custo e grande rapidez, permitindo o diagnóstico de inúmeras doenças genéticas. Algumas variações da PCR, como a análise de RFLPs (restriction fragment length polymorphism), envolvem múltiplas etapas e limitam-se ao estudo de polimorfismos que criam ou destroem sítios de restrição, fatores esses que elevam o custo e o tempo de execução da técnica.
A técnica de PCR-ARMS (amplification refractory mutation system), também conhecida como AS-PCR (alelle specific PCR) ou PASA (PCR amplification of specific alleles) foi primeiramente descrita por Newton et al, 19892 e permite o diagnóstico de mutações conhecidas no DNA genômico, de forma simples, rápida, confiável e de baixo custo.3 Por esse motivo tem sido adotada no estudo de inúmeros genes, incluindo no diagnóstico pré-natal da Fibrose Cística.4-11
O ARMS é uma adaptação da PCR, onde dois primers senso são desenhados com tamanhos diferentes e extremidades 3’ complementares ao alelo normal ou mutado (alelo específicos) e um primer anti-senso complementar a ambos alelos,11 amplificando assim seqüências de tamanhos distintos e, quando combinados em reações multiplex, permitem a detecção simultânea de várias mutações diferentes.2,5,12 As bandas visualizadas são específicas para o alelo selvagem (normal) ou para a mutação estudada, e a análise simultânea de várias mutações através do PCR multiplex permite a caracterização genotípica do indivíduo quanto a todas as mutações testadas.
A técnica é baseada no princípio de que a Taq DNA polimerase não apresenta atividade 3’-5’ exonuclease, de modo que o mal pareamento entre a extremidade 3’ do primer e o DNA molde (template) resulta na impossibilidade de amplificação.
Nossos estudos tem o objetivo de avaliar como ocorre o pareamento 3’ terminal entre o primer de PCR e a seqüência molde, e determinar o efeito da interação entre diversas condições de amplificação com a eficiência e especificidade da reação. Para tal, utilizamos como modelo a doença Fibrose Cística, onde algumas mutações de ponto são responsáveis pela maioria dos casos, nos possibilitando desenhar primers para mutações conhecidas e testar suas condições de amplificação em indivíduos normais e afetados.
Materiais e métodos
Primers de PCR
Foram desenhados três primers para cada mutação de interesse, um primer senso com extremidade 3’ complementar a seqüência normal (primer normal), um primer senso com 10 bases a mais na extremidade 5’ e a extremidade 3’ complementar a seqüência do alelo mutado (primer mutado) e um primer anti-senso comum para ambos os primers senso descritos acima. O fato dos primers mutados apresentarem em média dez bases a mais que os primers normais, permite a diferenciação do produto amplificado normal ou mutado. Seqüência dos primers descrita na tabela 1.
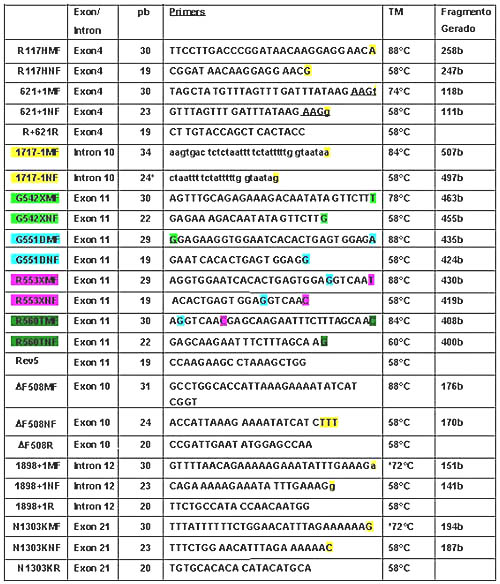
Tabela 1. A tabela mostra a seqüência dos primers que serão utilizados no Multiplex da Fibrose Cística. A primeira coluna indica o nome do primer, a segunda coluna o éxon/íntron ao qual a mutação pertence. A última letra destacada de cada primer representa a substituição da base da seqüência normal, pela mutação, no primer mutado. TM (temperatura de anelamento).
Termocicladores
As reações foram testadas em termocicladores com especificações técnicas diferentes, que apresentavam “ramp times” distintos e necessitavam ou não de adição de óleo mineral na reação de amplificação (PTC100-60 MJ Research e Mastercycler Gradient-Eppendorf) a fim de verificarmos a influência dessas variáveis nas condições de anelamento, amplificação e especificidade das reações (tabela 2). De maneira semelhante, também foram avaliadas condições de ciclagem como tempo, temperaturas de anelamento e extensão, número de ciclos e a concentração de reagentes presentes no tampão.

Tabela 2. Comparação entre as especificações técnicas dos termocicladores PTC100-60 MJ Research e Mastercycler Gradient-Eppendorf.
Reação de amplificação
Os primers normais e mutados foram testados em reações simplex, utilizando DNA de um indivíduo normal (controle negativo) e um portador de Fibrose Cística (controle positivo). As reações apresentaram um volume final de 25 μl (2 μl de cada primer 25 mM; 2.5 μl de tampão 10x; 2.5μl de DMSO 10%; 3.75 μl de dNTPs 10 mM, 0.5 μl de Taq DNA polimerase; 150 ng de DNA genômico e a concentração de magnésio na reação variou entre 0 e 3 μl desse sal a 50 mM). As condições de ciclagem incluíam a desnaturação inicial de 94°C por 10 minutos seguida de 35 ciclos de 94°C por 30 segundos, 55°C por 40 segundos e 72°C por 40 segundos, e uma alongação final a 72°C por 10 minutos. Os produtos de PCR foram analisados em gel de acrilamida 7% (figura 1C). As condições avaliadas foram a concentração de MgCl2 e a composição do tampão de amplificação (tabela 3).

Figura 1. A) Gel de poliacrilamida. Poços: Controle, 1 e 2) 0 μl de MgCl2; 3 e 4) 0.5 μl de MgCl2; 5 e 6) 1.0 μl de MgCl2; 7 e 8) 1.5 μl de MgCl2; 9 e 10) 2.0 μl de MgCl2; 11 e 12) 2.5 μl de MgCl2; 13 e 14) 3.0 μl de MgCl2. Poços ímpares (1, 3, 5, 7, 9, 11, 13) contém DNA do controle normal e os pares (2, 4, 6, 8, 10, 12, 14) contém o DNA de um paciente portador da mutação DF508 (controle positivo). B) Gel de poliacrilamida. Poços: Controle, 1 e 2) 0 μl de MgCl2; 3 e 4) 0.5 μl de MgCl2; 5 e 6) 1.0 μl de MgCl2; 7 e 8) 1.5 μl de MgCl2; 9 e 10) 2.0 μl de MgCl2; 11 e 12) 2.5 μl de MgCl2; 13 e 14) 3.0 μl de MgCl2. Poços ímpares (1, 3, 5, 7, 9, 11, 13) contém DNA do controle normal e os pares (2, 4, 6, 8, 10, 12, 14) contém o DNA de um paciente portador da mutação G542X (controle positivo). C) Gel de poliacrilamida. Poços: ladder, 1e 2) R117H; 3) 621+1; 4) 1717-1; 5) G542X; 6) G551D; 7) R553X; 8) R560T; 9) DF508; 10) 1898+1; 11) N1303K. A figura mostra a amplificação de todos os primers mutados no DNA do indivíduo normal (controle negativo).

Tabela 3. Comparação entre os tampões utilizados nas reações de amplificação.
Resultados
Influência do Ramp Time
A discrepância entre os “ramp times” das duas máquinas e a presença ou ausência de tampa aquecida, foram fatores capazes de regular o pareamento 3’ terminal do primer, permitindo ou impossibilitando a amplificação de seqüências com algum grau de não-complementaridade terminal (figura 1C).
Influência do Mg++
Outro fator de influência no pareamento 3’ terminal foi a concentração de Mg++, e a adição de 2 μl MgCl2 50 mM na reação de PCR possibilitou o anelamento entre seqüências que não eram 100% complementares na extremidade 3’ do primer (figura 1C). No entanto, a adição de 3 μl de MgCl2 50 mM permitiu que o anelamento entre o primer e molde só ocorresse sob 100% de complementaridade (figuras 1 A e B).
Influência do tampão
Os resultados sugerem também que as concentrações e os tipos de reagentes utilizados na formulação do tampão de amplificação apresentaram discreta influência quanto a eficiência e especificidade das reações, sendo o tampão 2 o de melhor desempenho (tabela 3).
Discussão/Conclusão
Dentre as variáveis testadas, as que foram capazes de regular o pareamento 3’ terminal do primer foram as características do termociclador (ramp time e tampa aquecida) e a concentração de Mg++ na reação de PCR. A combinação desses fatores nos permitiu prever a especificidade da reação.
As reações desempenhadas no termociclador PTC100-60 MJ Research, o qual apresenta um maior “ramp time” (1.0°C/s) e a necessidade de adição de óleo mineral, aliado ao uso de 2 μl de MgCl2 permitiram a amplificação dos primers mutados no DNA normal, mesmo havendo o mal pareamento da extremidade 3’ terminal entre os primers e o molde. Entretanto, conseguimos também desempenhar as reações com 100% de especificidade quando utilizamos o termociclador Mastercycler Gradient-Eppendorf, com menor “ramp time” e tampa aquecida, combinado a concentração de 3 μl de MgCl2. Dessa forma, as amplificações ocorriam apenas entre seqüências 100% complementares.
Os resultados indicam a possibilidade de identificação precisa de indivíduos portadores ou afetados de diversas doenças genéticas como câncer, ataxias, hemocromatose hereditária, anemia falciforme, entre outras, causadas por pequenas deleções, inserções ou substituições no DNA.
A capacidade de se regular a especificidade 3’ terminal do primer é interessante pois permite a introdução de mutações controladas no produto amplificado (mutagênese in vitro), gerando controles positivos na ausência de pacientes controles, ou ainda amplificar seqüências genômicas de espécies próximas mas não idênticas, o que é de grande utilidade na genética animal e estudos de conservação.
A manipulação da especificidade da reação pode ser utilizada tanto no sentido de amplificar somente na presença de complementaridade total, ou de permitir pequenos mal-pareamentos, de acordo com as intenções de estudo.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Saik RK, Gelfance D, Stoffel S. Primer detected anzymatic amplification of DNA with a thermostable DNA polymerase. Science 1988; 239:487-491.
- Newton CR, Graham A, Heptinstall LE, Powell SJ, Summers C, Kalsheker, Smith JC, and Markham AF. Analysis of any point mutation in DNA. The amplification refractory mutation system (ARMS). Nucleic Acids Research 1989; 17:2503-2516.
- Wu DY, Ugozzoli L, Pal BK and Wallace RB. Allele-specific enzymatic amplification of Beta-globin genomic DNA for Diagnosis of sicle cell anemia. Proc Natl Acad Scl 1989; 86:2757-2760.
- Baty D, Kwiatkowski AT, Mechan D, Harris A, Pippard MJ, Goudie D. Development of a multiplex ARMS test for mutations in the HFE gene associated whith hereditary haemochromatosis. J Clin Pathol 1998; S1:73-74.
- Newton RC, Summers C, Scwartz M, Graham A, Heptinstall LE, Super M. et al. Amplification refractory mutation system for prenatal diagnosis and carrier assessment in cystic fibrosis. Lancet II 1989; 1481-1483.
- Stoflet ES, Koeberl DD, Sarkar G, Sommer SS. Genomic amplification with transcript sequencing. Science 1988; 29:491-494.
- Bugawan TL, Horn GT, Long CM, Mickelson E, Hansen JA, Ferrara GB, Angelini G, Erlich HA. Analysis of HLA-DP allelic sequence polymorphism using the in-vitro enzymatic DNA amplification of DP-A and DP-B loci. Journal of Immunology 1988; 141:4024-30.
- Chehab FF, Doherty M, Cai S, Kan YW, Cooper S, Rubin EM. Detection of sicklecell anaemia and thalassaemias. Nature 1987; 329:293-294.
- Kogan SC, Doherty M, Gitschier J. An improved method for prenatal ldiagnosis of genetic diseases by analysis of amplified DNA sequences. New England J Med 1987; 317:985-990.
- Levinson B, Janco R, Phillips J, Gitschier J. A novel missense mutation in the factor VIII gene identified by analysis of amplified hemophilia DNA sequences. Nucleic Acids Research 1987; 15:9797-9805.
- Kwok S, Kellog DE, McKinney N, Spasic D, Goda L, Levenson C, et al. Effects of primer-template mismatches on the polymerase chain reaction: human immunodeficiency virus type I model studies. Nucleic Acids Research 1990; 18:999-1005.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:


