PERFILES DE EXPRESION GENICA EN EL TRASPLANTE RENAL
(especial para SIIC © Derechos reservados)
Coautores
Mónica Bescós Zaborras* Josep M. Campistol Plana**
Licenciado en Biología. Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS)*
Doctor en Medicina. Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS)**
Recepción del artículo: 6 de diciembre, 2004
Aprobación: 7 de febrero, 2005
 Conclusión breve
Revisión de las últimas novedades en los perfiles de expresión en el trasplante renal en relación con en su posible vertiente clínica.
Conclusión breve
Revisión de las últimas novedades en los perfiles de expresión en el trasplante renal en relación con en su posible vertiente clínica.
 Resumen
La reciente expansión de las últimas herramientas de la biología molecular en el trasplante renal experimental ha abierto importantes expectativas en el ámbito de su aplicación a la clínica. Se espera un gran rendimiento no sólo en el conocimiento de la fisiopatología del rechazo y la tolerancia, sino en la determinación del mínimo número de genes con valor pronóstico, de progresión y de categorización de los pacientes. La información conjunta derivada de la genómica y la proteómica nos guiará a la identificación y reducción de los factores de riesgo de pérdida del injerto con extensión de la vida de los órganos y mejora en la calidad de vida de los pacientes. En esta revisión se repasan las últimas novedades de los perfiles de expresión en el trasplante renal centrándonos en su posible vertiente clínica. Asimismo, se contemplan las dificultades tanto metodológicas como científicas y de interpretación y validación de los resultados que generan.
Resumen
La reciente expansión de las últimas herramientas de la biología molecular en el trasplante renal experimental ha abierto importantes expectativas en el ámbito de su aplicación a la clínica. Se espera un gran rendimiento no sólo en el conocimiento de la fisiopatología del rechazo y la tolerancia, sino en la determinación del mínimo número de genes con valor pronóstico, de progresión y de categorización de los pacientes. La información conjunta derivada de la genómica y la proteómica nos guiará a la identificación y reducción de los factores de riesgo de pérdida del injerto con extensión de la vida de los órganos y mejora en la calidad de vida de los pacientes. En esta revisión se repasan las últimas novedades de los perfiles de expresión en el trasplante renal centrándonos en su posible vertiente clínica. Asimismo, se contemplan las dificultades tanto metodológicas como científicas y de interpretación y validación de los resultados que generan.
 Palabras clave
Trasplante renal, diagnóstico, pronóstico, microensayos, PCR cuantitativa
Clasificación en siicsalud
Palabras clave
Trasplante renal, diagnóstico, pronóstico, microensayos, PCR cuantitativa
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/71325
Especialidades
 Principal: Genética Humana, Nefrología y Medio Interno, Trasplantes,
Principal: Genética Humana, Nefrología y Medio Interno, Trasplantes,
 Relacionadas: Diagnóstico por Laboratorio, Genética Humana, Medicina Interna, Nefrología y Medio Interno, Trasplantes,
Relacionadas: Diagnóstico por Laboratorio, Genética Humana, Medicina Interna, Nefrología y Medio Interno, Trasplantes,
 Enviar correspondencia a:
Enviar correspondencia a:
Dr. Josep M. Campistol. Servei de Nefrologia y Trasplantament Renal, Institut Clínic de Nefrologia i Urologia (ICNU), Hospital Clínic de Barcelona. Villarroel 170 - 08036 - Barcelona, España. Campistol, Josep M.
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Agradecimientos: Este trabajo ha sido realizado mediante la financiación parcial de las “Redes Temáticas de Investigación Cooperativa: V-2003-REDC03” y por el “Fondo de Investigaciones Sanitarias FIS03/0557”.
GENE EXPRESSION PROFILING IN RENAL TRANSPLANTATION
 Abstract
Abstract
The recent molecular biology expansion in transplant gene expression profiling is a great promise regarding its potential clinical application. Gene expression profiling may provide important clues not only to tolerance and rejection pathophysiology, but also in identifying the minimal set of genes that predict progression, prognosis, and disease categorization. The combined genomic and proteomic approaches will help to identify and reduce risk factors, leading to lower rates of graft loss and improving patient’s quality of life. The aim of this brief review is to outline the role of gene expression profiling in renal transplantation, focusing on its potential clinical use. Scientific, technical, and data interpretation and validation difficulties are also discussed.
 Key words
Key words
Renal transplantation, diagnostic, prognosis, microarrays
PERFILES DE EXPRESION GENICA EN EL TRASPLANTE RENAL
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
El Proyecto Genoma Humano,1,2 encaminado a revolucionar la biomedicina y la sociedad, reveló que nuestro genoma comprende alrededor de 30 000 genes, un número significativamente inferior al esperado. Esta circunstancia subraya la importancia de otros factores para explicar la complejidad del ser humano.3 No únicamente el número de genes, sino la forma en que están distribuidos en el genoma, los polimorfismos, las duplicaciones o la metilación de secuencias reguladoras añaden gran complejidad a la comprensión del genoma (Figura 1). A nivel transcripcional encontramos por otra parte splicing alternativos. En un reciente estudio realizado sobre 10 000 genes se determinó que un 74% presentaban splicing alternativos, distinguiéndose como uno de los eventos más importantes de aportación a la diversidad proteica.4 Así, la complejidad aumenta desde la genómica (análisis del ADN) y la transcriptómica (ARN mensajeros y estructurales) hasta llegar al proteoma (conjunto de proteínas que se expresan en la célula).

Figura 1. Diagrama de representación del aumento de complejidad.
Con el conocimiento de estas disciplinas “-ómicas”, junto con otras como la metabolómica, accederemos a las bases moleculares del rechazo y la tolerancia, al impacto del tratamiento inmunosupresor sobre el órgano, a las susceptibilidades de cada paciente, así como al diseño de tratamientos inmunosupresores personalizados.
Los actuales marcadores fluorogénicos y las técnicas de miniaturización han transformado la biología molecular. Esta innovación llegó también a los laboratorios, tanto de investigación como de diagnóstico de trasplante renal. En esta revisión nos limitaremos a los conceptos de microensayos y PCR en tiempo real en sus vertientes de expresión génica y a los recientes hallazgos que ya nos han aportado.
Microensayos
Un microensayo se define como un sistema miniaturizado de cientos o miles de secuencias de ADN de identidad conocida, dispuestas en un orden lógico en un soporte que puede ser de vidrio, silicio (chip) o membranas de hibridación.5 El objetivo de estos ensayos es determinar diferencias en la expresión de un número variable de genes entre una muestra patológica y una muestra control o de referencia. Los ADN distribuidos sobre el soporte provienen de amplificaciones por reacción en cadena de la polimerasa (PCR) de librerías de ADN complementario (cADN). El proceso es el siguiente (Figura 2): los ARN de la muestra de referencia y patológica son retrotranscritos a cADN y marcados con diferentes fluorocromos, dejándose posteriormente cohibridar sobre el microensayo que contiene los cADN de los genes de interés. A continuación el microensayo es escaneado por un haz de láser para cada longitud de onda de los dos marcadores fluorescentes, separando de esta manera las intensidades de los ARN provenientes de la muestra de referencia de las intensidades de la muestra patológica. Posteriormente, se analizan el ratio de fluorescencia muestra patológica/referencia para cada uno de los puntos del microensayo, asociándose cada una de las intensidades a un gen determinado.5

Figura 2. Esquema representativo de un microensayo de expresión de cDNA.
Estudios con microensayos en el trasplante renal humano
Se han realizado estudios de expresión con microensayos tanto en pacientes con rechazo agudo como crónico.
Afortunadamente, el rechazo agudo dejó de ser una de las causas de pérdida de injertos debido a las terapias inmunosupresoras y al diagnóstico anatomopatológico temprano. No deja de ser, no obstante, uno de los factores de riesgo importantes para la posterior aparición de nefropatía crónica del injerto (NCIR). Una de las primeras publicaciones de microensayos en el trasplante renal con biopsias renales humanas la realizó el grupo de Akalin y col.6 El análisis consistió en comparar el patrón de expresión de tres biopsias con histología normal frente a siete biopsias con rechazo agudo utilizando el sistema GeneChip, de Affymetrix, que contenía 6 800 genes de secuencia completa. Alrededor de 200 transcritos presentaron una regulación al alza durante un episodio de rechazo agudo, la mayoría relacionados con activación del sistema inmune e inflamación. Unicamente 10 eran compartidos por la mayoría de las biopsias, entre ellos la quimiocina MIP-β3, la molécula de adhesión CD18, la C3 del complemento, o factores relacionados con citocinas (fosfoproteína estimulada por interleucina-2, activador transcripcional estimulado por interferón-(INF)-α). También confirmaron la regulación a la baja del factor de crecimiento epidérmico y el cininógeno. Sorprendentemente, de entre estos 10 genes compartidos no encontraron marcadores de activación de células T. Posteriormente, en un estudio en 50 pacientes pediátricos sometidos a trasplante,7,8 realizado con un linfochip de la universidad de Standford conteniendo 12 440 genes, se reveló la heterogeneidad molecular del rechazo agudo. Los autores clasificaron en tres grupos los rechazos agudos en función del patrón molecular observado. La agrupación de los pacientes correlacionó con la recuperación funcional del órgano, siendo peor los del primer grupo, que presentaban perfiles de expresión concordantes con diferenciación y proliferación inmune. Así, en este grupo detectaron mayor actividad de moléculas relacionadas con la infiltración y activación de linfocitos (factor nuclear κB, INF-γ), células T y macrófagos, mientras que en el segundo grupo el patrón de expresión se interpretó como respuesta inmune innata frente a infección (anexinas) o frente a citotoxicidad a anticalcineurínicos como el factor transformante del crecimiento-β (TGF-β). El tercer perfil correspondía a expresión más relacionada con la reparación tisular tras necrosis tubular o inflamación tubulointersticial que no a activación inmune. De hecho, el análisis mostró más similitudes con un grupo con NCIR que con el diagnóstico anatomopatológico de rechazo agudo que presentaban. Los autores sugieren la realización de un estudio prospectivo longitudinal, tanto en trasplante pediátrico como en adultos, para confirmar estos resultados.8 Estos trabajos inician la categorización del rechazo agudo y profundizan en su fisiopatología.
En el desarrollo de NCIR también han aparecido recientemente publicaciones enfocadas a la búsqueda de marcadores diagnósticos y pronósticos. Dos recientes estudios con enfoques diferentes, uno realizado en biopsias humanas y otro sobre tejido renal explantado, han tratado de arrojar luz sobre esta patología responsable de la mayoría de las pérdidas de injertos después del primer año.9 Así, Scherer y col.10 analizaron una cohorte de 17 pacientes con trasplante renal con biopsia de protocolo a los 6 y 12 meses. La finalidad era determinar qué genes expresados en la biopsia a los 6 meses poseían valor pronóstico de NCIR al año. Un total de 65 de los aproximadamente 12 000 genes investigados (plataforma GeneChip de Affymetrix) clasificaban los pacientes correctamente en NCIR. Una posterior selección de 10 genes fue suficiente como para predecir la aparición de NCIR en el 88% de los casos del estudio. Sorprendentemente, la mayoría de estos genes no se habían implicado anteriormente en la NCIR. Asimismo se respalda la idea de que el TGF-β puede jugar un papel importante en las primeras fases postrasplante,11 ya que los pacientes que no desarrollaron NCIR presentaban niveles más elevados de ARN mensajero para TGF-β.
Donauer y col.12 se interesaron en el valor de los perfiles de expresión en órganos explantados por NCIR. Cotejaron la expresión en NCIR con dos grupos de referencia, uno con tejido sano procedente de nefrectomías y un segundo compuesto por riñones poliquísticos recogidos previamente al trasplante. El análisis estadístico señaló expresión diferencial en el 20% de los genes interrogados (unos 2 200 de los 7 000 del chip), pudiéndose distinguir el patrón de expresión normal del trasplantado y éste del patrón de insuficiencia renal terminal. Es interesante remarcar que el análisis de clusters reveló asimismo dos subtipos de expresión en la NCIR que, no obstante, no correlacionaron ni con la histología ni con la clínica, lo que abre una nueva vía de clasificación de estos pacientes.
Reacción en cadena de la polimerasa cuantitativa
La retrotranscripción acoplada a la reacción en cadena de la polimerasa cuantitativa (qRT-PCR) ha permitido determinar los niveles de expresión de numerosos genes relacionados con el rechazo, tanto agudo como crónico, en biopsias renales humanas.
Los métodos de qRT-PCR competitiva,13 aunque muy sensibles y específicos, presentan varios inconvenientes entre los que destacan su dificultad de diseño, que comparativamente emplean una cantidad considerable de cADN y que son al mismo tiempo una técnica laboriosa y compleja de optimizar. Un ejemplo de qRT-PCR competitiva se muestra en la Figura 3.
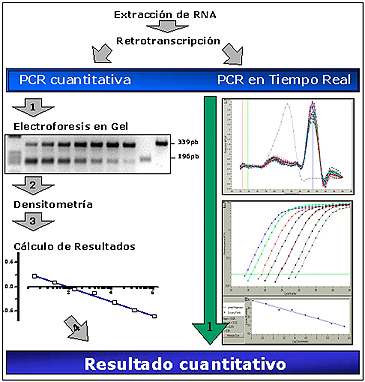
Figura 3. Esquema comparativo de PCR competitiva y PCR en tiempo real cuantitativa.
En los últimos años se ha extendido el uso marcadores fluorescentes que permiten detectar en tiempo real la cantidad de producto de PCR que se está generando en cada ciclo, denominándose a estas nuevas metodologías qRT-PCR en tiempo real o qRT-PCR cinética.14,15 Estas técnicas permiten realizar un seguimiento en tiempo real del proceso de amplificación, con gran sensibilidad y especificidad.
Otra gran ventaja es, además, la enorme reducción en la fase de análisis, ya que el resultado se obtiene al final del proceso sin necesidad de manipulación post-PCR. Asimismo, la cantidad de cADN necesario se reduce y se evita la contaminación, puesto que el proceso de PCR y su análisis se realiza en el mismo tubo. Existen dos modalidades en la detección en tiempo real de los productos de PCR: la primera es el marcador fluorescente SYBGreen (Molecular Probes) que se une específicamente al ADN de doble cadena; la segunda es mediante distintas clases de sondas (sondas FRET, Taqman o faros moleculares, entre otras) que hibridan sobre la cadena de ADN que se está amplificando y emiten, en ese momento, fluorescencia. Terminada la fase de amplificación se calcula el crossing point (Cp) para cada una de las muestras que representa el número de ciclo de PCR en el que se inicia la fase de crecimiento exponencial. Los resultados derivados pueden ser absolutos, si se ha diseñado una curva estándar, o semicuantitativos, si se compara con un gen de expresión constitutiva. En nuestra experiencia, la PCR en tiempo real presenta una reproducibilidad superior a la PCR competitiva,11 seguramente por la reducción en las fases de realización y análisis.
Las células de la orina como espécimen para qRT-PCR
La utilidad de la qRT-PCR en el análisis de expresión en biopsias renales está más que aceptada y numerosas publicaciones la han aplicado en el estudio de la fiosiopatología del trasplante renal, por lo que se halla lejos de esta revisión su análisis exhaustivo. De entre las últimas aportaciones destaca el análisis de expresión en células procedentes de la orina ya que abre una opción diagnóstica de apoyo en el rechazo agudo. Los potenciales riesgos asociados a la obtención percutánea de biopsias renales, así como los potenciales errores de muestreo condujeron recientemente a Baogui y col.16 a desarrollar un método no invasivo de diagnóstico basado en la expresión de granzima B y perforina en células procedentes de orina de pacientes trasplantados. La granzima B y la perforina forman parte de la maquinaria lítica de las células citotóxicas presentes durante el proceso de rechazo agudo. El procedimiento se basa en la sedimentación de las células, posterior extracción del ARN y qRT-PCR. Ambos genes se comportaron como buenos marcadores de rechazo, sin que se detectaran cambios de expresión en pacientes con función normal del injerto ni en pacientes con NCIR. Posteriormente, la quimiocina IP-10 y el receptor CXCR3 fueron ensayados con similares resultados.17
La expresión de éstos y otros marcadores moleculares de rechazo en orina se muestran como un buen procedimiento para reducir el número de biopsias en los pacientes, y detectar, de igual forma, el rechazo subclínico en aquellos casos en los que no se realizan biopsias de protocolo. También puede ser aplicado en un futuro a otras patologías renales, incluida la NCIR.
Inconvenientes de los sistemas de cuantificación de expresión génica
La gran utilidad de los microensayos no está exenta de dudas e incertidumbres,18 la cantidad de información que generan crea problemas de interpretación (tanto estadísticos como conceptuales) y de presentación de los resultados, para los que la bioinformática ya ha dado respuesta (en los ejemplos anteriores se manejaban unos 10 000 resultados por muestra). Asimismo, la necesidad de establecer qué se considera un tejido de referencia se agrava cuando la expresión de miles de genes es comparada con un estado patológico. Los perfiles de expresión vienen influidos al mismo tiempo por el sexo, la edad o la variación genética entre poblaciones. Otra dificultad adicional es la heterogeneidad del tejido a estudiar: una biopsia renal contiene células endoteliales, vasculares, podocitos, epiteliales tubulares de varios subtipos, fibroblastos o células sanguíneas, cada una de las cuales puede estar experimentando proliferación, necrosis, apoptosis, hipertrofia o transdiferenciación, lo que dificulta la comparación entre las muestras. Esto se subsana, en parte, por la posterior confirmación de los resultados con otras metodologías como la hibridación in situ. Asimismo, la microdisección por captura láser permite recolectar miles de células de un determinado subtipo en un corte histológico. Esta posibilidad genera nuevas cuestiones, ya que el limitado número de células obliga a amplificar el ARN.19 En general, si se parte de una biopsia, se hace ineludible el uso de esta metodología por el escaso material que se obtiene.
Otros problemas a los que se enfrentan los ensayos de expresión son la sensibilidad y la especificidad. Un ensayo posee una sensibilidad de alrededor de 10 ARN mensajeros por célula, un valor similar al Northern-blot.20 En cuanto a la especificidad, el principal problema es la cohibridación entre cADN de secuencia homóloga. Esto crea la necesidad de validar los resultados de los ensayos por Northern-blot (cuando la muestra lo permite) o por qRT-PCR. Por último, es de gran importancia la recolección de los especímenes, una biopsia o un órgano explantado que no se congele inmediatamente puede resultar no sólo en la degradación parcial de ciertos ARN mensajeros de corta vida media, sino en la activación de sistemas de respuesta a la tensión de oxígeno, como el factor de transcripción inducible por hipoxia-1.
Aunque se ha establecido que la principal fuente de variabilidad no es la analítica sino la biológica,21,22 se ha iniciado un consorcio con la finalidad de estudiar el posible desarrollo de dos tipos de ARN de referencia que permitan el control de calidad y el intercambio de información entre centros y plataformas.23 La finalidad es determinar la exactitud, el intervalo dinámico de medida, la sensibilidad y la especificidad de los sistemas de expresión, tanto los basados en ensayos como en qRT-PCR, con tal de que no sólo sean una herramienta de investigación sino también elementos de uso clínico. Es de interés también el control de calidad y contaminación en los sistemas de PCR.24
Es de gran importancia además la caracterización funcional de los hallazgos, ya que las variaciones en la expresión del ARN mensajero no tienen por qué reflejarse en cambios en la concentración o actividad de las proteínas, de hecho, se describió una pobre correlación entre los niveles de ARN mensajero y proteínas.25
Sin duda, todos estos inconvenientes se ven superados por las grandes ventajas e información que presentan tanto los ensayos como la qRT-PCR.
Conclusiones
La aplicación de la biología molecular en el campo del trasplante renal y del trasplante de órganos en general, abre importantes opciones con finalidad diagnóstica y pronóstica. En la actualidad, la biología molecular nos permite un diagnóstico más precoz y preciso del rechazo agudo mediante la determinación de la expresión génica en biopsias o en células de la orina. Los microensayos, con el análisis de miles de genes, permitirán un mejor conocimiento del rechazo y la tolerancia. La información conjunta derivada de la genómica y la proteómica nos guiará a la reducción sistemática de los factores de riesgo de pérdida del injerto –rechazo agudo, isquemia-reperfusión, inmunosupresión– con extensión de la vida de los órganos y mejora en la calidad de vida de los pacientes.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
 Bibliografía del artículo
Bibliografía del artículo
- Lander ES, Linton LM, Birren B y col. Initial sequencing and analysis of the human genome. Nature 2001; 409:860-921.
- Venter JC, Adams MD, Myers EW y col. The sequence of the human genome. Science 2001; 291:1304-1351.
- Subramanian G, Adams MD, Venter JC y col. Implications of the human genome for understanding human biology and medicine. JAMA 2001; 286: 2296-2307.
- García Blanco M, Baraniak AP, Lasda EL. Alternative splicing in disease and therapy. Nat Biotech 2004; 5:535-546.
- Arcellana-Panlilio M, Robbins SM. Cutting-edge technology I. Global gene expression profiling using ADN microarrays. Am J Physiol 2002; 282 [Gastrointest Liver Physiol]:G397-402.
- Akalin E, Hendrix RC, Polavarapu RC y col. Gene expression analysis in human renal allograft biopsy samples using high-density oligoarray technology. Transplantation 2001; 72:948-953.
- Sarwal M, Chua MS, Kambham N y col. Molecular heterogeneity in acute renal allograft rejection identified by ADN microarray profiling. N Engl J Med 2003; 349:125-38.
- Mansfield ES, Sarwal M. Arraying the orchestration of allograft pathology. Am J Transplant 2004; 4:853-862.
- Campistol JM, Iñigo P, Lario S y col. Role of transforming growth factor-β1 in the progression of chronic allograft nephropaty. Nephrol Dial Transplant 2001; 16[Suppl 1]:114-116.
- Scherer A, Krause A, Walker JR y col. Early prognosis of the development of renal chronic allograft rejection by gene expression profiling of human protocol biopsies. Transplantation 2003; 75:1323-1330.
- Lario S, Mendes D, Bescós M y col. Expression of transforming growth factor-β1 and hypoxia-inducible factor-1α in an experimental model of kidney transplantation. Transplantation 2003; 75: 1647-1654.
- Donauer J, Rumberger B, Klein M y col. Expression profiling on chronically rejected transplant kidneys. Transplantation 2003; 76:539-547.
- Raeymaekers L. General principles of quantitative PCR. In Quantitative PCR Protocols 1999:31-41. Eds Kochanowski B & Reischl U. Totowa, NJ: Humana Press.
- Bustin SA. Absolute quantification of mARN using real-time reverse transcription polymerase chain reaction assays. J Mol Endocrinol 2000; 25:169-193.
- Giulietti A, Overbergh L, Valckx D y col. An overview of real-time quantitative PCR: Applications to quantify cytokine gene expression. Methods 2001; 25:386-401.
- Baogui L, Hartono C, Ding R y col. Noninvasive diagnosis of renal-allograft rejection by measurement of messenger ARN for perforin and granzyme B in urine. New Engl J Med 2001; 344:947-54.
- Tatapudi RR, Muthukumar T, Dadhania D y col. Noninvasive detection of renal allograft inflammation by measurements of mARN for IP-10 and CXCR3 in urine. Kidney Int 2004; 665:2390-2397.
- King HC, Sinha AA. Gene expression profile analysis by ADN microarrays: promise and pitfalls. JAMA 2001; 286:2280-2288.
- Van Gelder RN, Von Zastrow ME, Yool A y col. Amplified ARN synthesized from limited quantities of heterogeneous cADN. Proc Natl Acad Sci 1990; 87:1663-1667.
- Taniguchi M, Miura K, Iwao H y col. Quantitative assessment of ADN microarrays – comparison with Northern blot analyses. Genomics 2001; 71:34-39.
- Bakay M, Chen YW, Borup R y col. Sources of variability and effect of experimental approach on expression profiling data interpretation. BMC Bioinformatics 2002; 3:4.
- Dumur CI, Nasim S, Best AM y col. Evaluation of quality-control criteria for microarray gene expression analysis. Clin Chem 2004; 50:1994-2002.
- Cronin M, Ghosh K, Sistare F y col. Universal ARN reference materials for gene expression. Clin Chem 2004; 50:1464-1471.
- Burkardt HJ. Standardization and quality control of PCR analyses. Clin Chem Lab Med 2000; 38:87-91.
- Ideker T, Thorsson V, Ranish JA y col. Integrated genomic and proteomic analyses of a systemically perturbed metabolic network. Science 2001; 292:929-934.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento


