Bibliografía del artículo
Bibliografía del artículo
1. Hickie IB, Naismith SL, Robillard R, Scott EM, Hermens DF.Manipulating the sleep-wake cycle and circadian rhythms to improve clinical management of major depression. BMC Medicine 11: 79-106, 2013.
2. Souetre E, Salvati E, Belugou JL, Pringuey D, Candito M, Krebs B, et. al. Circadian rhythms in depression and recovery: evidence for blunted amplitude as the main chronobiological abnormality. Psychiatry Research 28:263-78, 1989.
3. Wirz-Justice A. hronobiology and mood disorders. Dialogues in clinical neuroscience 5: 315-325, 2003.
4. Grandin LD, Alloy LB, Abramson LY. The social zeitgeber theory, circadian rhythms and mood disorders: Review and evaluation. Clinical psychology reviews, 26: 679-694, 2006.
5. Germain A, Kupfer D. Circadian rhythm disturbances in depression. Human Psychopharmacology 23: 571-585, 2008.
6. Norman TR, Dysfunctional circadian rhythms and mood disorders: Opportunities for novel therapeutic approaches, In: JF Cryan and BE Leonard (Eds) Depression: From Psychopathology to Pharmacotherapy, S Krager Basel pp32-52, 2010.
7. Racagni G, Riva M, Popoli M. The interaction between the internal clock and antidepressant efficacy. International Clinical Psychopharmacology (Suppl. 2):S9-S14, 2007.
8. Agez L, Laurent V, Guerrero HY, Pevet P, Masson-Pevet M, Gauer F, Endogenous melatonin provides an effective circadian message to both the suprachiasmatic nuclei and the pars tuberalis of the rat. Journal of Pineal Research 46:95-105, 2009.
9. Jimerson DC, Lynch HJ, Post RM, Wurtman RJ, Bunney WE. Urinary melatonin rhythms during sleep deprivation in depressed patients and normal. Life Sciences 20: 1501-1508, 1977.
10. Tuunainen A, Kripke DF, Elliott JA, Assmusa JD, Rex KM, Klauber MR, et. al. Depression and endogenous melatonin in postmenopausal women.Journal of Affective Disorders 9:149-58, 2002.
11. Crasson M, Kjiri S, Colin A, Kjiri K, Hermite- Baleriaux M, Ansseau M, et. al. Serum melatonin and urinary 6- sulfatoxymelatonin in major depression. Psychoneuroendocrinology 29: 1-12, 2004.
12. Carvalho LA, Gorenstein C, Moreno RA, Markus RP. Melatonin levels in drug-free patients with major depression from the southern hemisphere. Psychoneuroendocrinology 31: 761-768, 2006.
13. Voderholzer U, Laakmann G, Becker U, Haag C, Baghai T, Riemann D, et.al. Circadian profiles of melatonin in melancholic depressed patients and healthy subjects in relation to cortisol secretion and sleep. Psychiatry Research 71: 151-161, 1997.
14. Wetterberg L, Beck-Friis J, Aperia B, Petterson U. Melatonin cortisol ratio in depression. Lancet 2: 1361, 1979.
15. Nair NPV, Hariharasubramanian N, Pilapil C. Cicadian rhythm of plasma melatonin in endogenous depression. Progress in Neuro-Psychopharmacology & Biological Psychiatry 8:715-718, 1984
16. Claustrat B, Chazot G, Brun J, Jordan D, Sassolas G. A chronobiological study of melatonin and cortisol secretion in depressed subjects: plasma melatonin, a biological marker in major depression. Biological Psychiatry 19: 1215-1228, 1984.
17. Brown R, Kocsis JH, Caroff S, Amsterdam J, Winokur A, Stokes PE. Frazer A, Differences in nocturnal melatonin secretion between melancholic depressed patients and control subjects. American Journal of Psychiatry 142:811-816, 1985.
18. McIntyre IM, Judd FK, Norman TR, Burrows GD. Plasma melatonin concentrations in depression. Australian and New Zealand Journal of Psychiatry 20: 381-383, 1986.
19. Frazer, A, Brown, R, Kocsis, J, Caroff, S, Amsterdam, J, Winokur, A, et. al. Patterns of melatonin rhythms in depression. Journal of Neural Transmission 21 (Suppl): 269-290, 1986.
20. Fattah HIA, El-Demerdash OH, Abdel-Sattar NA, Sallam MS, Zakaria MF, El-Ghor MH. Melatonin the hormone of the pineal body: Its role as an endogenous biological marker in major depression and breast cancer. Ain Shams Medical Journal 47:719-731,1996.
21. Fountoulakis KN, Karamouzis M, Iacovides A, Nimatoudis J, Diakogiannis J, Kaprinis J, et. al. Morning and evening plasma melatonin and dexamethasone suppression test in patients with non-seasonal major depressive disorder from northern Greece (Latitude 40-41;5°). Neuropsychobiology 44:113-117, 2001.
22. Meliska CJ, Martínez LF, Lopez AM, Sorenson DL, Nowakowski S, Kripke DF, et.al. Antepartum depression severity is increased during seasonally longer nights: Relationship to melatonin and cortisol timing and quantity. Chronobiology International 30:116-173, 2013.
23. Beck-Friis J, Ljunggren JG, Thorén M, von Rosen D, Kjellman BF, Wetterberg L. Melatonin, cortisol and ACTH in patients with major depressive disorder and healthy humans with special reference to the outcome of the dexamethasone suppression test. Psychoneuroendocrinology 10:173-86, 1985.
24. Mendlewicz J, Branchey L, Weinberg U, Branchey M, Linkowski P, Weitzman ED. The 24-hour pattern of plasma melatonin in depressed patients before and after treatment. Psychopharmacology 4: 49-55, 1980.
25. Rao ML, Muller-Oerlinghausen B, Mackert A, Strebel B, Stieglitz RD, Volz HP, Blood serotonin, serum melatonin and light therapy in healthy subjects and in patients with non-seasonal depression. Acta Psychiatrica Scandinavica 86: 127-132, 1992.
26. Rubin RT, Heist EK, McGeoy SS, Hanada K, Lesser IM, Neuroendocrine Aspects of primary endogenous depression XI. Serum melatonin measures in patients and matched control subjects. Archives of General Psychiatry 49:558-567, 1992.
27. Thompson C, Franey C, Arendt J, Checkley SA, A comparison of melatonin secretion in depressed patients and normal subjects. British Journal of Psychiatry 152: 260-265, 1988.
28. Shafii M, MacMillan DR, Key MP, McCue-Derrick A, Kaufman N, Nahinsky ID. Nocturnal serum melatonin profile in major depression in children and adolescents. Archives of General Psychiatry 53:1009-1013, 1996.
29. Szymanska A, Rabe-Jalonska J, Karasek M, Diurnal profile of melatonin concentrations in patients with major depression: relationship to the clinical manifestation and antidepressant treatment. Neuroendocrinology Letters 22:192-198, 2001.
30. Buckley TM, Schatzberg AF, A pilot study of the phase angle between cortisol and melatonin in major depression - A potential biomarker? Journal of Psychiatric Research 44: 69-74, 2010.
31. Emens J, Lewy A, Kinzie JM, Arntz D, Rough J, Circadian misalignment in major depressive disorder. Psychiatry Research 168: 259-261, 2009.
32. Hasler BP, Buysse DJ, Kupfer DJ, Germain A, Phase relationships between core body temperature, melatonin, and sleep are associated with depression severity: Further evidence for circadian misalignment in non-seasonal depression. Psychiatry Research 178:205-207, 2010.
33. Robillard R, Naismith SL, Rogers NL, Scott EM, Ip TKC, Hermens DF, et. al., Sleep-wake cycle and melatonin rhythms in adolescents and young adults with mood disorders: Comparison of unipolar and bipolar phenotypes. European Psychiatry 28: 412-416, 2013.
34. Kopp C, Vogel E, Rettori MC, Delagrange P, Misslin R, The effects of melatonin on the behavioural disturbances induced by chronic mild stress in C3H/He mice. Behavioural Pharmacology 10, 73-83, 1999.
35. Papp M, Gruca P, Boyer P-A, Mocaer E, Effect of agomelatine in the chronic mild stress model of depression in the rat. Neuropsychopharmacology 28:694-703, 2003.
36. Detanico BC, Piato AL, Freitas JJ, L´hullier FL, Hidalgo MP, Caumo W, Elisabetsky E. Antidepressant-like effects of melatonin in the mouse chronic mild stress model. European Journal of Pharmacology 607:121-125, 2009.
37. Haridas S, Kumar M, Manda K, Melatonin ameliorates chronic mild stress induced behavioural dysfunctions in mice. Physiology and Behaviour 119:201-207, 2013.
38. Prakhie IV, Oxenkrug GF. The effect of nifedipine Ca2 antagonist on activity of MAO inhibitors N-acetyl-serotonin and melatonin in the mouse tail suspension test. International Journal of Neuropsychopharmacology 1:35-45, 1998.
39. Mantovani M, Pértile R, Calixto JB, Santos ARS, Rodrigues ALS. Melatonin exerts an antidepressant-like effect in the tail suspension test in mice: evidence for involvement of N-methyl-D-aspartate receptors and the L-arginine-nitric oxide pathway. Neuroscience Letters 343: 1-34, 2003.
40. Micale V, Arezzi A, Rampello L, Drago F. Melatonin affects the immobility time of rats in the forced swim test: the role of serotonin neurotransmission. European Neuropsychopharmacology 16: 538-545, 2006.
41. Norman, T.R, Cranston, I, Irons, J.A, Gabriel, C, Dekeyne, A, Millan, M.J, et. al. Agomelatine suppresses locomotor hyperactivity in olfactory bulbectomised rats: a comparison to melatonin and to the 5-HT2C antagonist, S32006. European Journal of Pharmacology 674:27-32, 2012.
42. Tardito D, Milanese M, Bonifacino T, Musazzi L, Grilli M, Mallei A, et. al., Blockade of stress-induced increase of glutamate release in the rat prefrontal/frontal cortex by agomelatine involves synergy between melatonergic and 5HT2C receptor-dependent pathways. BMC Neuroscience 11:68-72, 2010.
43. Carman JS, Post RM, Buswell R, Goodwin FK. Negative effects of melatonin on depression. American Journal of Psychiatry 133: 1181-1186, 1976.
44. Lewy AJ, Bauer VK, Cutler NL, Sack RL. Melatonin treatment of winter depression: a pilot study. Psychiatry Research 77:57-61, 1998.
45. Pandya CD, Howell KR, Pillai A. Antioxidants as potential therapeutics for neuropsychiatric disorders. Progress in Neuro-Psychopharmacology & Biological Psychiatry 46:214-223, 2013.
46. Reiter RJ, Tan DX, Manchester LC, El-Sawi MR. Melatonin Reduces Oxidant Damage and Promotes Mitochondrial Respiration: Implications for Aging. Annals of the New York Academy of Sciences 959:238-325, 2002.
47. Dolberg OT, Hirschmann S, Grunhais L. Melatonin for the treatment of sleep disturbances in major depressive disorder. American Journal of Psychiatry 155:1119-1121, 1998.
48. Dalton EJ, Rotondi D, Levitan RD, Kennedy SH, Brown GM. Use of slow release melatonin in treatment resistant depression. Journal of Psychiatry and Neuroscience 25: 48-52, 2000.
49. Serfaty MA, Osborne D, Buszewicz MJ, Blizard R, Raven PW. A randomized double-blind placebo-controlled trial of treatment as usual plus exogenous slow-release melatonin (6 mg) or placebo for sleep disturbance and depressed mood. International Clinical Psychopharmacology 25:132-141, 2010.
50. Redman JR, Guardiola-Lemaître B, Brown M, Delagrange P, Armstrong SM. Dose-dependent effects of S20098, a melatonin agonist on direction of re-entrainment of rat circadian rhythms. Psychopharmacology 118:385-390, 1995.
51. de Bodinat C, Guardiola-Lemaitre B, Mocaër E, Renard P, Muñoz C, Millan MJ. Agomelatine, the first melatonergic antidepressant: discovery, characterization and development. Nature Reviews. Drug Discovery 9:628-642, 2010.
52. Millan MJ, Gobert A, Lejeune F, Dekeyne A, Newman-Tancredi A, Pasteau V, et. al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-Hydroxytryptamine 2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. Journal of Pharmacology and Experimental Therapeutics 306: 954-964, 2003.
53. Chagraoui A, Protais P, Filloux T, Mocaer E. Agomelatine (S20098) antagonises the penile erections induced by the stimulation of 5HT2C receptors in Wistar rats. Psychopharmacology 170:17-22, 2003.
54. Bourin M, Mocaer E, Porsolt R. Antidepressant-like activity of S20098 (agomelatine) in the forced swimming test in rodents: involvement of melatonin and serotonin receptors. Journal of Psychiatry and Neuroscience 29: 126-133, 2004.
55. Bertaina-Anglade V, Drieu C, Boyer PA, Mocaer E. Antidepressant-like effects of agomelatine (S 20098) in the learned helplessness model. Behavioural Pharmacology 17:703-713, 2006.
56. Taylor D, Sparshatt A, Varma S, Olofinjana O. Antidepressant efficacy of agomelatine: meta-analysis of published and unpublished studies. British Medical Journal 348:g1888, 2014.
57. Howland RH. Agomelatine: a novel atypical antidepressant. Journal of Psychosocial Nursing and Mental Health Services 45:13-17, 2007.
58. Kennedy SH. Agomelatine: efficacy at each phase of antidepressant treatment. CNS Drugs 23 (Suppl. 2):41-47, 2009.
59. Kennedy SH, Rivzi SJ. Agomelatine in the treatment of major depressive disorder: potential for clinical effectiveness. CNS Drugs 24: 479-499, 2010.
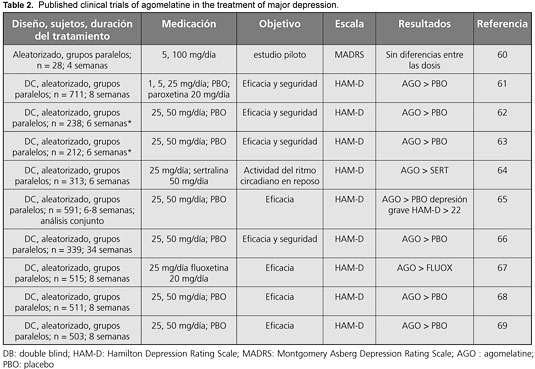
60. Singh SP, Singh V, Kar N. Efficacy of agomelatine in major depressive disorder: meta-analysis and appraisal. International Journal of Neuropsychopharmacology 15:417-428, 2012.
61. Loo H, Dalery J, Macher JP, Payen A. Pilot study comparing in blind the therapeutic effect of two doses of agomelatine, melatonin- agonist and selective 5HT2c receptors antagonist, in the treatment of major depressive disorders. L´Encephale 29: 165-171, 2002.
62. Loo H, Hale A, D´haenen H. Determination of the dose of agomelatine, a melatoninergic agonist and selective 5-HT(2C) antagonist, in the treatment of major depressive disorder: a placebo-controlled dose range study. International Clinical Psychopharmacology 17:239-247, 2002.
62. Olie JP, Kasper S. Efficacy of agomelatine, a MT1/MT2 receptor agonist with 5-HT2C antagonistic properties, in major depressive disorder. International Journal of Neuropsychopharmacology 10:661-673, 2007.
63. Kennedy SH, Emsley R. Placebo-controlled trial of agomelatine in the treatment of major depressive disorder. European Neuropsychopharmacology ; 16:93-100, 2006.
64. Kasper S, Hajak G, Wulff K, Hoogendijk WJG, Montejo AL, Smeraldi E, et. al. Efficacy of the novel antidepressant agomelatine on the circadian rest-activity cycle and depressive and anxiety symptoms in patients with major depressive disorder a randomized, double-blind comparison with sertraline. Journal of Clinical Psychiatry 71:109-120, 2010.
65. Montgomery SA, Kasper S. Severe depression and antidepressants: focus on a pooled analysis of placebo-controlled studies on agomelatine. International Clinical Psychopharmacology 22:283-291, 2007.
66. Goodwin GM, Emsley R, Rembry S, Rouillon F. Agomelatine prevents relapse in patients with major depressive disorder without evidence of a discontinuation syndrome: a 24-week randomized, double-blind, placebo-controlled trial. Journal of Clinical Psychiatry 70:1128-1137, 2009.
67. Hale A, Corral R-M, Mencacci C, Ruiz JS, Severo CA, Gentil V. Superior antidepressant efficacy results of agomelatine vs. fluoxetine in severe MDD patients: a randomized, double-blind study. International Clinical Psychopharmacology 25:305-314, 2010.
68. Zajecka J, Schatzberg A, Stahl S, Shah A, Caputo A, Post A. Efficacy and safety of agomelatine in the treatment of major depressive disorder: a multicenter, randomized, double-blind, placebo-controlled trial. Journal of Clinical Psychopharmacology 30:135-144, 2010.
69. Stahl SM, Fava M, Trivedi MH, Caputo A, Shah A, Post A. Agomelatine in the treatment of major depressive disorder: an 8-week, multicentre, randomised, placebo controlled trial. Journal of Clinical Psychiatry 71:616-626, 2010.
70. Turner EH, Matthews AM, Linardatos E, Tell RA, Rosenthal R. Selective publication of antidepressant trials and its influence on apparent efficacy. N Engl J Med 358:252-260, 2008.
71. Kirsch I, Deacon BJ, Huedo-Medina TB, Scoboria A, Moore TJ, Johnson BT. Initial severity and antidepressant benefits: a meta-analysis of data submitted to the Food and Drug Administration. PLoS Med 5: e45, 2008.
72. Carocci A, Catalano A, Sinicropi MS. Melatonergic drugs in development. Clinical Pharmacology: Advances and Applications 6:127-137, 2014.
73. McGechan A, Wellington K, Ramelteon. CNS Drugs 19: 1057-1065, 2005.
74. Furuya F, Kunishige K, Miyaoka T, Wake R, Liaury K, Sadakuni F, Horiguchi J. Augmentation with ramelteon to achieve remission in geriatric major depression. Psychiatry and Clinical Neurosciences 66: 80-83, 2012.
75. Norris ER, Burke K, Correll JR, Zemanek KJ, Lerman J, Primelo RA, et.al. A double-blind, randomized, placebo-controlled trial of adjunctive ramelteon for the treatment of insomnia and mood stability in patients with euthymic bipolar disorder. Journal of Affective Disorders144:141-147, 2013.
76. Rajaratnam SM, Polymeropoulos MH, Fisher DM, Roth T, Scott C, Birznieks G, et.al. Melatonin agonist tasimelteon (VEC-162) for transient insomnia after sleep-time shift: Two randomised controlled multicentre trials. Lancet 373:482-491, 2009.
77. Laudon M, Nir T, Zisapel N. Development of piromelatine, a novel multimodal sleep medicine. European Neuropsychopharmacology S145, 2014.
78. Tian S-W, Laudon M, Han L, Gao J, Huang F, Yang Y, et.al. Antidepressant- and anxiolytic effects of the novel melatonin agonist Neu-P11 in rodent models. Acta Pharmacologica Sinica 31:775-783, 2010.




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: