Casos Clínicos
TUMOR NEUROECTODERMICO PRIMITIVO ENDOMETRIAL CON METASTASIS BILATERAL EN MAMA
El tumor neuroectodérmico primitivo del útero es una neoplasia extremadamente rara. Suele presentarse como sarcomas puros en mujeres posmenopáusicas como un sangrado vaginal irregular.
Clasificación en siicsalud
Artículos originales > Expertos del Mundo >
página /dato/casiic.php/153009
Especialidades



Artículos originales > Expertos del Mundo >
página /dato/casiic.php/153009
Especialidades



Primera edición en siicsalud
22 de septiembre, 2016
22 de septiembre, 2016
TUMOR NEUROECTODERMICO PRIMITIVO ENDOMETRIAL CON METASTASIS BILATERAL EN MAMA
(especial para SIIC © Derechos reservados)
(especial para SIIC © Derechos reservados)
El sarcoma de Ewing-tumor neuroectodérmico primitivo (PNET, por su sigla en inglés) constituye una familia de neoplasias que se caracterizan por una diferenciación neuroectodérmica. Fue descrito por primera vez en 1918 por Stout, y el término fue acuñado en 1973 por Hart y Earle, y se define como un sarcoma de grado variable y diferenciación neuroectodérmica. Puede ser central y periférico, de acuerdo con la célula de origen y la localización.
El PNET central deriva del tubo neural y engloba sobre todo el cerebro y la médula espinal. El PNET periférico deriva de la cresta neural y tiene lugar fuera del sistema nervioso central, afecta el sistema nervioso simpático, el hueso y los tejidos blandos, y a nivel visceral afecta el pulmón, el riñón y el tracto genital femenino.1
El PNET del útero es extremadamente raro en el aparato genital femenino (sólo se han descrito 44 casos),2 por lo que la información existente es limitada.
Presentamos el caso único de una paciente posmenopáusica con PNET uterino con metástasis bilateral en ambas mamas, pues no hemos encontrado en la literatura anglosajona ningún caso con metástasis bilateral en ambas mamas.
Caso clínico
Mujer de 66 años, cuyos antecedentes familiares oncológicos son madre con cáncer de útero y padre con cáncer de colon, y personales (dos cesáreas y un legrado por aborto, menarca a los 11 años y menopausia a los 52, y apendicectomía), acude a la consulta por sangrado vaginal irregular de tres meses de evolución.
A la exploración se aprecia cérvix permeable, y se palpa un nódulo móvil en mama derecha. Analítica normal. Se realiza una ecografía abdominal en la que aparece un útero de 75.6 x 49 mm con imagen homogénea de 42 mm que ocupa endometrio, que no permite visualización de endometrio ni anejos. En la mamografía se observa un nódulo irregular, mal delimitado en el cuadrante superoexterno de mama derecha, así como otro nódulo en la mama izquierda (Figuras 1 y 2).

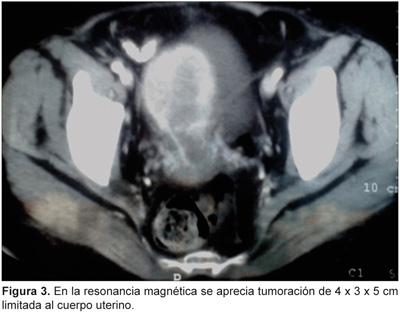
La resonancia magnética abdominal describe un miometrio muy adelgazado con masa uterina de 4 y 5 cm (Figura 3) y un nódulo sólido de 17 mm captador de contraste en la fosa isquiorrectal izquierda, y un gran quiste hepático, sugestivo de quiste simple, confirmado posteriormente con ecografía.
Se realiza legrado con biopsia endometrial y trucut del nódulo en cuadrante superior externo de la mama derecha, con diagnóstico de tumor maligno indiferenciado. Posteriormente se practica una histerectomía más anexectomía bilateral y linfadenectomía pelviana selectiva, así como exéresis bilateral del nódulo en ambas mamas (Figura 4).

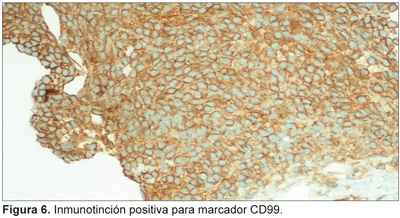
El estudio histológico muestra cuerpo uterino de 7.6 x 5 x 3 cm, con tumoración ulcerada que afecta toda la cavidad endometrial e infiltra masivamente la capa muscular y puntualmente la serosa, con focos de invasión vascular. Microscópicamente, presenta núcleos pequeños, hipercromáticos, citoplasma muy escaso, formando masas, con alto índice mitótico y grandes áreas de necrosis. Inmunohistoquímicamente es negativa para citoqueratina, desmina, actina, antígeno leucocitario común y S-100; positiva para vimentina, CD56, CD99 (Figuras 5 y 6) y FLi-1 positivo dudoso, y focalmente para enolasa y sinaptofisina, siendo identificado como sarcoma de alto grado endometrial tipo PNET. Los nódulos mamarios igualmente son caracterizados como PNET. La paciente se queja de dolor a nivel de cadera e inestabilidad, se le realiza gammagrafía ósea y radiografía simple, que muestran lesiones líticas, compatibles con metástasis a nivel femoral y de la calota craneal.

Con el diagnóstico de PNET estadio IVB se remite al comité oncológico, se decide aplicar 12 ciclos de quimioterapia tipo VAC (vincristina, adriamicina, ciclofosfamida), alternando con VP16 IFo (etopósido e ifosfamida). Actualmente, luego de cinco años, la paciente está asintomática y libre de enfermedad, con esteatosis hepática y, a nivel radiológico, sólo un quiste hepático de 4 mm.
Discusión
El PNET en el tracto genital femenino es extremadamente raro, el ovario suele ser la localización más frecuente, seguido del cuerpo uterino, el cérvix y la vulva como los más infrecuentes.3 A nivel uterino constituyen menos de un 3% de todas las neoplasias, la mayoría son leiomiosarcomas y sarcomas del endometrio y tienen predilección por el cuerpo uterino.4 Se caracterizan en el 85% d ellos casos por la translocación en los genes EWS (t (11; 22) (q24; q12) y FLi-1.1 Suelen ser PNET puros o asociados con otros subtipos histológicos (el 28% se asocia con neoplasias mullerianas, sobre todo al carcinoma endometrial).5
Se presentan preferentemente en mujeres posmenopáusicas mayores de 50 años (75%), aunque también en adolescentes, con un rango de edad entre 12 y 81 años), y el sangrado vaginal irregular es el síntoma de presentación más frecuente, aunque en ocasiones se palpa una masa pelviana.6
Típicamente, muestran células redondas llamativamente uniformes e hipercromáticas que se agrupan formando un patrón lobular. Cada célula tiene un núcleo redondo u ovalado con cromatina fina y uno o dos nucléolos pequeños. El citoplasma es escaso, pálido y mal definido, con un número de mitosis variable. Aunque está muy vascularizado, las células están densamente agrupadas comprimiendo los vasos, y sólo se distinguen áreas de necrosis. Pueden encontrarse PNET atípicos: de células grandes o de células fusiformes; a veces forman rosetas, la mayoría son similares a las de los neuroblastomas.7
El diagnóstico se basa en microscopia óptica e inmunohistoquímica, que evidencia de diferenciación neuroectodérmica, y los marcadores neuroectodérmicos más importantes son CD99 y FLi-1, aunque también expresan positividad para vimentina, y muy focalmente a NSE, cromogranina, sinaptofisina y S-100.8
El diagnóstico diferencial incluye tumores que contienen elementos neuroectodérmicos del tipo central, como tejido glial maduro en endocérvix/endometrio, teratoma inmaduro con tejido glial, gliomas uterinos múltiples, tumores uterinos con una pequeña población de células malignas (carcinoma indiferenciado, carcinoma de células pequeñas, sarcoma estromal y linfoma), rabdomiosarcoma alveolar y metástasis del carcinoma del Merckel.
Tienen un curso clínico potencialmente agresivo se detecta en estadios avanzados, salvo el PNET endometrial, que típicamente suele diagnosticarse en forma temprana, y por lo tanto con un mejor pronóstico. Su pronóstico se correlaciona con su estadificacion (FIGO) en el momento del diagnóstico.3
No existe uniformidad en el tratamiento, y se requiere que éste sea temprano y multimodal, incluye cirugía, quimioterapia (vincristina, ciclofosfamida, cisplatino, doxorrubicina, actinomicina D, carboplatino y VP-16) o radioterapia o ambas.9 Aunque el mesilato de imatinib ha resultado ser un éxito terapéutico en los tumores del estroma gastrointestinal, en el caso de los PNET se desconoce su potencial terapéutico, posiblemente porque el 24% de los PNET expresan positividad variable al CD117.10
Conclusión
El PNET uterino debe estar presente en el diagnóstico diferencial de tumores uterinos de células pequeñas para realizar un diagnóstico precoz, evitando así su comportamiento agresivo; es fundamental la positividad de los marcadores CD99 y FLi-1. Además, debe descartarse una metástasis en otro órgano y a nivel mamario (como nuestro caso), mediante su exploración y la realización de una mamografía/ecografía.
El PNET central deriva del tubo neural y engloba sobre todo el cerebro y la médula espinal. El PNET periférico deriva de la cresta neural y tiene lugar fuera del sistema nervioso central, afecta el sistema nervioso simpático, el hueso y los tejidos blandos, y a nivel visceral afecta el pulmón, el riñón y el tracto genital femenino.1
El PNET del útero es extremadamente raro en el aparato genital femenino (sólo se han descrito 44 casos),2 por lo que la información existente es limitada.
Presentamos el caso único de una paciente posmenopáusica con PNET uterino con metástasis bilateral en ambas mamas, pues no hemos encontrado en la literatura anglosajona ningún caso con metástasis bilateral en ambas mamas.
Caso clínico
Mujer de 66 años, cuyos antecedentes familiares oncológicos son madre con cáncer de útero y padre con cáncer de colon, y personales (dos cesáreas y un legrado por aborto, menarca a los 11 años y menopausia a los 52, y apendicectomía), acude a la consulta por sangrado vaginal irregular de tres meses de evolución.
A la exploración se aprecia cérvix permeable, y se palpa un nódulo móvil en mama derecha. Analítica normal. Se realiza una ecografía abdominal en la que aparece un útero de 75.6 x 49 mm con imagen homogénea de 42 mm que ocupa endometrio, que no permite visualización de endometrio ni anejos. En la mamografía se observa un nódulo irregular, mal delimitado en el cuadrante superoexterno de mama derecha, así como otro nódulo en la mama izquierda (Figuras 1 y 2).

La resonancia magnética abdominal describe un miometrio muy adelgazado con masa uterina de 4 y 5 cm (Figura 3) y un nódulo sólido de 17 mm captador de contraste en la fosa isquiorrectal izquierda, y un gran quiste hepático, sugestivo de quiste simple, confirmado posteriormente con ecografía.

Se realiza legrado con biopsia endometrial y trucut del nódulo en cuadrante superior externo de la mama derecha, con diagnóstico de tumor maligno indiferenciado. Posteriormente se practica una histerectomía más anexectomía bilateral y linfadenectomía pelviana selectiva, así como exéresis bilateral del nódulo en ambas mamas (Figura 4).

El estudio histológico muestra cuerpo uterino de 7.6 x 5 x 3 cm, con tumoración ulcerada que afecta toda la cavidad endometrial e infiltra masivamente la capa muscular y puntualmente la serosa, con focos de invasión vascular. Microscópicamente, presenta núcleos pequeños, hipercromáticos, citoplasma muy escaso, formando masas, con alto índice mitótico y grandes áreas de necrosis. Inmunohistoquímicamente es negativa para citoqueratina, desmina, actina, antígeno leucocitario común y S-100; positiva para vimentina, CD56, CD99 (Figuras 5 y 6) y FLi-1 positivo dudoso, y focalmente para enolasa y sinaptofisina, siendo identificado como sarcoma de alto grado endometrial tipo PNET. Los nódulos mamarios igualmente son caracterizados como PNET. La paciente se queja de dolor a nivel de cadera e inestabilidad, se le realiza gammagrafía ósea y radiografía simple, que muestran lesiones líticas, compatibles con metástasis a nivel femoral y de la calota craneal.


Con el diagnóstico de PNET estadio IVB se remite al comité oncológico, se decide aplicar 12 ciclos de quimioterapia tipo VAC (vincristina, adriamicina, ciclofosfamida), alternando con VP16 IFo (etopósido e ifosfamida). Actualmente, luego de cinco años, la paciente está asintomática y libre de enfermedad, con esteatosis hepática y, a nivel radiológico, sólo un quiste hepático de 4 mm.
Discusión
El PNET en el tracto genital femenino es extremadamente raro, el ovario suele ser la localización más frecuente, seguido del cuerpo uterino, el cérvix y la vulva como los más infrecuentes.3 A nivel uterino constituyen menos de un 3% de todas las neoplasias, la mayoría son leiomiosarcomas y sarcomas del endometrio y tienen predilección por el cuerpo uterino.4 Se caracterizan en el 85% d ellos casos por la translocación en los genes EWS (t (11; 22) (q24; q12) y FLi-1.1 Suelen ser PNET puros o asociados con otros subtipos histológicos (el 28% se asocia con neoplasias mullerianas, sobre todo al carcinoma endometrial).5
Se presentan preferentemente en mujeres posmenopáusicas mayores de 50 años (75%), aunque también en adolescentes, con un rango de edad entre 12 y 81 años), y el sangrado vaginal irregular es el síntoma de presentación más frecuente, aunque en ocasiones se palpa una masa pelviana.6
Típicamente, muestran células redondas llamativamente uniformes e hipercromáticas que se agrupan formando un patrón lobular. Cada célula tiene un núcleo redondo u ovalado con cromatina fina y uno o dos nucléolos pequeños. El citoplasma es escaso, pálido y mal definido, con un número de mitosis variable. Aunque está muy vascularizado, las células están densamente agrupadas comprimiendo los vasos, y sólo se distinguen áreas de necrosis. Pueden encontrarse PNET atípicos: de células grandes o de células fusiformes; a veces forman rosetas, la mayoría son similares a las de los neuroblastomas.7
El diagnóstico se basa en microscopia óptica e inmunohistoquímica, que evidencia de diferenciación neuroectodérmica, y los marcadores neuroectodérmicos más importantes son CD99 y FLi-1, aunque también expresan positividad para vimentina, y muy focalmente a NSE, cromogranina, sinaptofisina y S-100.8
El diagnóstico diferencial incluye tumores que contienen elementos neuroectodérmicos del tipo central, como tejido glial maduro en endocérvix/endometrio, teratoma inmaduro con tejido glial, gliomas uterinos múltiples, tumores uterinos con una pequeña población de células malignas (carcinoma indiferenciado, carcinoma de células pequeñas, sarcoma estromal y linfoma), rabdomiosarcoma alveolar y metástasis del carcinoma del Merckel.
Tienen un curso clínico potencialmente agresivo se detecta en estadios avanzados, salvo el PNET endometrial, que típicamente suele diagnosticarse en forma temprana, y por lo tanto con un mejor pronóstico. Su pronóstico se correlaciona con su estadificacion (FIGO) en el momento del diagnóstico.3
No existe uniformidad en el tratamiento, y se requiere que éste sea temprano y multimodal, incluye cirugía, quimioterapia (vincristina, ciclofosfamida, cisplatino, doxorrubicina, actinomicina D, carboplatino y VP-16) o radioterapia o ambas.9 Aunque el mesilato de imatinib ha resultado ser un éxito terapéutico en los tumores del estroma gastrointestinal, en el caso de los PNET se desconoce su potencial terapéutico, posiblemente porque el 24% de los PNET expresan positividad variable al CD117.10
Conclusión
El PNET uterino debe estar presente en el diagnóstico diferencial de tumores uterinos de células pequeñas para realizar un diagnóstico precoz, evitando así su comportamiento agresivo; es fundamental la positividad de los marcadores CD99 y FLi-1. Además, debe descartarse una metástasis en otro órgano y a nivel mamario (como nuestro caso), mediante su exploración y la realización de una mamografía/ecografía.
Rosario Guerrero Cauqui, Anatomía Patológica Hospital de Algeciras, Algeciras, España
1. Daya D, Lukka H, Clement P. Primitive neuroectodermal tumors of the uterus: A report of four cases. Hum Pathol 23(10):1120-9, 1992.
2. Ren YL, Tang XY, LiT. Ewing sarcoma-primitive neuroectodermal tumor of the uterus: a clinicopathologic, immunohistochemical and ultrastructural study of one case. Arch Gynecol Obstet 283(5):1139-43, 2011.
3. Park JY, Lee S, Kang HJ, Kim HS, Park SY. Primary Ewing´s sarcoma- primitive neuroectodermal tumor of the uterus: A case report and literature review. Gynecologic Oncology 106(2):427-32, 2007.
4. Fadare O. Heterologous and rare homologous sarcomas of the uterine corpus: a clinicopathologic review. Adv Anat Pathol 18(1):60-74, 2011. doi: 10.1097/PAP.0b013e3182026be7.
5. Bhardwaj M, Batrani M, Chawla I, Malik R. Uterine primitive neuroectodermal tumor with adenosarcoma: a case report. J Med Case Rep 28(4):195 199, 2010.
6. Majeed U, Ilyas MA, Uddin N, Ahmed Q, Mansoor S, Jamshed A, et al. Primary Ewing´s sarcoma- primitive neuroectodermal tumour of uterus. J Obstet Gynaecol 29(1):73-4, 2009.
7. Blattner JM, Gable P, Quigley MM, McHale MT. Primitive neuroectodermal tumor of the uterus. Gynecol Oncol 106(2):419-22, 2007.
8. Euscher ED, Deavers MT, Lopez-Terrada D, Lazar AJ, Silva EG, Malpica A. Uterine tumors with neuroectodermal differentiation: a series of 17 cases and review of the literature. Am J surg Pathol 32(2):219-28, 2008.
9. Tang X, Wang P, He Y, Yang F, Li L, Wang H, et al. Primitive neuroectodermal tumor in female genital tract: a clinicopathologic study. Zhonghua Bing Li Xue Za Zhi 41(11):729-32, 2012.
Folpe AL, Goldblum JR, Rubin BP et al. Morphological and immunophenotypic diversity in Ewing family tumors a study of 66 genetically confirmed cases. Am J Surg Pathol 29:1025, 2005.
Está expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC.
ua91218
































