Casos Clínicos
SINDROME DE HIPERINFESTACION POR STRONGYLOIDES STERCORALIS EN UNA PACIENTE CON LES EN TRATAMIENTO CON ALTAS DOSIS DE CORTICOIDES: PRESENTACION DE UN CASO Y REVISION DE LA LITERATURA
Se describe el caso de una paciente con diagnóstico de lupus eritematoso sistémico que recibía tratamiento con altas dosis de corticoides y que sufrió un cuadro de distrés respiratorio por Strongyloides stercoralis.
Coautores
Marcelo Corti* S Mecca** G Mariño**
Hospital de Enfermedades Infecciosas Francisco J Muñiz, Buenos Aires, Argentina*
Hospital Interzonal General de Agudos "Eva Perón" (Castex), Buenos Aires, Argentina**
Marcelo Corti* S Mecca** G Mariño**
Hospital de Enfermedades Infecciosas Francisco J Muñiz, Buenos Aires, Argentina*
Hospital Interzonal General de Agudos "Eva Perón" (Castex), Buenos Aires, Argentina**
Clasificación en siicsalud
Artículos originales > Expertos del Mundo >
página /dato/casiic.php/112830
Especialidades






Artículos originales > Expertos del Mundo >
página /dato/casiic.php/112830
Especialidades






Primera edición en siicsalud
10 de agosto, 2010
10 de agosto, 2010
Introducción
Strongyloides stercoralis es un nemátodo intestinal endémico de áreas tropicales y subtropicales de Africa, Asia, América central y del Sur. Produce una infección crónica y a menudo asintomática que habitualmente se diagnostica por la detección de larvas rhabditiformes en las heces o por la presencia de eosinofilia en sangre periférica. En pacientes inmunocomprometidos puede evolucionar a formas graves que incluyen el síndrome de hiperinfestación y la enfermedad diseminada.
Caso clínico
Mujer de 50 años, oriunda de Paraguay, con diagnóstico de lupus eritematoso sistémico 8 meses antes, en tratamiento con prednisona en dosis de 60 mg/dia. Siete días antes de su admisión presenta disnea clase funcional (CF) I-II que progresa a CF III-IV en las últimas 24 horas.
En el examen clínico de ingreso se encontraba lúcida, normotensa, taquicárdica, taquipneica y afebril. La semiología respiratoria reveló la existencia de escasos rales velcro bibasales con predominio en el hemitórax derecho. También se comprobó edema en miembros inferiores con predominio del lado izquierdo. El resto del examen clínico no mostró anormalidades.
Los análisis de laboratorio de ingreso mostraron los siguientes resultados: hematocrito 26%, glóbulos blancos 10 000/mm3, plaquetas 217 000/mm3, glucemia 6.5 g/l, creatininemia 0.8 mg%, urea 34 mg%, pH 7.39, bicarbonato 15.5, cuerpos cetónicos negativos.
Con dignóstico presuntivo de tromboembolismo pulmonar se efectuó ecodoppler de miembros inferiores que mostró trombosis de la vena femoral superficial. El ecocardiograma fue normal. Se indicó insulinoterapia y se inició anticoagulación con heparina.
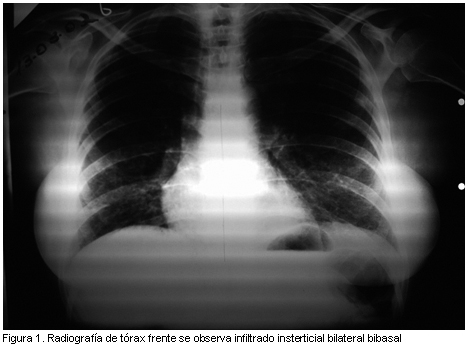
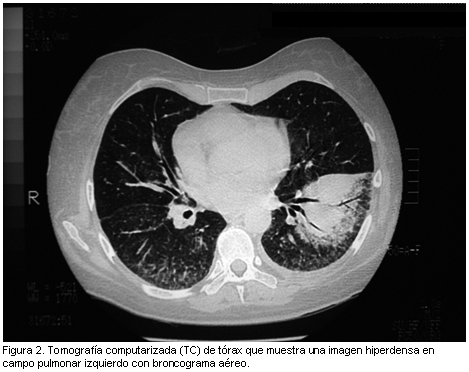
A los siete días presenta registros de fiebre. En la radiografía de tórax se advirtió un infiltrado intersticial en ambas bases (figura 1). Se realizó tomografía computarizada (TC) de tórax que mostró una imagen hiperdensa en campo pulmonar izquierdo con broncograma aéreo (figura 2). Los hemocultivos fueron negativos y la serología para VIH no reactiva. Se comenzó tratamiento empírico con antibióticos: ceftazidima 1 g cada 8 h más amikacina 500 mg/día que luego se reemplazó por imipenem 500 mg cada 6 h, ambos por vía intravenosa.
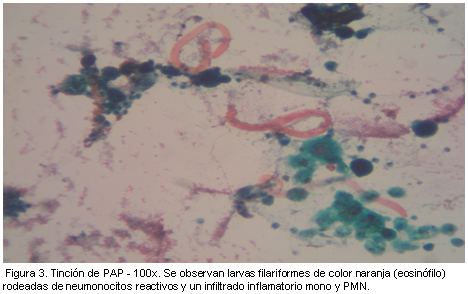
La paciente persistió febril con escasa respuesta al tratamiento. Se decidió efectuar fibrobroncoscopia con lavado broncoalveolar que fue negativo para gérmenes comunes, bacilos ácido-alcohol resistentes y hongos. En el examen citológico con Giemsa se observaron larvas filariformes compatibles con Strongyloides stercoralis (Figuras 3 y 4). Ante este hallazgo, se indicó tratamiento con ivermectina en dosis de 12 mg/dia; 24 h más tarde presentó cuadro de shock séptico y falleció.

Discusión
La estrongiloidosis es una enfermedad parasitaria intestinal causada por el nematodo Strongyloides stercoralis. El macho mide 0.7 mm de longitud por 40 a 50 µm de ancho y es de vida libre. La hembra, que es partenogenética, se aloja en la mucosa del intestino delgado, en especial en el duodeno. Mide 2.2 mm de largo por 40 µm de ancho y sus extremos son afilados. Posee dos úteros que contienen unos diez huevos embrionados que depositados en la mucosa intestinal dejan rápidamente en libertad una larva rhabditoide de 200 µm de largo, la cual llega al exterior con las heces. En el suelo, las larvas evolucionan al estado de parásitos adultos de vida libre, o hacia las formas infestantes para el hombre. Estas penetran por la piel de los pies, ingresan en el torrente circulatorio y por éste arriban al corazón derecho y desde allí al pulmón, donde perforan la pared alveolar y caen en el espacio aéreo; ascienden por los bronquios y la tráquea hasta la faringe donde son deglutidas. De esta manera, llegan al intestino delgado donde dan origen a hembras partenogenéticas que se alojan en la mucosa o submucosa del duodeno pudiendo colonizar toda la extensión del intestino delgado, el colon y la vía biliar y pancreática. Este ciclo dura 28 días.
Se conoce también un ciclo de autoinfestación que dura 14 días; en la luz del intestino o en las márgenes del ano, las larvas rhabditoides pueden evolucionar a la forma infestante, atravesar la mucosa intestinal o la piel perianal y reiniciar así el ciclo de autoinfestación.1
El hospedero provoca una infección generalmente asintomática del tracto gastrointestinal (60% de los casos). En algunos casos se manifiesta como diarrea crónica con anemia y eosinofilia periférica. Debido a la habilidad del parásito de completar su ciclo de vida mediante el proceso de autoinfestación, bajo ciertas condiciones de inmunodepresión esto puede resultar en una diseminación larvaria hacia otros tejidos u órganos.2
Los tratamientos con inmunosupresores, la corticoterapia prolongada –como en la paciente que se presenta–, los linfomas y leucemias, la coinfección por HTLV-1, VIH y otros estados como desnutrición, diabetes mellitus, insuficiencia renal crónica y consumo crónico de alcohol favorecen la diseminación larvaria. En estas condiciones comórbidas, S. stercoralis puede producir: - síndrome de hiperinfestación, caracterizado por la invasión de larvas filariformes en intestino y pulmón con una gran carga larvaria en aquellos sitios por los que habitualmente pasa el nematodo en su ciclo vital; - enfermedad diseminada con diseminación larvaria y compromiso de ganglios, hígado, endocardio, pulmón y sistema nervioso central, es decir localizaciones no contempladas en el ciclo parasitario.3
Los síntomas gastrointestinales son los más comunes y el tracto respiratorio es el aparato afectado con más frecuencia luego del tracto gastrointestinal. La bacteriemia por gramnegativos o polimicrobiana causada por la migración de las larvas a través de la pared intestinal es otra presentación común de la infección diseminada, que favorece la incidencia de sepsis y meningitis por gérmenes gramnegativos, en especial Escherichia coli.4 Los signos y síntomas gastrointestinales más frecuentes son la pérdida de peso progresiva, diarrea crónica, dolor abdominal (duodenitis parasitaria) o vómitos, aunque la presentación clínica gastrointestinal es usualmente inespecífica, abarca un amplio rango de manifestaciones clínicas desde las formas asintomáticas u oligosintomáticas hasta la insuficiencia multiorgánica, que puede tener lugar décadas después de la infección primaria. Con respecto al compromiso respiratorio el paciente puede presentar tos, disnea, sibilancias (síndrome de Löeffler), hemoptisis y distrés respiratorio agudo; además puede haber fiebre asociada o no a los síntomas mencionados anteriormente.
La aparición de síntomas y signos como distrés respiratorio, infiltrados nuevos en la radiografía de tórax o ambos pueden ser manifestaciones de un síndrome de hiperinfestación por Strongyloides stercoralis, como en la paciente que se describe. La eosinofilia puede estar ausente y a veces hay eosinopenia, lo que representa un signo de mal pronóstico ya que se asocia con mayor riesgo de mortalidad.
La sensibilidad del examen de materia fecal es variable y depende del número de muestras analizadas. El estudio de una sola muestra puede perder el 70% o más de los casos debido a una carga parasitaria baja o a una excreción larvaria intermitente. La sensibilidad diagnóstica aumenta al 50% cuando se analizan tres muestras de materia fecal y es mayor del 90% con 7 muestras seriadas. La prueba de ELISA tiene valor secundario debido a que puede permanecer positiva por meses o años y tener reacción cruzada con otras especies de helmintos. El esputo y el lavado broncoalveolar son útiles para la identificación del parásito en las localizaciones pulmonares, como en el presente caso.
El tratamiento de las formas diseminadas de la enfermedad se basa en la combinación de albendazol 400 mg dos veces al día por 7 días e ivermectina 200 µg/kg/d por 1-2 días. El albendazol y la ivermectina deben mantenerse hasta que existan pruebas de la eliminación del parásito.3-6
Reconocer los antecedentes epidemiológicos y factores de riesgo es esencial para establecer el diagnóstico de las formas de hiperinfestación y diseminadas graves de esta geohelmintiasis. Para tal fin, deben efectuarse exámenes parasitológicos seriados y en fresco previos al inicio de tratamientos inmunosupresores, en especial en sujetos procedentes de áreas endémicas.
En el caso que se presenta, la paciente procedente de un área endémica se encontraba inmunodeprimida debido a la corticoterapia prolongada por su enfermedad de base (lupus eritematoso sistémico). A partir de este hecho, al no haberse detectado la infección por S. stercoralis (generalmente asintomática, como ya se dijo líneas arriba), evolucionó a un cuadro de hiperinfestación seguido de sepsis con insuficiencia multiorgánica que la llevó al óbito.
Los autores no manifiestan conflictos de intereses.
Caso clínico
Mujer de 50 años, oriunda de Paraguay, con diagnóstico de lupus eritematoso sistémico 8 meses antes, en tratamiento con prednisona en dosis de 60 mg/dia. Siete días antes de su admisión presenta disnea clase funcional (CF) I-II que progresa a CF III-IV en las últimas 24 horas.
En el examen clínico de ingreso se encontraba lúcida, normotensa, taquicárdica, taquipneica y afebril. La semiología respiratoria reveló la existencia de escasos rales velcro bibasales con predominio en el hemitórax derecho. También se comprobó edema en miembros inferiores con predominio del lado izquierdo. El resto del examen clínico no mostró anormalidades.
Los análisis de laboratorio de ingreso mostraron los siguientes resultados: hematocrito 26%, glóbulos blancos 10 000/mm3, plaquetas 217 000/mm3, glucemia 6.5 g/l, creatininemia 0.8 mg%, urea 34 mg%, pH 7.39, bicarbonato 15.5, cuerpos cetónicos negativos.
Con dignóstico presuntivo de tromboembolismo pulmonar se efectuó ecodoppler de miembros inferiores que mostró trombosis de la vena femoral superficial. El ecocardiograma fue normal. Se indicó insulinoterapia y se inició anticoagulación con heparina.
A los siete días presenta registros de fiebre. En la radiografía de tórax se advirtió un infiltrado intersticial en ambas bases (figura 1). Se realizó tomografía computarizada (TC) de tórax que mostró una imagen hiperdensa en campo pulmonar izquierdo con broncograma aéreo (figura 2). Los hemocultivos fueron negativos y la serología para VIH no reactiva. Se comenzó tratamiento empírico con antibióticos: ceftazidima 1 g cada 8 h más amikacina 500 mg/día que luego se reemplazó por imipenem 500 mg cada 6 h, ambos por vía intravenosa.


La paciente persistió febril con escasa respuesta al tratamiento. Se decidió efectuar fibrobroncoscopia con lavado broncoalveolar que fue negativo para gérmenes comunes, bacilos ácido-alcohol resistentes y hongos. En el examen citológico con Giemsa se observaron larvas filariformes compatibles con Strongyloides stercoralis (Figuras 3 y 4). Ante este hallazgo, se indicó tratamiento con ivermectina en dosis de 12 mg/dia; 24 h más tarde presentó cuadro de shock séptico y falleció.


Discusión
La estrongiloidosis es una enfermedad parasitaria intestinal causada por el nematodo Strongyloides stercoralis. El macho mide 0.7 mm de longitud por 40 a 50 µm de ancho y es de vida libre. La hembra, que es partenogenética, se aloja en la mucosa del intestino delgado, en especial en el duodeno. Mide 2.2 mm de largo por 40 µm de ancho y sus extremos son afilados. Posee dos úteros que contienen unos diez huevos embrionados que depositados en la mucosa intestinal dejan rápidamente en libertad una larva rhabditoide de 200 µm de largo, la cual llega al exterior con las heces. En el suelo, las larvas evolucionan al estado de parásitos adultos de vida libre, o hacia las formas infestantes para el hombre. Estas penetran por la piel de los pies, ingresan en el torrente circulatorio y por éste arriban al corazón derecho y desde allí al pulmón, donde perforan la pared alveolar y caen en el espacio aéreo; ascienden por los bronquios y la tráquea hasta la faringe donde son deglutidas. De esta manera, llegan al intestino delgado donde dan origen a hembras partenogenéticas que se alojan en la mucosa o submucosa del duodeno pudiendo colonizar toda la extensión del intestino delgado, el colon y la vía biliar y pancreática. Este ciclo dura 28 días.
Se conoce también un ciclo de autoinfestación que dura 14 días; en la luz del intestino o en las márgenes del ano, las larvas rhabditoides pueden evolucionar a la forma infestante, atravesar la mucosa intestinal o la piel perianal y reiniciar así el ciclo de autoinfestación.1
El hospedero provoca una infección generalmente asintomática del tracto gastrointestinal (60% de los casos). En algunos casos se manifiesta como diarrea crónica con anemia y eosinofilia periférica. Debido a la habilidad del parásito de completar su ciclo de vida mediante el proceso de autoinfestación, bajo ciertas condiciones de inmunodepresión esto puede resultar en una diseminación larvaria hacia otros tejidos u órganos.2
Los tratamientos con inmunosupresores, la corticoterapia prolongada –como en la paciente que se presenta–, los linfomas y leucemias, la coinfección por HTLV-1, VIH y otros estados como desnutrición, diabetes mellitus, insuficiencia renal crónica y consumo crónico de alcohol favorecen la diseminación larvaria. En estas condiciones comórbidas, S. stercoralis puede producir: - síndrome de hiperinfestación, caracterizado por la invasión de larvas filariformes en intestino y pulmón con una gran carga larvaria en aquellos sitios por los que habitualmente pasa el nematodo en su ciclo vital; - enfermedad diseminada con diseminación larvaria y compromiso de ganglios, hígado, endocardio, pulmón y sistema nervioso central, es decir localizaciones no contempladas en el ciclo parasitario.3
Los síntomas gastrointestinales son los más comunes y el tracto respiratorio es el aparato afectado con más frecuencia luego del tracto gastrointestinal. La bacteriemia por gramnegativos o polimicrobiana causada por la migración de las larvas a través de la pared intestinal es otra presentación común de la infección diseminada, que favorece la incidencia de sepsis y meningitis por gérmenes gramnegativos, en especial Escherichia coli.4 Los signos y síntomas gastrointestinales más frecuentes son la pérdida de peso progresiva, diarrea crónica, dolor abdominal (duodenitis parasitaria) o vómitos, aunque la presentación clínica gastrointestinal es usualmente inespecífica, abarca un amplio rango de manifestaciones clínicas desde las formas asintomáticas u oligosintomáticas hasta la insuficiencia multiorgánica, que puede tener lugar décadas después de la infección primaria. Con respecto al compromiso respiratorio el paciente puede presentar tos, disnea, sibilancias (síndrome de Löeffler), hemoptisis y distrés respiratorio agudo; además puede haber fiebre asociada o no a los síntomas mencionados anteriormente.
La aparición de síntomas y signos como distrés respiratorio, infiltrados nuevos en la radiografía de tórax o ambos pueden ser manifestaciones de un síndrome de hiperinfestación por Strongyloides stercoralis, como en la paciente que se describe. La eosinofilia puede estar ausente y a veces hay eosinopenia, lo que representa un signo de mal pronóstico ya que se asocia con mayor riesgo de mortalidad.
La sensibilidad del examen de materia fecal es variable y depende del número de muestras analizadas. El estudio de una sola muestra puede perder el 70% o más de los casos debido a una carga parasitaria baja o a una excreción larvaria intermitente. La sensibilidad diagnóstica aumenta al 50% cuando se analizan tres muestras de materia fecal y es mayor del 90% con 7 muestras seriadas. La prueba de ELISA tiene valor secundario debido a que puede permanecer positiva por meses o años y tener reacción cruzada con otras especies de helmintos. El esputo y el lavado broncoalveolar son útiles para la identificación del parásito en las localizaciones pulmonares, como en el presente caso.
El tratamiento de las formas diseminadas de la enfermedad se basa en la combinación de albendazol 400 mg dos veces al día por 7 días e ivermectina 200 µg/kg/d por 1-2 días. El albendazol y la ivermectina deben mantenerse hasta que existan pruebas de la eliminación del parásito.3-6
Reconocer los antecedentes epidemiológicos y factores de riesgo es esencial para establecer el diagnóstico de las formas de hiperinfestación y diseminadas graves de esta geohelmintiasis. Para tal fin, deben efectuarse exámenes parasitológicos seriados y en fresco previos al inicio de tratamientos inmunosupresores, en especial en sujetos procedentes de áreas endémicas.
En el caso que se presenta, la paciente procedente de un área endémica se encontraba inmunodeprimida debido a la corticoterapia prolongada por su enfermedad de base (lupus eritematoso sistémico). A partir de este hecho, al no haberse detectado la infección por S. stercoralis (generalmente asintomática, como ya se dijo líneas arriba), evolucionó a un cuadro de hiperinfestación seguido de sepsis con insuficiencia multiorgánica que la llevó al óbito.
Los autores no manifiestan conflictos de intereses.
Gustavo Risso, 1417, Buenos Aires, Argentina,
e-mail: gustavodrisso@hotmail.com
1. Palmieri OJ y col. Enfermedades infecciosas. Edición 2005, Buenos Aires.
2. El manual Merck. Edición 2000.
3. Lim S, Katz K, Krajden S, Fuksa M, Keystone JS, Kain KC. Complicated and fatal Strongyloydes infection in Canadians: risk factors, diagnosis and management. CMAJ 171, 2004.
4. Fardet L, Généreu T, Cabene J, Kettaneh A. Severe strongyloidiasis in corticosteroid-treated patients. Clin Microbiol Infect 12:945-947, 2006.
5. Namisato S, Motomura K, Haranaga S, Hirata T, Toyama M, Shinzato T, Higa F, Saito A. Pulmonary strongyloidiasis in a patient receiving prednisolone therapy. Case report. Internal Medicine 43:731-736, 2004.
6. Setoyama M, Fukumaru S, Takasaki T, Yoshida H, Kanzaki T. SLE with death from acute massive pulmonary hemorrhage caused by disseminated strongyloidiasis. Case report. Scand J Rheumatol 26:389-91, 1997.
Está expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC.
ua91218
































