Casos Clínicos
DISNEA Y DERRAME PLEURAL IZQUIERDO MASIVO COMO PRESENTACION DE DISECCION DE AORTA DESCENDENTE
Se presenta el caso de un paciente que acudió a urgencias por disnea intensa. La historia clínica, la situación de bajo gasto cardíaco y el derrame pleural masivo serohemático llevaron a la sospecha de disección aórtica.
Coautores
Rafael Gólpe Gómez* Nieves Gonzalez Vidal**
Especialista en Neumología, Hospital Xeral Calde de Lugo, Lugo, España*
Especialista em Medicina Familiar y Comunitária, Hospital Comarcal de Monforte de Lemos, Lugo, España**
Rafael Gólpe Gómez* Nieves Gonzalez Vidal**
Especialista en Neumología, Hospital Xeral Calde de Lugo, Lugo, España*
Especialista em Medicina Familiar y Comunitária, Hospital Comarcal de Monforte de Lemos, Lugo, España**
Clasificación en siicsalud
Artículos originales > Expertos del Mundo >
página /dato/casiic.php/111908
Especialidades








Artículos originales > Expertos del Mundo >
página /dato/casiic.php/111908
Especialidades








Primera edición en siicsalud
16 de marzo, 2010
16 de marzo, 2010
DISNEA Y DERRAME PLEURAL IZQUIERDO MASIVO COMO PRESENTACION DE DISECCION DE AORTA DESCENDENTE
(especial para SIIC © Derechos reservados)
(especial para SIIC © Derechos reservados)
Introducción
La incidencia de la disección aórtica varía desde 5 a 30 casos por millón de personas/año. Si bien es una enfermedad poco frecuente, sus consecuencias catastróficas hacen que muchos pacientes fallezcan antes de presentarse en el hospital y ser diagnosticados. El dolor es el síntoma más común, pero hasta un tercio de pacientes presentan síntomas por afección de órganos en relación con la disección aórtica. Esto hace que la enfermedad sea proteiforme en su presentación y que sea necesario un alto índice de sospecha para un rápido diagnóstico. Presentamos el caso de un paciente que acudió a urgencias por disnea intensa. La historia clínica, la situación de bajo gasto cardíaco y el derrame pleural masivo serohemático llevaron a la sospecha de disección aórtica.
Caso clínico
Paciente varón de 65 años con hipertensión arterial conocida pero no tratada desde hacía unos 10 años. Sin otros antecedentes de interés. La mañana del día del ingreso presentó dolor intenso centro torácico, con irradiación a espalda, que se acompañaba de sudoración y mareo sin pérdida de conocimiento. Una hora después el dolor cedió en intensidad, por lo que el paciente decidió no solicitar asistencia médica. Unas diez horas más tarde el dolor, que había sido soportable hasta entonces, incrementó su intensidad, nuevamente era centrotorácico, lacerante, opresivo, irradiado a la espalda, acompañado de náuseas y sudoración profusa, así como de caída al suelo con pérdida de conciencia que dura unos segundos. Unas horas después comenzó con intensa disnea en reposo, por lo que el paciente acudió al servicio de urgencias.
A su llegada estaba consciente, orientado, no refería dolor. La presión arterial era 140/80 mm Hg, presentaba taquipnea (FR 32 rpm), sin uso de musculatura respiratoria accesoria, afebril, con una FC de 96 lpm. No presentaba ingurgitación yugular, la exploración de cabeza y cuello era normal. Llamaban la atención roncus difusos en hemotórax derecho con algún sibilante espiratorio y una marcada disminución del murmullo vesicular en hemitórax izquierdo. El abdomen y las extremidades no presentaban anomalías. La saturación con aire ambiente era de 89%. Se inició tratamiento urgente con oxigenoterapia, broncodilatadores nebulizados, hidrocortisona y diuréticos intravenosos.
Pruebas complementarias realizadas: hemograma: Hg 9.9 g/dl; VCM 91 fl; leucocitos: 14 600/µl con 83% de polimorfonucleares; plaquetas 248 000 / µl; coagulación normal, bioquímica urgente normal que incluía enzimas cardíacas y amilasa; dímero D 1 845 mg/l; gasometría arterial con 02 35%, p02 101 mm Hg, pC02 27 mm Hg, pH 7.17, HCO3 9 mmol/l; Sat 92%; EKG: ritmo sinusal con ocasionales complejos ventriculares; radiografía de tórax: imagen compatible con derrame pleural izquierdo masivo con desplazamiento de estructuras mediastínicas hacia la derecha (Figura 1). Estando en la sala de urgencias presentó caída de cifras tensionales. Se perfundieron expansores de plasma y suero, con lo que se logró estabilizar al paciente. Se realizó toracocentesis diagnóstica y se obtuvo un líquido hemático que drenó con dificultad y no se coagulaba.
La disección aórtica (DA) se clasifica como aguda si el diagnóstico se realiza antes de las dos semanas de comenzados los síntomas.1 Más de un tercio de los casos se consideran disecciones crónicas ya que el diagnóstico se retrasa más tiempo. Anatómicamente se usa con frecuencia la clasificación de Stanford,2 que considera disección tipo A aquella que afecta a la aorta ascendente y de tipo B a la disección que afecta la aorta distal a la salida de la arteria subclavia izquierda. Los hombres se ven afectados con más frecuencia que las mujeres, oscilando entre 2:1-5:1, según distintas series.3,4 La hipertensión arterial es el factor de riesgo más importante en pacientes mayores. En jóvenes, enfermedades del colágeno, incluyendo el síndrome de Marfan, el síndrome de Ehlers-Danlos, las vasculitis y otras malformaciones del anillo aórtico están asociadas a la disección aórtica. Los traumatismos directos sobre la aorta se han descrito tras cirugía o cateterismo. El consumo de cocaína también se ha relacionado con la presencia de disección aórtica en pacientes por lo demás sanos.5 La DA puede ocurrir por ruptura de la íntima y propagación de la disección hacia la capa media o por la formación de una hemorragia en la capa media, por degeneración de ésta y perforación posterior de la íntima.3 Este último mecanismo es más frecuente en pacientes mayores e hipertensos.
El dolor es el síntoma más frecuente en la DA. Generalmente es centrotorácico y anterior en las disecciones de aorta ascendente, en tanto que el dolor en la espalda y zona lumbar es más frecuente en las disecciones de aorta descendente. El dolor inicial puede ser seguido de un tiempo libre de dolor que puede ser de horas a días. El retorno del dolor tiene generalmente un carácter ominoso porque expresa progresión en la ruptura aneurismática.6 Más de un tercio de los pacientes presentan síntomas y signos por afección de órganos comprometidos por la isquemia que provoca la DA en alguna de las ramas arteriales que los irrigan. Entre otros cuadros se puede ver con frecuencia isquemia miocárdica, por oclusión coronaria o déficit neurológico por extensión de la disección en la aorta ascendente a las carótidas. En las disecciones de tipo B se puede ver isquemia esplénica, insuficiencia renal, isquemia de extremidades inferiores o déficit neurológicos debidos a la isquemia en la arteria espinal.1
El diagnóstico diferencial de la DA es amplio incluyendo el IAM, pericarditis, el tromboembolismo de pulmón, dolor musculoesquelético, pleuritis, colecistitis, perforación de víscera hueca, pancreatitis, etc. El diagnóstico de la DA se basa hoy en día en pruebas de imágenes. La radiología torácica convencional puede mostrar ensanchamiento mediastínico. Es la tomografía la prueba que en la actualidad diagnostica la mayor parte de casos de DA. Su sensibilidad varía entre 83% y 97%, con una especificidad del 87%. La resonancia magnética tiene también buena sensibilidad y especificidad, si bien el mayor inconveniente es la realización técnica con un paciente inestable. La ecocardiografía transesofágica tiene buen rendimiento diagnóstico, dada la cercanía entre el esófago y la aorta torácica. Requiere intubación esofágica pero es un método sencillo que se puede realizar junto a la cama del enfermo y que dará un diagnóstico en pocos minutos. Puede ser muy útil en pacientes inestables a los que no se les puede practicar una resonancia.7 En la actualidad no se dispone de un marcador especifico de DA pero son esperanzadores los resultados obtenidos con el análisis sérico de la miosina procedente del músculo liso.8
El derrame pleural masivo secundario a la rotura aneurismática y posterior vertido en la cavidad pleural ha sido descrito excepcionalmente. Los casos publicados en la literatura9-11 son parecidos al nuestro en cuanto a que afectaban a pacientes mayores e hipertensos y en los que el dolor torácico no fue el síntoma principal. En nuestro paciente es la disnea provocada por el derrame pleural masivo la que le hace acudir a urgencias. Inexplicablemente, a pesar de la intensidad del dolor inicial, el paciente no acudió al hospital al comienzo del cuadro. Es probable que en ese primer momento no existiera el derrame pleural y el diagnóstico diferencial se hubiese realizado en razón del dolor precordial.
Aprovechamos nuestro caso para subrayar la necesidad de pensar en la disección de aorta torácica ante un derrame pleural serohemático no traumático, incluso en ausencia de otras características clínicas típicas de esta entidad, lo cual redundará en un diagnóstico rápido, imprescindible en la lucha con una entidad de tan ominoso pronóstico.
Los autores no manifiestan conflictos de intereses.
La incidencia de la disección aórtica varía desde 5 a 30 casos por millón de personas/año. Si bien es una enfermedad poco frecuente, sus consecuencias catastróficas hacen que muchos pacientes fallezcan antes de presentarse en el hospital y ser diagnosticados. El dolor es el síntoma más común, pero hasta un tercio de pacientes presentan síntomas por afección de órganos en relación con la disección aórtica. Esto hace que la enfermedad sea proteiforme en su presentación y que sea necesario un alto índice de sospecha para un rápido diagnóstico. Presentamos el caso de un paciente que acudió a urgencias por disnea intensa. La historia clínica, la situación de bajo gasto cardíaco y el derrame pleural masivo serohemático llevaron a la sospecha de disección aórtica.
Caso clínico
Paciente varón de 65 años con hipertensión arterial conocida pero no tratada desde hacía unos 10 años. Sin otros antecedentes de interés. La mañana del día del ingreso presentó dolor intenso centro torácico, con irradiación a espalda, que se acompañaba de sudoración y mareo sin pérdida de conocimiento. Una hora después el dolor cedió en intensidad, por lo que el paciente decidió no solicitar asistencia médica. Unas diez horas más tarde el dolor, que había sido soportable hasta entonces, incrementó su intensidad, nuevamente era centrotorácico, lacerante, opresivo, irradiado a la espalda, acompañado de náuseas y sudoración profusa, así como de caída al suelo con pérdida de conciencia que dura unos segundos. Unas horas después comenzó con intensa disnea en reposo, por lo que el paciente acudió al servicio de urgencias.
A su llegada estaba consciente, orientado, no refería dolor. La presión arterial era 140/80 mm Hg, presentaba taquipnea (FR 32 rpm), sin uso de musculatura respiratoria accesoria, afebril, con una FC de 96 lpm. No presentaba ingurgitación yugular, la exploración de cabeza y cuello era normal. Llamaban la atención roncus difusos en hemotórax derecho con algún sibilante espiratorio y una marcada disminución del murmullo vesicular en hemitórax izquierdo. El abdomen y las extremidades no presentaban anomalías. La saturación con aire ambiente era de 89%. Se inició tratamiento urgente con oxigenoterapia, broncodilatadores nebulizados, hidrocortisona y diuréticos intravenosos.
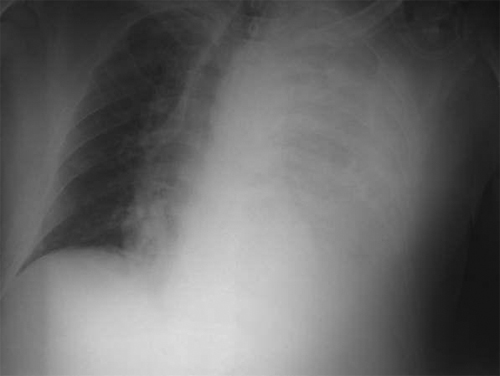
Pruebas complementarias realizadas: hemograma: Hg 9.9 g/dl; VCM 91 fl; leucocitos: 14 600/µl con 83% de polimorfonucleares; plaquetas 248 000 / µl; coagulación normal, bioquímica urgente normal que incluía enzimas cardíacas y amilasa; dímero D 1 845 mg/l; gasometría arterial con 02 35%, p02 101 mm Hg, pC02 27 mm Hg, pH 7.17, HCO3 9 mmol/l; Sat 92%; EKG: ritmo sinusal con ocasionales complejos ventriculares; radiografía de tórax: imagen compatible con derrame pleural izquierdo masivo con desplazamiento de estructuras mediastínicas hacia la derecha (Figura 1). Estando en la sala de urgencias presentó caída de cifras tensionales. Se perfundieron expansores de plasma y suero, con lo que se logró estabilizar al paciente. Se realizó toracocentesis diagnóstica y se obtuvo un líquido hemático que drenó con dificultad y no se coagulaba.

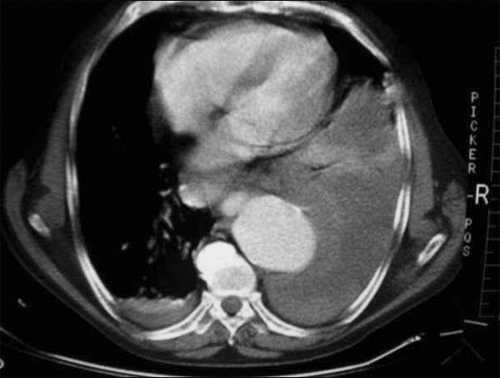
Figura 1Bioquímica líquido pleural: proteínas 4.7 mg/dl, glucosa 90 mg/dl, LDH 256 UI/l, leucocitos 2 300/µl e incontables hematíes. No se apreciaban gérmenes en la tinción de Gram. Ante el cuadro clínico de dolor centrotorácico intenso, la caída de tensión arterial, la anemia normocítica y el liquido hemático se sospechó rotura de aneurisma torácico por lo que se indicó tomografía computarizada de urgencia (Figura 2).

Figura 2Discusión
La disección aórtica (DA) se clasifica como aguda si el diagnóstico se realiza antes de las dos semanas de comenzados los síntomas.1 Más de un tercio de los casos se consideran disecciones crónicas ya que el diagnóstico se retrasa más tiempo. Anatómicamente se usa con frecuencia la clasificación de Stanford,2 que considera disección tipo A aquella que afecta a la aorta ascendente y de tipo B a la disección que afecta la aorta distal a la salida de la arteria subclavia izquierda. Los hombres se ven afectados con más frecuencia que las mujeres, oscilando entre 2:1-5:1, según distintas series.3,4 La hipertensión arterial es el factor de riesgo más importante en pacientes mayores. En jóvenes, enfermedades del colágeno, incluyendo el síndrome de Marfan, el síndrome de Ehlers-Danlos, las vasculitis y otras malformaciones del anillo aórtico están asociadas a la disección aórtica. Los traumatismos directos sobre la aorta se han descrito tras cirugía o cateterismo. El consumo de cocaína también se ha relacionado con la presencia de disección aórtica en pacientes por lo demás sanos.5 La DA puede ocurrir por ruptura de la íntima y propagación de la disección hacia la capa media o por la formación de una hemorragia en la capa media, por degeneración de ésta y perforación posterior de la íntima.3 Este último mecanismo es más frecuente en pacientes mayores e hipertensos.
El dolor es el síntoma más frecuente en la DA. Generalmente es centrotorácico y anterior en las disecciones de aorta ascendente, en tanto que el dolor en la espalda y zona lumbar es más frecuente en las disecciones de aorta descendente. El dolor inicial puede ser seguido de un tiempo libre de dolor que puede ser de horas a días. El retorno del dolor tiene generalmente un carácter ominoso porque expresa progresión en la ruptura aneurismática.6 Más de un tercio de los pacientes presentan síntomas y signos por afección de órganos comprometidos por la isquemia que provoca la DA en alguna de las ramas arteriales que los irrigan. Entre otros cuadros se puede ver con frecuencia isquemia miocárdica, por oclusión coronaria o déficit neurológico por extensión de la disección en la aorta ascendente a las carótidas. En las disecciones de tipo B se puede ver isquemia esplénica, insuficiencia renal, isquemia de extremidades inferiores o déficit neurológicos debidos a la isquemia en la arteria espinal.1
El diagnóstico diferencial de la DA es amplio incluyendo el IAM, pericarditis, el tromboembolismo de pulmón, dolor musculoesquelético, pleuritis, colecistitis, perforación de víscera hueca, pancreatitis, etc. El diagnóstico de la DA se basa hoy en día en pruebas de imágenes. La radiología torácica convencional puede mostrar ensanchamiento mediastínico. Es la tomografía la prueba que en la actualidad diagnostica la mayor parte de casos de DA. Su sensibilidad varía entre 83% y 97%, con una especificidad del 87%. La resonancia magnética tiene también buena sensibilidad y especificidad, si bien el mayor inconveniente es la realización técnica con un paciente inestable. La ecocardiografía transesofágica tiene buen rendimiento diagnóstico, dada la cercanía entre el esófago y la aorta torácica. Requiere intubación esofágica pero es un método sencillo que se puede realizar junto a la cama del enfermo y que dará un diagnóstico en pocos minutos. Puede ser muy útil en pacientes inestables a los que no se les puede practicar una resonancia.7 En la actualidad no se dispone de un marcador especifico de DA pero son esperanzadores los resultados obtenidos con el análisis sérico de la miosina procedente del músculo liso.8
El derrame pleural masivo secundario a la rotura aneurismática y posterior vertido en la cavidad pleural ha sido descrito excepcionalmente. Los casos publicados en la literatura9-11 son parecidos al nuestro en cuanto a que afectaban a pacientes mayores e hipertensos y en los que el dolor torácico no fue el síntoma principal. En nuestro paciente es la disnea provocada por el derrame pleural masivo la que le hace acudir a urgencias. Inexplicablemente, a pesar de la intensidad del dolor inicial, el paciente no acudió al hospital al comienzo del cuadro. Es probable que en ese primer momento no existiera el derrame pleural y el diagnóstico diferencial se hubiese realizado en razón del dolor precordial.
Aprovechamos nuestro caso para subrayar la necesidad de pensar en la disección de aorta torácica ante un derrame pleural serohemático no traumático, incluso en ausencia de otras características clínicas típicas de esta entidad, lo cual redundará en un diagnóstico rápido, imprescindible en la lucha con una entidad de tan ominoso pronóstico.
Los autores no manifiestan conflictos de intereses.
Alfonso Mateos Colino, Hospital Xeral Calde de Lugo Servicio de Medicina Interna, Lugo, España,
e-mail: alfonsomateos10@hotmail.com
1. Khan IA, Nair CK. Clinical, diagnostic, and management perspectives of aortic dissection. Chest 122:311-328, 2002.
2. Daily PO, Trueblood HW, Stinson EB et al. Management of acute aortic dissections. Ann Thorac Surg 10:237-24, 1970.
3. Wilson SK, Hutchins GM. Aortic dissecting aneurysms: causative factors in 204 subjects. Arch Pathol Lab Med 106:175-180, 1982.
4. Auer J, Berent R, Eber B et al. Aortic dissection: incidence, natural history and impact of surgery. J Clin Basic Cardiol 3:151-154, 2000.
5. Fisher A, Holroyd BR et al. Cocaine-associated dissection of the thoracic aorta. J Emerg Med 10:723-727, 2002.
6. Meszaros I, Morocz J, Szlavi J et al. Epidemiology and clinicopathology of aortic dissection. Chest 117:1271-78, 2000.
7. Cigarroa, JE, Isselbacher, EM, DeSanctis, RW, Eagle, KA. Diagnostic imaging in the evaluation of suspected aortic dissection. Old standards and new directions. N Engl J Med 328:35-43, 1993.
8. Suzuki T, Katoh H, Watanabe M, et al. Novel biochemical diagnostic method for aortic dissection. Results of a prospective study using immunoassay of smooth muscle myosin heavy chain. Circulation 93:1244-9, 1996.
9. Gandelman G, Barzilay N, Krupsky M et al. Left pleural hemorrhagic effusion. A presenting sign of thoracic aortic dissecting aneurysm. Chest 106(2):636-8, 1994.
10. Little S, Johnson J, Moon BY et al. Painless left hemorrhagic pleural effusion: An unusual presentation of dissecting ascending aortic aneurysm. Chest 116(5):1478-80, 1999.
11. Langin T, Kelkel PE, Villemot D. Left hemothorax, a complication of a dissecting aneurysm of the descending thoracic aorta. Rev Mal Respir 11(1):74-6, 1994.
Artículos publicados por el autor
(selección)
Mateos Colino A, Gólpe R, González Rodríguez A, González Juanatey C, Legarra JJ, Blanco M. Aspergillus pacemaker endocarditis presenting as pulmonary embolism Respirology 10(10):396-8, 2005
Mateos Colino A, Gólpe Gómez R, González Rodríguez A, Sousa Escandón A, González Uribarri C, Seirulo Salas M. Pneumoscrotum secondary to a massive subcutaneous emphysema after expontaneous pneumothorax drainage Actas Urol Esp 28(28):606-9, 2004
Mateos Colino A, Sousa Escandón MA, Gólpe Gómez R, García Figueras R, Pérez Valcarcel J, Fernández MA. Tuberculous epididymitis caused by Mycobacterium bovis Arch Esp Urol 56(56):175-8, 2003
Mateos Colino A, Gólpe R, García Figueiras R, Sousa A, Pérez Valcárcel J. Male with fever and left hypochondrial pain of several weeks duration Enferm Infecc Microbiol Clin 21(21):57-8, 2003
Mateos Colino A, Peña Miralles C, Ugartemendía C. Pneumococcal pericarditis treated successfully by pericardiocentesis An Med Interna 17(17):50-1, 2000
Mateos Colino A, Falo Zamora C, Mañer M, Fernández Viladrich P. Febrile syndrome and isolated pleural effusion as manifestation of Q fever Rev Clin Esp 196(196):800-1, 1996
Mateos Colino A, González Gay MA, Cereijo MJ, Santiago J, Rabuñal R, Brañas F. Neuro-Behçet: a follow-up of 4 cases treated with chlorambucil An Med Interna 12(12):600-2, 1995
Mateos Colino A, Flórez Gutiérrez J, Monte Secades R. Pleural effusion associated with vertebral osteomyelitis Arch Bronconeumol 31(31):430-1, 1995
Mateos Colino A, Monte Secades R, Ibáñez Alonso D, Santiago Toscano J, Rabuñal Rey R, Soilán del Cerro JL. Actinomyces as the etiology of empyema Arch Bronconeumol 31(31):293-5, 1995
Mateos Colino A, Gólpe R, González Rodríguez A, González Juanatey C, Legarra JJ, Blanco M. Aspergillus pacemaker endocarditis presenting as pulmonary embolism Respirology 10(10):396-8, 2005
Mateos Colino A, Gólpe Gómez R, González Rodríguez A, Sousa Escandón A, González Uribarri C, Seirulo Salas M. Pneumoscrotum secondary to a massive subcutaneous emphysema after expontaneous pneumothorax drainage Actas Urol Esp 28(28):606-9, 2004
Mateos Colino A, Sousa Escandón MA, Gólpe Gómez R, García Figueras R, Pérez Valcarcel J, Fernández MA. Tuberculous epididymitis caused by Mycobacterium bovis Arch Esp Urol 56(56):175-8, 2003
Mateos Colino A, Gólpe R, García Figueiras R, Sousa A, Pérez Valcárcel J. Male with fever and left hypochondrial pain of several weeks duration Enferm Infecc Microbiol Clin 21(21):57-8, 2003
Mateos Colino A, Peña Miralles C, Ugartemendía C. Pneumococcal pericarditis treated successfully by pericardiocentesis An Med Interna 17(17):50-1, 2000
Mateos Colino A, Falo Zamora C, Mañer M, Fernández Viladrich P. Febrile syndrome and isolated pleural effusion as manifestation of Q fever Rev Clin Esp 196(196):800-1, 1996
Mateos Colino A, González Gay MA, Cereijo MJ, Santiago J, Rabuñal R, Brañas F. Neuro-Behçet: a follow-up of 4 cases treated with chlorambucil An Med Interna 12(12):600-2, 1995
Mateos Colino A, Flórez Gutiérrez J, Monte Secades R. Pleural effusion associated with vertebral osteomyelitis Arch Bronconeumol 31(31):430-1, 1995
Mateos Colino A, Monte Secades R, Ibáñez Alonso D, Santiago Toscano J, Rabuñal Rey R, Soilán del Cerro JL. Actinomyces as the etiology of empyema Arch Bronconeumol 31(31):293-5, 1995
Está expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC.
ua91218






























