Casos Clínicos
INFECCION DISEMINADA POR MYCOBACTERIUM MALMOENSE EN UN PACIENTE INFECTADO POR EL VIRUS DE LA INMUNODEFICIENCIA HUMANA
Descripción del primer caso de infección respiratoria con infiltración hepática por Mycobacterium malmoense en un paciente cubano infectado por el virus de inmunodeficiencia humana.
Coautores
Carlos Fonseca* Lidunka Valdés* Daniel Pérez* Olga Pomier* Ernesto Hilario Montoro**
Hospital Nacional de Referencia para la atención a pacientes VIH/SIDA, La Habana, Cuba*
Centro Colaborador OPS/OMS, La Habana, Cuba**
Carlos Fonseca* Lidunka Valdés* Daniel Pérez* Olga Pomier* Ernesto Hilario Montoro**
Hospital Nacional de Referencia para la atención a pacientes VIH/SIDA, La Habana, Cuba*
Centro Colaborador OPS/OMS, La Habana, Cuba**
Clasificación en siicsalud
Artículos originales > Expertos del Mundo >
página /dato/casiic.php/102716
Especialidades






Artículos originales > Expertos del Mundo >
página /dato/casiic.php/102716
Especialidades






Primera edición en siicsalud
17 de noviembre, 2009
17 de noviembre, 2009
INFECCION DISEMINADA POR MYCOBACTERIUM MALMOENSE EN UN PACIENTE INFECTADO POR EL VIRUS DE LA INMUNODEFICIENCIA HUMANA
(especial para SIIC © Derechos reservados)
(especial para SIIC © Derechos reservados)
Introducción
En 1977 se describió Mycobacterium malmoense, especie de crecimiento lento no cromogénica, perteneciente al Grupo III en la clasificación de Runyon; mayoritariamente se aísla de infecciones pulmonares, también como agente causal de linfadenitis. Durante algunas décadas esta especie se restringía geográficamente a Europa, pero después de la pandemia producida por el virus de inmunodeficiencia humana (VIH), esta especie micobacteriana también se ha expandido geográficamente 1-4
El objetivo de este trabajo es describir el primer caso de infección respiratoria con infiltración hepática por Mycobacterium malmoense en un paciente cubano infectado por el virus de inmunodeficiencia humana.
Caso clínico
Paciente varón de 56 años de edad con antecedentes de asma bronquial, que ingresa en julio de 2003 en el Hospital Nacional de Referencia para la atención a pacientes con VIH/sida del Instituto de Medicina Tropical “Pedro Kourí” (IPK), con diagnóstico clínico de neumopatía inflamatoria bilateral y sospecha de infección por VIH (contacto sexual desprotegido con paciente diagnosticado VIH+). Se confirma diagnóstico de infección por VIH 1. Presentaba un recuento global de linfocitos T CD4+ de 390 células/mm3; se le tomaron repetidas muestras de esputo para descartar la presencia de bacilos ácido-alcohol resistentes (BAAR), los exámenes directos fueron negativos y la prueba cutánea de tuberculina tuvo lectura de 0 mm. Se impone tratamiento con antibióticos de amplio espectro lográndose resolución del cuadro respiratorio, egresa 2 semanas después sin ningún síntoma clínico.
En marzo de 2004 el recuento de linfocitos T CD4+ comenzó a descender hasta 92 células/mm3 (4%) por lo que se decidió iniciar terapia antirretroviral de gran actividad (TARGA) con zidovudina, lamivudina e indinavir. El paciente ingresa nuevamente en junio de ese mismo año con diarrea crónica y poca respuesta al tratamiento antirretroviral. Se comprueba mala adhesión a la TARGA, por lo que se realiza cambio de tratamiento utilizando estavudina, lamivudina y nevirapina. Durante el período 2004 a 2006 continuó presentando diarrea crónica intermitente y varios procesos respiratorios a repetición que mejoraban con tratamiento antimicrobiano. Los diferentes exámenes directos y de cultivo de la muestra de esputo en busca de BAAR siguieron dando resultado negativo.
En septiembre de 2006, por cultivo de una muestra de esputo se detecta presencia de BAAR, con codificación 6, por lo que reingresó en nuestro hospital esta vez con tos húmeda, fiebre y disnea. Al examen físico se constataban crepitantes en ambas bases pulmonares, además de una acentuada ictericia y hepatomegalia. La radiografía de tórax puso de manifiesto un infiltrado de aspecto inflamatorio en ambas bases pulmonares y discreto ensanchamiento del mediastino. Los exámenes complementarios dieron los siguientes resultados: Hb 98 g/l; leucocitos 3.1x109/l; eritrosedimentación 72 mm/h; TGP 103 U/l; TGO 159 U/l; bilirrubina total 32 mmol/l; bilirrubina directa 19 mmol/l; LDH 262 U/l; creatinina 88 µmol/l; urea 6.4 mmol/l; colesterol 93 mg%; glucemia 4.1 mmol/l; Ags HVB (+); Age HVB (+); Ac HVC (+); recuento de células T CD4+ 76 cel/mm3 (5%) y carga viral 280 000 copias/ml. Se realizó además ultrasonido abdominal que demostró la presencia de hepatomegalia con marcado aumento de la ecogenicidad hepática. Se inició tratamiento para tuberculosis pulmonar con isoniacida, rifampicina, pirazinamida y etambutol y nuevamente se cambió la TARGA por tenofovir, lamivudina y saquinavir + ritonavir.
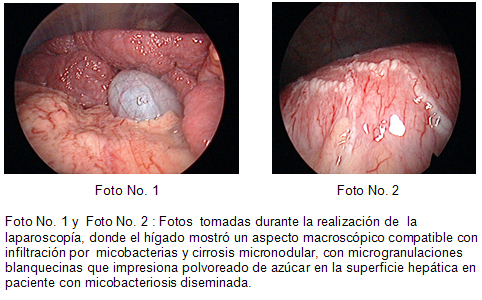
Tres semanas después de iniciado el tratamiento, el paciente había experimentado sólo una muy ligera mejoría clínico-radiológica, los síntomas hepáticos siguieron y se decide realizar una laparoscopia en la cual el hígado mostró un aspecto macroscópico compatible con infiltración por micobacterias y cirrosis micronodular; se tomó biopsia de tejido, el cual se envió al Laboratorio Nacional de Referencia e Investigaciones de TB y Micobacterias del IPK, para descartar la presencia de BAAR para ser cultivada (Figuras 1 y 2).
Todas las muestras de esputo y la de biopsia de tejido hepático fueron tratadas según las técnicas diagnósticas establecidas, los cultivos fueron incubados a 37ºC. Las lecturas de los cultivos se realizaron cada 7 días. A partir de las 3-4 semanas se obtuvo en todos los tubos de cultivo el aislamiento de colonias no pigmentadas de crecimiento lento, la codificación de los cultivos osciló entre 4 y 7 (Figura 3).

Para detectar la presencia de BAAR se realizó tinción de Zielh-Neelsen a partir de las colonias. Para la clasificación e identificación de la cepa aislada se utilizaron pruebas bioquímicas convencionales. Para la confirmación diagnóstica se utilizó el análisis del patrón de las fracciones de ácidos micólicos micobacterianos mediante la utilización de la técnica de cromatografía en capa delgada, según recomienda la literatura.1-5 La cepa micobacteriana aislada fue clasificada como perteneciente al Grupo III de Runyon e identificada como Mycobacterium malmoense. Este diagnóstico fue confirmado cuando el patrón de las fracciones de ácidos micólicos que se obtuvo fue de: alfa micolato y cetomicolato, además de la mancha característica de los ésteres metílicos de ácidos grasos.6 A partir de los resultados obtenidos por el laboratorio de micobacteriología se suspende tratamiento antituberculoso y se inicia tratamiento específico con claritromicina 500 mg/12 h, rifampicina 600 mg/24 h, etambutol 15 mg/kg de peso/24 h y ciprofloxacina 500 mg/12 h. Se asocia además interferón gamma recombinante y ribavirina al tratamiento, pues la reacción en cadena de la polimerasa (PCR) para virus de hepatitis C también fue positiva. El 2 de enero de 2007 el paciente ingresa en nuestra institución para realizar un nuevo chequeo clínico, ya estaba completamente asintomático y con mejoría significativa de las pruebas de función hepática y la radiografía de tórax mostraba la reabsorción total de todas las lesiones inflamatorias. Discusión Durante muchos años la descripción de enfermedades producidas por micobacterias no tuberculosas, atípicas, ambientales u oportunistas era casi anecdótica. Este concepto cambia a partir de las últimas décadas, hoy en día son entidades muy frecuentes, a partir del incremento mundial de pacientes inmunodeficientes después de la aparición de la pandemia del sida.7 Las micobacterias atípicas, ambientales u oportunistas están ampliamente distribuidas en el medio ambiente, sobre todo en el agua y en la tierra, sus principales reservorios. La transmisión persona a persona es rara, y los mecanismos de transmisión más aceptados son la aerosolización de microorganismos del medio ambiente, en la afección respiratoria, y su ingestión por vía digestiva, en el caso de la linfadenitis en niños y en las formas diseminadas de los pacientes con sida. En una gran mayoría de los países desarrollados se ha descrito un aumento importante en la incidencia de micobacteriosis por micobacterias ambientales u oportunistas, incluso en niños; esto se ha relacionado con diferentes factores como el incremento en la prevalencia de la enfermedad pulmonar obstructiva crónica, la mejora de las técnicas de diagnóstico, la naturaleza de los microorganismos, el aumento del reconocimiento clínico de la enfermedad y de su descripción en pacientes inmunocomprometidos, con neoplasias, receptores de trasplantes, por la administración de esteroides y sobre todo por el advenimiento de la epidemia del VIH.7-11 Datos epidemiológicos demuestran que en estos últimos años ha habido un significativo incremento de la incidencia de micobacteriosis por gérmenes oportunistas, no sólo en pacientes infectados por el virus de inmunodeficiencia humana sino también en los pacientes VIH negativos. Las formas clínicas más frecuentes son las pulmonares; sin embargo, específicamente en este grupo de riesgo, son también frecuentes las manifestaciones extrapulmonares e infecciones diseminadas, precisamente por el deterioro de su barrera inmunitaria.11-14 Los pacientes VIH positivos suelen presentar formas diseminadas, los raros casos con enfermedad localizada acostumbran a tener una mejor situación inmunitaria, aunque debemos destacar que desde la introducción del tratamiento antirretroviral de gran actividad (TARGA) es posible encontrar formas de enfermedad menos agresivas, por lo que se hace evidente que si se mejora el estado inmunitario de los enfermos en general, sean o no VIH positivos, mejorará también la respuesta terapéutica a las infecciones por micobacterias ambientales u oportunistas y la supervivencia. En pacientes con tratamiento antirretroviral también se han descrito presentaciones clínicas atípicas que característicamente aparecen en las primeras semanas de tratamiento. La infección micobacteriana suele manifestarse con fiebre elevada y progresivamente se desarrollan linfadenopatías cutáneas o viscerales y, ocasionalmente, hepatitis, osteomielitis o infecciones pulmonares o gastrointestinales localizadas; estas manifestaciones se describen dentro de las llamadas enfermedades de reconstrucción inmunitaria. El diagnóstico de confirmación de estas infecciones requiere el aislamiento del agente causal a partir de alguna muestra clínica.14-18 En la literatura han sido varios los informes de micobacteriosis producidas por Mycobacterium malmoense; a pesar de que esta especie no es de las de mayor índice de aislamiento, casi siempre M. malmoense se ha descrito asociada a pacientes con algún tipo de inmunocompromiso en cuadros clínicos respiratorios; sin embargo, en los niños esta especie ha sido mayormente asociada a cuadros de linfadenitis.11,17-21 Este estudio reafirma la importancia de fusionar los métodos convencionales establecidos para la clasificación e identificación micobacteriana con métodos diagnósticos alternativos como es el estudio del patrón de las fracciones de ácidos micólicos, pues esta herramienta aporta una reafirmación diagnóstica.2,4,6 Se recomienda mantener especial interés en todos los aislamientos micobacterianos en pacientes inmunodeficientes, y merece que los clínicos comiencen a sospechar de estos patógenos oportunistas, para solicitar su aislamiento, y en especial en los pacientes VIH positivos, pues por el deterioro de su barrera de defensa, las consecuencias clínicas en ellos son impredecibles y en muchos casos mortales.
Los autores no manifiestan conflictos de intereses.

Todas las muestras de esputo y la de biopsia de tejido hepático fueron tratadas según las técnicas diagnósticas establecidas, los cultivos fueron incubados a 37ºC. Las lecturas de los cultivos se realizaron cada 7 días. A partir de las 3-4 semanas se obtuvo en todos los tubos de cultivo el aislamiento de colonias no pigmentadas de crecimiento lento, la codificación de los cultivos osciló entre 4 y 7 (Figura 3).

Para detectar la presencia de BAAR se realizó tinción de Zielh-Neelsen a partir de las colonias. Para la clasificación e identificación de la cepa aislada se utilizaron pruebas bioquímicas convencionales. Para la confirmación diagnóstica se utilizó el análisis del patrón de las fracciones de ácidos micólicos micobacterianos mediante la utilización de la técnica de cromatografía en capa delgada, según recomienda la literatura.1-5 La cepa micobacteriana aislada fue clasificada como perteneciente al Grupo III de Runyon e identificada como Mycobacterium malmoense. Este diagnóstico fue confirmado cuando el patrón de las fracciones de ácidos micólicos que se obtuvo fue de: alfa micolato y cetomicolato, además de la mancha característica de los ésteres metílicos de ácidos grasos.6 A partir de los resultados obtenidos por el laboratorio de micobacteriología se suspende tratamiento antituberculoso y se inicia tratamiento específico con claritromicina 500 mg/12 h, rifampicina 600 mg/24 h, etambutol 15 mg/kg de peso/24 h y ciprofloxacina 500 mg/12 h. Se asocia además interferón gamma recombinante y ribavirina al tratamiento, pues la reacción en cadena de la polimerasa (PCR) para virus de hepatitis C también fue positiva. El 2 de enero de 2007 el paciente ingresa en nuestra institución para realizar un nuevo chequeo clínico, ya estaba completamente asintomático y con mejoría significativa de las pruebas de función hepática y la radiografía de tórax mostraba la reabsorción total de todas las lesiones inflamatorias. Discusión Durante muchos años la descripción de enfermedades producidas por micobacterias no tuberculosas, atípicas, ambientales u oportunistas era casi anecdótica. Este concepto cambia a partir de las últimas décadas, hoy en día son entidades muy frecuentes, a partir del incremento mundial de pacientes inmunodeficientes después de la aparición de la pandemia del sida.7 Las micobacterias atípicas, ambientales u oportunistas están ampliamente distribuidas en el medio ambiente, sobre todo en el agua y en la tierra, sus principales reservorios. La transmisión persona a persona es rara, y los mecanismos de transmisión más aceptados son la aerosolización de microorganismos del medio ambiente, en la afección respiratoria, y su ingestión por vía digestiva, en el caso de la linfadenitis en niños y en las formas diseminadas de los pacientes con sida. En una gran mayoría de los países desarrollados se ha descrito un aumento importante en la incidencia de micobacteriosis por micobacterias ambientales u oportunistas, incluso en niños; esto se ha relacionado con diferentes factores como el incremento en la prevalencia de la enfermedad pulmonar obstructiva crónica, la mejora de las técnicas de diagnóstico, la naturaleza de los microorganismos, el aumento del reconocimiento clínico de la enfermedad y de su descripción en pacientes inmunocomprometidos, con neoplasias, receptores de trasplantes, por la administración de esteroides y sobre todo por el advenimiento de la epidemia del VIH.7-11 Datos epidemiológicos demuestran que en estos últimos años ha habido un significativo incremento de la incidencia de micobacteriosis por gérmenes oportunistas, no sólo en pacientes infectados por el virus de inmunodeficiencia humana sino también en los pacientes VIH negativos. Las formas clínicas más frecuentes son las pulmonares; sin embargo, específicamente en este grupo de riesgo, son también frecuentes las manifestaciones extrapulmonares e infecciones diseminadas, precisamente por el deterioro de su barrera inmunitaria.11-14 Los pacientes VIH positivos suelen presentar formas diseminadas, los raros casos con enfermedad localizada acostumbran a tener una mejor situación inmunitaria, aunque debemos destacar que desde la introducción del tratamiento antirretroviral de gran actividad (TARGA) es posible encontrar formas de enfermedad menos agresivas, por lo que se hace evidente que si se mejora el estado inmunitario de los enfermos en general, sean o no VIH positivos, mejorará también la respuesta terapéutica a las infecciones por micobacterias ambientales u oportunistas y la supervivencia. En pacientes con tratamiento antirretroviral también se han descrito presentaciones clínicas atípicas que característicamente aparecen en las primeras semanas de tratamiento. La infección micobacteriana suele manifestarse con fiebre elevada y progresivamente se desarrollan linfadenopatías cutáneas o viscerales y, ocasionalmente, hepatitis, osteomielitis o infecciones pulmonares o gastrointestinales localizadas; estas manifestaciones se describen dentro de las llamadas enfermedades de reconstrucción inmunitaria. El diagnóstico de confirmación de estas infecciones requiere el aislamiento del agente causal a partir de alguna muestra clínica.14-18 En la literatura han sido varios los informes de micobacteriosis producidas por Mycobacterium malmoense; a pesar de que esta especie no es de las de mayor índice de aislamiento, casi siempre M. malmoense se ha descrito asociada a pacientes con algún tipo de inmunocompromiso en cuadros clínicos respiratorios; sin embargo, en los niños esta especie ha sido mayormente asociada a cuadros de linfadenitis.11,17-21 Este estudio reafirma la importancia de fusionar los métodos convencionales establecidos para la clasificación e identificación micobacteriana con métodos diagnósticos alternativos como es el estudio del patrón de las fracciones de ácidos micólicos, pues esta herramienta aporta una reafirmación diagnóstica.2,4,6 Se recomienda mantener especial interés en todos los aislamientos micobacterianos en pacientes inmunodeficientes, y merece que los clínicos comiencen a sospechar de estos patógenos oportunistas, para solicitar su aislamiento, y en especial en los pacientes VIH positivos, pues por el deterioro de su barrera de defensa, las consecuencias clínicas en ellos son impredecibles y en muchos casos mortales.
Los autores no manifiestan conflictos de intereses.
Lilian María Mederos Cuervo, Centro Colaborador OPS/OMS Laboratorio Nacional de Referencia e Investigaciones de Micobacterias y Tuberculosis, La Habana, Cuba,
e-mail: mederos@ipk.sld.cu
1. Schröder KH, Juhlin I. Mycobacterium malmoense sp. Nov Int J Syst Bacterial 27:241-246, 1977.
2. Casal M, Guerrero A, Martín N, Moreno S, Nogales MC. Diagnóstico microbiológico de las infecciones por micobacterias. En: Picazo JJ, editor. Procedimientos en microbiología clínica, Servicio de Publicaciones, Facultad de Medicina, Universidad de Córdova, pp. 20-22, 1999.
3. Portaels F, Deneb M, Larsson L. Pulmonary disease caused by Mycobacterium malmoense. Comments on the possible origin of infection and methods for laboratory diagnosis. Tubercle 72:218-222, 1991.
4. Medina MV, Sauret J, Caminero JA. Enfermedades producidas por micobacterias ambientales. Méd Clin 113:621-630, 1999.
5. Cosma CL, Sherman DR, Ramakrishnan L. The secret lives of the pathogenic mycobacteria. Annu Rev Microbiol 57:641-676, 2003.
6. Leite CQF, Souza CWO, Leite SRA. Identification of mycobacteria by thin layer chromatographic analysis of mycolic acid and conventional biochemical method: Four years of experience. Mem Inst Oswaldo Cruz 93:801-805, 1998.
7. Casal M. Cómo denominar a las micobacterias diferentes a Mycobacterium tuberculosis y a Mycobacterium leprae. Enferm Infecc Microbiol Clin 21:296-298, 2003.
8. Brown-Elliot BA, Wallace RJ. Clinical and taxonomic status of pathogenic nonpigmented or late-pigmenting rapidly growing mycobacteria. Clin Microbiol Rev 15:716-746, 2002.
9. Fabbri J, Welge-Lussen A, Frei R, Zimmerli W. Mycobacterium malmoense bei einem Kind: Fallbeschreibung und differential diagnose der zervikalen Lymphadenitis und Lymphadenopatients. Schweiz Med Wochenschr 123:1756-1761, 1993.
10. Olsen RJ, Cernoch PL, Land GA. Mycobacterial synovitis caused by slow-growing nonchromogenic species: eighteen cases and a review of the literature. Arch Pathol Lab Med 130:783-791, 2006.
11. Baquero-Artigao F. Infección pediátrica por micobacterias no tuberculosas. An Pediatr (Barc) 5:458-466, 2005.
12. Schmoor P, Descamps V, Lebrun-Vignes B, Crack B, Grossin M, Nouhouayi A, Belaich S. Mycobacterium malmoense cutaneous infection in an immunocompetent patient. Ann Dermatol Venereol 128:139-40, 2001.
13. Chocarra A, González-López A, Breznes MF, Ricart A. Disseminated infection due to Mycobacterium malmoense in a patient infected with human immunodeficiency virus. Clin Infect Dis 19:203-204, 1994.
14. Connolly MJ, Magee JG, Hendrick DJ, Jenkins PA. Mycobacterium malmoense in the north-east of England. Tubercle 66:211-217, 1985.
15. Hoffner SE, Henriques B, Petrini B, Källenius G. Mycobacterium malmoense: An easily missed pathogen. J Clin Microbiol 29:2673-2674, 1991.
16. Cosma CL, Sherman DR, Ramakrishnan L. The secret lives of the pathogenic mycobacteria. Annu Rev Microbiol 57:641-76, 2003.
17. Mederos LM, González D, Pérez Daniel, Paneque A, Montoro EH. Linfadenitis causada por Mycobacterium malmoense en paciente infectado con el virus de inmunodeficiencia humana. Rev Chil Infect 21:229-231, 2004.
18. Mederos LM, Frantz JL, Perovani MA, Montoro EH. Identificación de micobacterias no tuberculosas en pacientes VIH/SIDA por métodos convencionales y de las fracciones de los ácidos micólicos. RSVM 27:50-53, 2007.
19. Maddock C, Pariente CM. How does stress affect you? An overview of stress, immunity,depression and disease. Epidemiol Psichiatr Soc 10:153-162, 2001.
20. Randall J, Olsen MD, Cernoch MT, Geoffrey A. Mycobacterial synovitis caused by slow-growing nonchromogenic species:eighteen cases and a review of the literature. Arch Pathol Lab Med 6:783-791, 2006.
21. Martínez-Moragón E., Menéndez R, Palasí P, Santos M, López Aldeguer. Enfermedades por micobacterias ambientales en pacientes con y sin infección por el VIH: características epidemiológicas, clínicas y curso evolutivo. Arch Bronconeumol 37:281-286, 2001.
Está expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC.
ua91218































